Ела Кац
1 Училище по растителни науки и продоволствена сигурност, Университет в Тел Авив, Тел Авив, Израел
2 Катедра по растителни науки, Калифорнийски университет, Дейвис, САЩ
София Нисани
1 Училище по растителни науки и продоволствена сигурност, Университет в Тел Авив, Тел Авив, Израел
Даниел А. Чамовиц
1 Училище по растителни науки и продоволствена сигурност, Университет в Тел Авив, Тел Авив, Израел
Резюме
Диета, богата на кръстоцветни зеленчуци като карфиол, броколи и зеле, отдавна се счита за здравословна и различни епидемиологични проучвания показват, че консумацията на кръстоцветни зеленчуци допринася за диета, предпазваща от рак. Докато тези зеленчуци съдържат широк спектър от фитохимикали, механизмът, по който тези зеленчуци противодействат на рака, все още е до голяма степен неразрешен. Многобройни in situ проучвания включват индол-3-карбинол, продукт на разпадане на глюкозинолат индол-3-илметилглюкозинолат, като един от фитохимикалите с противоракови свойства. Индол-3-карбинол влияе върху редица клетъчни процеси, но механизмите, по които той действа върху раковите клетки, се разкриват бавно. Последните проучвания за ролята на индол-3-карбинола в Arabidopsis отварят вратата за сравнения между кралствата, които могат да помогнат за разбирането на ролята на този важен фитохормон както в растителната биология, така и в борбата с рака.
Въведение
Диета, богата на кръстоцветни зеленчуци като карфиол, броколи и зеле, отдавна се смята за здравословна. Още в древни времена се е смятало, че екстрактите от тези зеленчуци имат лечебни и лечебни свойства и както Питагор, така и Хипократ са разбирали лечебните свойства на екстрактите от горчица 1. През 20-ти век започват да се натрупват епидемиологични проучвания, сочещи защитните свойства на кръстоцветните зеленчуци в диета, предпазваща от рак 2. Мета-анализ на проучвания, проведени в продължение на 18 години в Европа, разкри обратна връзка между седмичната консумация на кръстоцветни зеленчуци и няколко често срещани видове рак, включително рак на дебелото черво, гърдата, бъбреците и горната част на храносмилателния тракт 3. Докато тези зеленчуци съдържат широк спектър от фитохимикали 4, механизмът, по който тези зеленчуци противодействат на рака, все още е до голяма степен неразрешен.
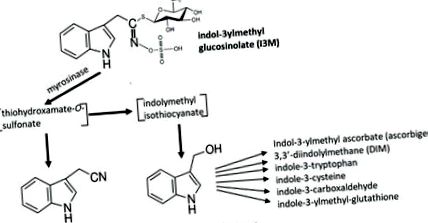
Разграждането на индол-3-илметилглюкозинолат (I3M-GS), един от най-широко разпространените глюкозинолати, води до образуването на индол-3-ацетонитрил (I3N) и индол-3-карбинол (I3C) (Фигура 1) 13. I3C от своя страна може да реагира със себе си и с различни други растителни метаболити, за да образува конюгати, някои от които са показани на фигура 1. Повечето от тези I3C конюгати имат все още неизвестни функции в метаболизма на растенията, въпреки че, интересното е, че друга функция на продуктите на разпадане на глюкозинолат може да бъде да сигнализират за допълнителни реакции на защитата на растенията 14. Следователно е възможно разпадането на I3M-GS да задейства и други отговори надолу по веригата при Arabidopsis и други кръстоцветни.
Фигура 1.
Катализирана от мирозиназа разграждане на I3M-GS води до образуването на нестабилни междинни продукти и след това до индол-3-ацетонитрил (I3N) и индол-3-карбионол (I3C). I3C реагира със себе си и други растителни метаболити, образувайки редица конюгати, някои от които са показани.
От диетична гледна точка готвенето на зеленчуци влияе върху профила им на разграждане на глюкозинолат 15. Кипенето води до инактивиране на ензима мирозиназа, но може да доведе и до не-ензимно разграждане на I3M-GS до I3C и I3N 16. В допълнение, човешките чревни микроби могат да доведат до разграждане на глюкозинолат 17 .
Индол-3-карбинол и рак
Продуктите от разграждането на глюкозинолатите, а не непокътнатите глюкозинолати, допринасят главно за антиканцерогенните ефекти на яденето на зеле, броколи и сродни зеленчуци 11, 12, 18. I3C отдавна е изследван по отношение на потенциалните роли в управлението на рака 19, 20 и много проучвания показват, че I3C потиска разпространението на различни ракови клетъчни линии, включително ракови клетки на гърдата, дебелото черво, простатата и ендометриума (прегледани в 19, 21). Един пример за неговите анти-пролиферативни свойства идва от проучване, проведено върху нетуморогенни и туморогенни епителни клетки на гърдата (MCF10A и MCF10CA1a, съответно), което показва, че I3C индуцира апоптоза в клетките на рака на гърдата, но не и в не-туморогенния епител на гърдата клетки 22. I3C и един от реакционните му продукти, дииндолилметан (DIM), са замесени в индукцията на ензими за детоксикация фаза 1, което може да доведе до разграждане на други хранителни канцерогени. Както in situ, така и in vivo проучванията сочат ролята на I3C като хемопротективен агент при рак на гърдата и простатата 23 .
Проучванията in vivo показват, че I3C инхибира развитието на различни видове рак при няколко животни, когато се дава преди или успоредно с канцероген. Въпреки това, когато I3C се дава на животните след канцерогена, I3C насърчава канцерогенезата 48. Тази загриженост относно дългосрочните ефекти на лечението с I3C върху риска от рак при хората доведе до известна предпазливост при използването на I3C като хранителна добавка в протоколите за управление на рака 49, 50 .
Клетъчните процеси на бозайниците, приписани на действието на I3C, са толкова разнообразни, колкото различните фенотипове, представени от многото изследвани видове рак. Всъщност фокусирането върху ефектите на I3C върху един вид рак (напр. Рак на гърдата) може да доведе до плейотропни ефекти за I3C върху множество молекулярни цели (прегледани в 51), които могат да се различават от тези, представени при друг тип рак. Въпреки че не се обмисля често, за да се получи различна гледна точка за действието на I3C в клетките като цяло, може да е поучително да се поучим от активността на I3C в растенията.
Индол-3-карбинол и растения
Моделното растение Arabidopsis thaliana осигурява отлична система за изясняване на молекулярните механизми, участващи в действието на I3C, тъй като 1) произвежда I3C ендогенно след тревопасните, 2) малки количества I3C се произвеждат конститутивно в корените, намеквайки за ендогенна роля в поддържането на хомеостазата и 3) неговият кратък жизнен цикъл и малък ръст, съчетан с усъвършенствани налични генетични и геномни ресурси, правят Arabidopsis отлична моделна система не само за биологията на растенията, но и за еукариотните изследвания като цяло 52 .
Докато ролята на I3C в възпирането на тревопасните животни е добре проучена 53, както и биохимичният път, водещ до производството на I3C 13, вторичните реакции в растенията, индуцирани от I3C, едва сега започват да се разкриват. Нашите скорошни проучвания подчертават, че I3C е не само защитен химикал, насочен към тревопасните животни, но и сигнална молекула, модулираща различни клетъчни пътища и пътища на развитие.
Използвайки Arabidopsis като моделна система, ние показахме, че екзогенно прилаганият I3C бързо и обратимо инхибира удължаването на корена по дозозависим начин 54. Това инхибиране беше придружено от три I3C-индуцирани отговора, които са от значение за нашето разбиране на I3C активността при инхибиране на рака.
Първо, приложението на I3C доведе до спиране на клетъчното делене в кореновата меристема (Фигура 2А). Докато обикновено редица CycB1-експресиращи клетки са видими в кореновата меристема, след третиране с I3C, не са открити CycB1-съдържащи клетки, което показва прекратяване на клетъчното делене. Това заключение се подкрепя от резултатите от профилирането на транскриптите, показващи понижаването на регулирането на гените на клетъчния цикъл шест часа след излагане на I3C 55 .
Анализът на сортирано с флуоресценция клетъчно сортиране (FACS) върху ядра, изолирани от върховете на корените, допълнително показва спиране на клетъчния цикъл. Както се вижда на Фигура 2В, три различни популации от ядра се откриват в необработени корени, съответстващи на 2n, 4n и 8n ядра. След лечение с I3C обаче има прогресивна загуба на популациите 4n и 8n, с едновременно увеличение на клетките с повишено странично разсейване (популация В).
Фигура 2.
A. Конфокалното изображение разкрива липса на клетки, експресиращи Cyclin B-GFP след третиране с I3C. Фиданки, експресиращи Cyclin B-GFP, се отглеждат на среда Murashige и Skoog (MS) в продължение на 4 дни, третират се с MS (ляв панел) или 500 μm I3C (десен панел) в продължение на 6 часа и се изобразяват с помощта на конфокална микроскопия. Клетъчните стени се оцветяват с пропидиев йодид. Б.. Анализът на сортирано с флуоресценция клетъчно сортиране (FACS) разкрива промени в ядрената сложност след третиране с I3C. Ядрата бяха изолирани от корените на Arabidopsis, третирани с MS или MS плюс I3C за отбелязаните времена между 0 и 15 часа и анализирани чрез FACS за съдържание на ДНК (FL2-A = пропидиев йодид флуоресценция) и ядрена сложност (SCC-H = светлинен разсейване) . Зелената, лилавата и синята кутия представляват популациите, които се различават според ядреното съдържание, съответно 2n, 4n и ендорепликационната популация (8n). Червените кутии представляват две популации от ядра (" A" и " Б."), които се различават според страничното разсейване.
Второ, прилагането на I3C доведе до загуба на активност на ауксин (индол-3-оцетна киселина [IAA]) в кореновата меристема 54. Ауксинът е най-централният растителен хормон, контролиращ почти всички аспекти на растежа и развитието на растенията 56. I3C влияе върху растежа и развитието на растенията, като директно модулира ауксиновата сигнализация. I3C антагонизира редица фенотипове на индуциран от ауксин растеж, включително инхибиране на удължаването на корените, образуване на коренови косми и вторично разклоняване на корените. I3C директно пречи на зависимото от ауксин свързване на реакцията на транспортния инхибитор на ауксин-рецептора (TIR1) към два от неговите субстрати 54. Рецепторът за ауксин TIR1 е субединица, съдържаща F-кутия на SCF (Skp, Cullin, F-box) E3 убиквитин лигазен комплекс. Свързването на ауксин с SCF TIR1/AFB насърчава разграждането на транскрипционните репресори на ауксин/индол-3-оцетна киселина (Aux/IAA) и чрез това регулира транскрипцията на индуцираните от ауксина гени 57. I3C инхибира зависимата от ауксин димеризация на рецептора с неговите субстрати, като се конкурира с ауксин за същото място на свързване в TIR1.
Третият I3C-индуциран отговор, релевантен за нашето разбиране на I3C активността при инхибиране на рака, е автофагията. Излагането на корените на Arabidopsis на I3C води до индуциране на автофагия 58. Тази автофагия не е обща, насочена към масово разграждане на общото цитоплазматично съдържание за рециклиране, като това, което се случва при условия на глад, а по-скоро специфична. Специфична автофагия е насочена към увредени протеини и други клетъчни компоненти за разграждане 59 и се наблюдава при съвместната локализация на GFP-AtATG8A и mCherry-AtNBR1 маркерните протеини в автофагозомите след лечение с I3C. Индуцираната от I3C автофагия е насочена към ауксиновия рецептор TIR1, като по този начин свързва I3C-зависимото инхибиране на ауксиновата сигнализация 55 и I3C индукцията на автофагия 58 .
Тези два I3C-зависими процеса са открити в корените не само след директно излагане на екзогенно нанесен I3C, но и след третиране на листата с I3C. Най-важното е, че нараняването на листа също индуцира автофагия и инхибира ауксиновия отговор в корена и този ефект на нараняване се губи при мутанти с дефект на глюкозинолат. Това показва, че I3C-зависим сигнал се транспортира от листата до кореновата меристема, където ауксиновата сигнализация се инхибира и се предизвиква автофагия. По този начин I3C е не само защитен метаболит, който отблъсква насекомите, но също така участва в комуникация на дълги разстояния, регулираща растежа и развитието в растенията.
Индол-3-карбинол, автофагия и обмен на протеини
Връзката между I3C и автофагията е доста интересна, тъй като тази връзка е открита и в няколко човешки ракови клетки, както е описано по-рано 35, 36. Процесът на автофагия включва разграждане на ненужни или нефункционални клетъчни компоненти чрез действието на лизозоми (при бозайници) или вакуоли (при растения). Този процес е еволюционно запазен сред еукариотите и неговият механизъм е добре изяснен 60, 61. В контекста на рака автофагията може да се разглежда като „нож с две остриета“. Активирането на автофагията може да функционира като туморен супресор (чрез разграждане на дефектните органели и клетъчен компонент) или може да бъде използвано от раковите клетки за генериране на хранителни вещества и енергия по време на глад 62 .
Въпреки че I3C-индуцираната автофагия е била открита както при растения, така и при животни, механизмът за директно сигнализиране все още не е изяснен. Това обаче може да загатва за споделен сигнален механизъм както за растенията, така и за хората. По този начин не само е поучително за раковите биолози да се учат от активността на I3C в растенията, но и растителните биолози имат много да спечелят от по-близкото разбиране на механистичните изследвания на раковите биолози.
Към днешна дата са идентифицирани само няколко I3C-свързващи протеини. В човешките клетки ензимът еластаза, който медиира превръщането на циклин Е от форма с по-високо в по-ниско молекулно тегло, свързана с пролиферация на ракови клетки, е първият идентифициран специфичен целеви протеин за I3C 63. Лечението с I3C също инхибира еластазно-зависимото разцепване на допълнителен субстрат, свързан с мембраната CD40, член на суперсемейството на рецептора на туморния некротичен фактор (TNF) 64. По този начин връзката I3C-еластаза може да помогне за разработването на целенасочени терапии на рак на гърдата при хора, където високите нива на еластаза са свързани с лоша прогноза.
Единственият I3C-свързващ протеин, идентифициран в растенията до момента, е протеинът TIR1 F-box. Докато ауксинът е специфичен за растенията хормон, SCF комплексите съществуват и при бозайниците и играят важна роля в много функции на бозайниците 65. TIR1 е свързан с човешкия протеин SKP2 66, така че несъмнено I3C би могъл да регулира белтъчния обмен и при бозайниците. Тази догадка се подкрепя от проучвания, които показват, че I3C се насочва и инхибира различна Е3 убиквитин лигаза, NEDD4-1 (Невронна прекурсорна клетка, експресирана в развитие надолу ген 4-1) в човешки меланомни клетки 67, 68. По този начин, свързан с I3C, инхибиран NEDD4 ще трябва да бъде изчистен от клетката и несъмнено това може да се случи чрез специфична автофагия, точно както свързаният с I3C, инхибиран TIR1 е насочен в корените на растенията за изчистване чрез специфична автофагия. Тъй като NEDD4 често се свръхекспресира при различни видове човешки рак 69, I3C може да бъде потенциално терапевтично средство, инхибиращо активността на свръхнатрупаната Е3 лигаза.
Докато растенията не развиват метастатичен рак, както бозайниците, растенията могат да развият тумори. Растенията и животните споделят многобройни пътища и сигнални каскади 70 и приблизително 70% от гените, замесени в рак, имат хомолози в генома на Arabidopsis thaliana, подобно на процентите на човешки гени за рак в други установени системи като Drosophila melanogaster, Caenorhabditis elegans и Saccharomyces cerevisiae 52. Освен това, докато растенията и животните очевидно имат независими хормонални регулаторни механизми, има известно сходство и кръстосана реактивност между царствата. Растенията произвеждат фито-естрогени и други стероидни хормони, които също влияят върху сигнализирането на човешкия хормон, както и редица предполагаеми протеини, свързващи стероидни хормони 71–75. По този начин, изследването на I3C при растенията може да има пряко значение за по-нататъшното разбиране на ролята на I3C и може би контролиране на рака при хората.
Бележки
[Версия 1; съдии: 2 одобрени]
Отчет за финансиране
Нашите изследвания за ролята на I3C в Arabidopsis се финансират от безвъзмездни средства от Двунационалния фонд за научни изследвания и развитие на селското стопанство (BARD, IS ‑ 4505‐12R и US ‐ 4846‐15C).
Финансистите не са играли роля в дизайна на проучването, събирането и анализа на данни, решението за публикуване или подготовката на ръкописа.
Бележки
Редакционна бележка за процеса на преглед
Прегледите на факултета F1000 се поръчват от членовете на престижния факултет F1000 и се редактират като услуга за читателите. За да направят тези рецензии възможно най-изчерпателни и достъпни, реферите предоставят информация преди публикуването и се публикува само окончателната, преработена версия. Реферите, одобрили окончателната версия, са изброени с техните имена и принадлежности, но без техните доклади за по-ранни версии (всички коментари вече ще бъдат разгледани в публикуваната версия).
Реферите, които одобриха тази статия, са:
Хуан М. Сапата, Instituto de Investigaciones Biomédicas "Alberto Sols", CSIC-UAM, Мадрид, Испания
Гари Л. Файърстоун, Катедра по молекулярна и клетъчна биология и Лаборатория за изследване на рака, Калифорнийски университет в Бъркли, Бъркли, Калифорния, САЩ
- Хормонална терапия за рак на гърдата Американско онкологично общество
- Диета с ниско съдържание на въглехидрати и високо протеини и риск от инцидентен рак; проспективно кохортно проучване
- Колко плодове от киви трябва да ям на ден; Лечебни растителни храни
- Нискомикробен диетичен мемориален център за рак на Sloan Kettering
- Диета с ниско съдържание на фибри Мемориален център за рак на Sloan Kettering