1 Катедра по вътрешни болести, клиника Маршфийлд, 1000 N. Oak Avenue, Маршфийлд, WI 54449, САЩ
2 Катедра по ендокринология, клиника Маршфийлд, Маршфийлд, WI 54449, САЩ
Резюме
Амиодаронът е мощно антиаритмично лекарство на йодна основа, имащо структурно сходство с тироксин (Т4). Известно е, че произвежда аномалии на щитовидната жлеза, вариращи от ненормално тестване на функцията на щитовидната жлеза до явен хипотиреоидизъм или хипертиреоидизъм. Тези неблагоприятни ефекти могат да се появят при пациенти със или без съществуващо заболяване на щитовидната жлеза. Амиодарон-индуцираната тиреотоксикоза (AIT) е клинично признато състояние, което се дължи обикновено на йод-индуциран прекомерен синтез на щитовидната жлеза, известен също като тип 1 AIT. В редки случаи AIT се причинява от индуцирано от амиодарон възпаление на щитовидната тъкан, което води до освобождаване на предварително образувани хормони на щитовидната жлеза и хипертиреоидно състояние, известно като AIT тип 2. Разграничаването между двете състояния е важно, тъй като и двете състояния имат различни последици за лечението; обаче смесеното представяне не е необичайно, което създава предизвикателства за диагностика и лечение. Описваме случай на пациент с индуциран от амиодарон хипертиреоидизъм тип 2 и разглеждаме текущата литература за най-добрите практики за диагностични и лечебни подходи.
1. Въведение
2. Представяне на казус
63-годишен мъж е бил на терапия с амиодарон 200 mg/ден в продължение на приблизително 2 години за повтаряща се болка в стенокардия, вторична вследствие на пароксизмално предсърдно мъждене, въпреки контрола на камерната честота. Той е бил насочен към ендокринологичния отдел поради опасения от хипертиреоидизъм, диагностициран по време на рутинно проследяване на мониторирането на функцията на щитовидната жлеза, свързано с експозицията му на амиодарон. Той съобщи за 19-килограмова загуба на тегло през последната година, част от които умишлена, и влошаване на треперенето на ръката, което имаше от години. Той отрече всякакви други симптоми на хипертиреоидизъм.
Миналата медицинска история е била значима за неклузивна коронарна артериална болест, хипертония, болестно затлъстяване и периферни съдови заболявания с клаудикация. Семейната му история включва сестра със свързана с щитовидната жлеза симптоматика, но той не е в състояние да предостави допълнителни подробности. Пациентът е бил нащрек, без остър стрес, с телесно тегло 263 паунда. Изследването на щитовидната жлеза не разкрива осезаеми възли на нито един лоб. Жлезата се движеше свободно по време на преглъщане и беше донякъде дифузно увеличена. При палпация не се наблюдава лимфаденопатия или болезненост. Жизнените признаци бяха нормални с кръвно налягане от 110/60 mm Hg. Останалата част от изследването беше незабележителна.
Тестовете за функция на щитовидната жлеза разкриха ниво на тиреоид стимулиращ хормон (TSH) от 0,01 mIU/mL (диапазон 0,35–4,5 mIU/mL), свободен T4 от 2,7 ng/dL (диапазон 0,6–1,2 ng/dL) и нива на свободен T3 от 3,7 pg/ml (диапазон 2,1–4,1 pg/ml). Ултразвукът на щитовидната жлеза не показва хиперваскуларност (Фигура 1). Ултразвукът, направен преди 2 години, разкри мултинодуларна жлеза с доминиращ десен едрителен възел 1,3 × 0,8 cm, за който беше установено, че е доброкачествен при аспирационна биопсия с фина игла. Имаше още 1,1 × 0,6 cm възел от лявата страна, който не беше биопсиран. Дясният доминиращ възел остава стабилен, а левият възел леко се е увеличил до размер от 1,2 cm. Поглъщането и сканирането на радиойод има 0,6% (диапазон 4–20%) и 0,2% (диапазон 5–30%), съответно на 4 часа и 24 часа, в съответствие с индуцираната от амиодарон тиреотоксикоза в клиничния контекст (Фигура 2). Скринингът за тиреоглобулинови антитела е нормален при 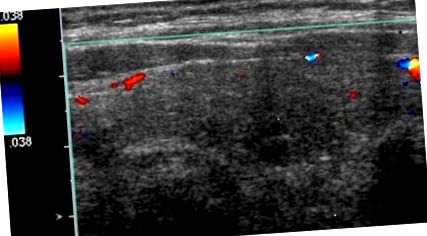
а)
б)
(° С)
Въпреки че нито една от находките не е диагностична, те предпочитат диагнозата AIT2, повече отколкото по-често срещаната AIT1. Пациентът е лекуван с ниски дози стероиди (20 mg преднизон дневно) в продължение на месец с деескалация на дозировката след подобряване на тестовете за функция на щитовидната жлеза. Той съобщава за подобрение на двустранния тремор на ръцете, обратно към изходното ниво, и е еутиреоиден с TSH от 3,09 mIU/mL, свободен T4 от 1,0 ng/dL и свободен T3 от 2,5 pg/mL по време на последващо проследяване 3 месеца по-късно. Пациентът остава еутиреоиден клинично и биохимично без рецидив на AIT, като същевременно продължава терапията с амиодарон в продължение на 3 години след лечението на AIT2.
3. Дискусия
Амиодарон се използва при лечение на различни предсърдни и камерни аритмии и е предпочитан при пациенти с левокамерна дисфункция [2]. Поради структурното сходство с хормоните на щитовидната жлеза и съдържанието на йод в лекарството, е известно, че причинява значителни промени в тестването на функцията на щитовидната жлеза, често с клинично значимо въздействие [3].
3.1. Механизми на свързана с амиодарон дисфункция на щитовидната жлеза
Амиодарон инхибира активността на тип 1 5′-дейодиназа в черния дроб/периферните тъкани, която може да продължи седмици след оттеглянето на лекарството [4]. Освен това, лекарството инхибира 5′-дейодиназната активност от тип 2 в хипофизата, което намалява превръщането на Т4 в Т3 и повишава нивата на TSH [5]. Докато амиодаронът няма ефект върху метаболизма (разпределение и отстраняване) на плазмения пул Т3 [6], лекарството инхибира навлизането на тиреоиден хормон в циркулацията [7]. Таблица 1 обобщава ефектите на амиодарон върху тестовете за функция на щитовидната жлеза при пациенти с еутиреоидна жлеза.
Поради своите присъщи свойства, амиодаронът се свързва по-скоро с хипотиреоидизъм, отколкото с тиреотоксикоза в страни с изобилие от йод като Обединеното кралство и САЩ [8]. Патогенезата на индуцирания от амиодарон хипертиреоидизъм все още не е напълно разбран, което прави диагнозата и лечението предизвикателни. Описани са два основни типа AIT с различни механизми. AIT1 се дължи на индуциран от йод излишен синтез и освобождаване на хормони на щитовидната жлеза, обикновено от анормални щитовидни жлези. AIT2 е форма на деструктивен тиреоидит, който води до изтичане на предварително образувани хормони в кръвообращението. Въпреки че излишъкът на йод може да бъде важен патогенен фактор и при двата подтипа, някои форми на AIT може да се дължат чисто на подостър тиреоидит и освобождаване на предварително образувани хормони.
3.2. Диагнози на AIT2
AIT обикновено има внезапно начало, което се проявява с нова или влошаваща се аритмия, или може да бъде асимптоматично, особено при по-млади индивиди [9, 10]. Тъй като хипертиреоидизмът тип 1 често се среща при пациенти с предшестващо заболяване на щитовидната жлеза, началото е в рамките на първите няколко месеца, докато средното време за поява на AIT2 е около 30 месеца след започване на терапията с амиодарон [11]. И в двата случая първоначалната оценка трябва да включва обичайната работа за функцията на щитовидната жлеза, включително TSH, T3, T4 и антитиреоидни антитела. Ултразвукът на щитовидната жлеза със или без CFDS и поглъщане на радиойод (RAIU) и сканиране са полезни при разграничаването на двата подтипа AIT.
В AIT2 RAIU ще бъде по-нисък (10%) [12]. В Съединените щати, където повечето пациенти имат изобилие от йод, RAIU може да бъде ниско и при двата вида AIT, така че CFDS е полезен при насочване на терапията [13, 14]. CFDS дава информация в реално време за притока на кръв в щитовидната жлеза и нейната морфология. Поради фоликуларна деструкция, лимфоцитна инфилтрация в резултат на възпалителни реакции, наблюдавани в AIT2, цветният поток при ултразвук би показал повишена васкуларност и скорост на кръвния поток [15]. Тези находки са показателни за хиперфункционираща жлеза и се наблюдават и при нелекувана болест на Грейв. CFDS може да служи за улесняване на вземането на решения поради относителната му лекота на използване, способността да се получат по-бързи резултати и неинвазивния характер на проучването, особено при пациенти с животозастрашаващи тахиаритмии.
Сканирането MIBI се използва за откриване на хиперфункциониращи паратиреоидни аденоми и някои злокачествени или доброкачествени тумори на щитовидната жлеза. Напоследък има интерес към използването му при разграничаване между двата вида AIT. Малко проучване на 20 пациенти установи, че то превъзхожда CFDS в диференцирането между AIT1 и AIT2 [16].
Интерлейкин-6 (IL-6), цитокин, свързан с възпаление, беше предложен като биомаркер, за да се направи разлика между тиреоидит, индуциран от амиодарон и индуциран от йод хипертиреоидизъм. Отбелязаното повишаване на нивата на IL-6 корелира тясно със субакутен тиреоидит при пациенти без предварително съществуващо заболяване на щитовидната жлеза. Установено е също нормално до леко повишаване на IL-6 при пациенти с AIT1 [17]. Таблица 2 представя сравнително обобщение между двата вида индуциран от амиодарон хипертиреоидизъм.
Клинични и патологични характеристики, отличаващи индуциран от амиодарон тип 1 и тип 2 хипертиреоидизъм † .
3.3. Лечение
Най-добрият възможен вариант за лечение на AIT2 е пероралните глюкокортикоиди. Те действат чрез намаляване на възпалението в щитовидната жлеза, основният патологичен механизъм при AIT2, а също така намаляват периферното превръщане на Т4 в Т3 [18]. Изходните концентрации на свободен Т4 и обемът на щитовидната жлеза могат да предскажат забавен отговор на глюкокортикоидите. При лица с висок риск това може да помогне за идентифициране на лица, при които операцията и/или йопановата киселина трябва да се обмислят в началото на заболяването [19].
Йопановата киселина, перорален холецистографски агент (OCA), действа чрез инхибиране на 5'-дейодиназната активност тип 1, ензима, отговорен за периферното превръщане на Т4 в Т3. 70% намаление на серумните нива на Т3 се наблюдава след 48 часа приложение на йопанова киселина при пациенти със спонтанен хипертиреоид, с малък ефект върху серумната концентрация на Т4. Йопановата киселина обаче не влияе на деструктивните процеси на тиреоидит, свързани с AIT2 [20]. Йопановата киселина е разумна алтернатива на стероидите за контрол на хипертиреоидизма в краткосрочен план, но ще отнеме повече време от използването на стероиди за постигане на еутиреоидно състояние, както е показано в малко, проспективно, рандомизирано контролно проучване [21].
Поради съвместното съществуване на двете форми на AIT, често има променлив отговор на терапия с глюкокортикоиди при AIT2. Понякога са необходими тионамиди в допълнение към глюкокортикоидите, за да се постигне еутиреоиден статус при тези пациенти. Нивата на IL-6 могат да помогнат при избора на терапия, но отчитането на нивата може да отнеме дни до седмици. Следователно при тежко болни пациенти, докато диагнозата не е сигурна, е разумно да се лекуват както AIT1, така и AIT2 с антитиреоидни лекарства и глюкокортикоиди с или без перхлорат. Тиреоидолозите могат да използват стъпков подход, при който първоначалната терапия би представлявала използване на тионамиди в продължение на 4 седмици и да въведе стероиди, ако няма достатъчен или никакъв отговор на терапията с тионамид [22].
Guitierrez-Repiso et al. [23] отбелязват, че при възрастна популация с адекватно и стабилно хранене, отделянето на йод в произволна проба от урина представлява 70–80% от дневния прием на йод. Този факт се използва и от няколко изследователи или за диагностика, или за лечение на лекарствено-индуцирана тиреотоксикоза [24-26]. Erdoğan и колеги предлагат лечение на AIT с преднизон, калиев перхлорат и титруване на метимазол, като се използва отделянето на йод с урината [27].
- 28-дневно предизвикателство с нисък гликемичен план на менюто - Яжте
- 10-дневно предизвикателство за чисто хранене!
- A4 Waist Предизвика опасна тенденция, експерт по хранителни разстройства предупреждава CTV News
- Аспартат аминотрансфераза лаборатория на Дейвис; Диагностични тестове
- Оценка на хранителните познания на медицинските сестри по отношение на режимите на терапевтична диета - ScienceDirect
