1 Катедра по медицина, Университет на Илинойс в Чикаго и Медицински център по ветераните в Чикаго, West Side Division, Чикаго, Илинойс 60612
1 Катедра по медицина, Университет на Илинойс в Чикаго и Медицински център по ветераните в Чикаго, West Side Division, Чикаго, Илинойс 60612
1 Катедра по медицина, Университет на Илинойс в Чикаго и Медицински център по ветераните в Чикаго, West Side Division, Чикаго, Илинойс 60612
1 Катедра по медицина, Университет на Илинойс в Чикаго и Медицински център по ветераните в Чикаго, West Side Division, Чикаго, Илинойс 60612
1 Катедра по медицина, Университет на Илинойс в Чикаго и Медицински център по въпросите на ветераните в Чикаго, West Side Division, Чикаго, Илинойс 60612
1 Катедра по медицина, Университет на Илинойс в Чикаго и Медицински център по ветераните в Чикаго, West Side Division, Чикаго, Илинойс 60612
Резюме
при липса на чернодробна трансплантация фулминантната чернодробна недостатъчност (FHF) се свързва с 50–90% смъртност и представлява ∼6% от всички смъртни случаи, свързани с черния дроб в САЩ (12, 16, 20). Тази лоша прогноза се дължи, поне отчасти, на липсата на подходящ животински модел, който би позволил по-добро разбиране на патофизиологията на този синдром. Основните критерии за животински модел на FHF включват възпроизводимост, смърт от чернодробна недостатъчност и дълъг терапевтичен прозорец (28). Тъй като чернодробната енцефалопатия (HE) неизменно се свързва с FHF при хората (6, 24), промененият психичен статус също трябва да се разглежда като основен критерий за животински модели на този синдром. И все пак нито един използван понастоящем животински модел не отговаря на всички тези различни критерии (Таблица1). Също толкова важно е, че не всички токсини, използвани в момента при изследването на FHF при животни, са докладвали, че причиняват нараняване при хората.
Таблица 1. Сравнение на често използвани токсини за индуциране на фулминантна чернодробна недостатъчност с чернодробна енцефалопатия
Доклад от Гуам в началото на 60-те години отбелязва, че цикадовите палмови ядки предизвикват различни видове рак на стомашно-чревния тракт (15). Оттогава активната съставка, азоксиметан (AOM), се използва за изследване на рак на дебелото черво при лабораторни животни (37). Интересното е, че този доклад описва по анекдотичен начин, че цикадовите палмови ядки също причиняват увреждане на черния дроб при хора, плъхове и храна от животни, получени от тази ядка (15). Следователно се интересувахме дали освен установената роля за причиняване на рак на дебелото черво, AOM може да се използва и като FHF-индуциращ хепатотоксин.
В това проучване ние изследвахме ефектите на AOM като хепатотоксин при мишки C57BL/6J. Ние ограничихме това разследване до този вид, тъй като цели животински генетични манипулации (т.е. трансгеника, нокаути) могат да се извършват само при мишки и този конкретен щам е най-добре характеризиран (27). Тук демонстрираме, че AOM индуцира дозозависим FHF при мишки, който е силно възпроизводим, причинява смърт от чернодробна недостатъчност по дозозависим начин поради чернодробно митохондриално увреждане, има дълъг терапевтичен прозорец и генерира свързана енцефалопатия с данни за мозъчна оток в краен стадий на заболяване. По този начин AOM е първият токсин, който отговаря на всички критерии, предварително идентифицирани като съществени за животински модел на FHF (28), който също е свързан с развитието на чернодробна енцефалопатия.
Грижа и поддръжка на мишката.
Мъжки мишки C57BL/6J (25–30 g телесно тегло) бяха получени от лабораторията Jackson (Bar Harbor, ME) и използвани на възраст 20 седмици. Мишките бяха хранени ad libitum с Lab Diet Formulab 5008 от гризачи (PMI Feeds, Сейнт Луис, Мисури) и им беше разрешен свободен достъп до вода. Мишките бяха настанени в микроизолаторни клетки с лабораторни постелки GreenTru (Green Products, Conrad, IO) и изложени на контролиран светлинен цикъл от 10:14 часа (светлина: тъмно) при 25 ° C. За да се приспособи видеозаписът, 48 часа преди администрирането на AOM (Sigma, Сейнт Луис, Мисури), мишките бяха изложени на непрекъсната светлина. За повечето експерименти животните получават 100 μg/g AOM, разтворени в 100 μl стерилен физиологичен разтвор (Fujisawa USA, Deerfield, IL), прилаган чрез интраперитонеална инжекция. За всички експерименти, животните се съчетават с инжектирана с физиологичен разтвор контролна група.
Клинична и биохимична оценка.
За да се определи дали хипогликемията може да е причинила промени в психичния статус, енцефалопатичните животни от етап I и III са били лекувани с глюкоза. След като нивото на серумна глюкоза беше определено с глюкометър (Bayer, Elkhart, IN) върху венозна кръв, получена от опашката, интраперитонеално беше приложено достатъчно глюкоза за връщане на серумните нива до нормални като 50% разтвор. След това животните се наблюдават непрекъснато и серумна глюкоза се проверява на всеки 15 минути.
Събиране на тъкани.
Всички органи, включително черния дроб, мозъка, сърцето, белите дробове, панкреаса, далака, бъбреците, стомаха и червата, бяха събрани и незабавно поставени в 10% формалин. Тъканите бяха обработени и вградени в парафин съгласно стандартния протокол на Института по патология на въоръжените сили (AFIP) (1). За всяка тъкан бяха приготвени 5-μm срезове с използване на микротом на Spencer модел 820 (American Optical, Buffalo, NY), топлина, фиксирана при 70 ° C в продължение на 20 минути и след това оцветена с хематоксилин и еозин съгласно стандартния протокол AFIP (1).
Имунохистохимия.
Използвана е тристепенна техника на индиректна имунопероксидаза за маркиране на първичното антитяло. Топлофиксираните тъканни секции се рехидратират в градуирани алкохоли и след това се изплакват в течаща водна баня. Секциите се инкубират за 5 минути при стайна температура в 3% водороден прекис в светлонепропусклива камера, за да се потуши ендогенната активност. След изрезките бяха изплакнати с 1 × PBS, стъклата бяха инкубирани в продължение на 20 минути в блокиращ разтвор (90% вода, 5% обезмаслено мляко и 5% H2O2). Излишният разтвор се отстранява и срезите се инкубират с 1: 250 разредено първично антитяло на глиален фибриларен киселинен протеин (GFAP) (Sigma) за 1 h в камера за влажност. Секциите се промиват в PBS буфер и след това се инкубират с биотинилиран анти-заешки IgG (DAKO, Carpinteria, СА) за 15 минути. Слайдовете се изплакват с PBS и се инкубират със стрептавидин-конюгирана хрянова пероксидаза (DAKO) в продължение на 15 минути. След като слайдовете бяха изплакнати с PBS, бе извършена идентификация на протеини чрез инкубиране на диапозитиви с течна DAB субстратно-хромогенна система (DAKO) за 2 минути. След последно измиване с PBS, последвано от вода, предметните стъкла се оцветяват с хематоксилин на Gills за 1 минута, дехидратират се в сортирани алкохоли и се монтират с покривало с използване на Permount.
Микроскопия.
Изображенията са получени с цифрова сканираща камера MicroLumina (Leaf, Westborough, MA), свързана с микроскоп Nikon E600 (Токио, Япония) с цели PlanApo. Проведена е трансмисионна електронна микроскопия върху прясно резецирана чернодробна тъкан, незабавно поставена в 4% глутаралдехид в 0,1 М какодилатен буфер (CB) за една нощ, след което е фиксирана за 2 часа в 2% воден осмиев тетроксид в CB. Тъканта беше дехидратирана в градуирани алкохоли и пробите бяха вградени в чиста Epon смола (EMS, Форт Вашингтон, Пенсилвания) и бяха полимеризирани при 60 ° С в продължение на 12 часа. Ултратънките срезове бяха оцветени с уранилацетат и оловен цитрат на Рейнолдс и бяха изследвани с електронен микроскоп за пропускане Phillips 410.
Клинични находки.
Животните, лекувани със 100 μg/g AOM, развиват доказателства за HE, което е предшествано от нова продромална фаза. Продромалната фаза се характеризира с намалена спонтанна активност и намален прием на храна и вода (фиг. 1). Това намаляване на активността и храненето е настъпило преди загубата на разсейващия рефлекс на животните, което преди е било определено като характерно за етап I HE (38). Тази продромална фаза на намалена активност възпроизводимо настъпва 5-7 часа след приложението на AOM и продължава ~ 15 часа, като по това време животните губят своя разсейващ рефлекс. По този начин летаргичните животни в продромалния период могат да бъдат разграничени от тези в етап I HE по силата на наличието или отсъствието на разсейващия рефлекс. 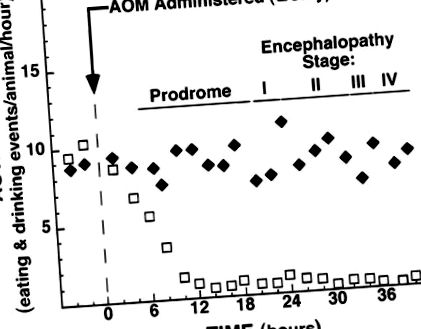
Фиг. 1.Промени в активността на животните след интраперитонеално инжектиране с физиологичен разтвор (♦) или 100 μg/g азоксиметан (AOM, □) до момента на убиване или смърт. Неактивността на продромалната фаза се диференцира от летаргията на стадий I на чернодробна енцефалопатия (HE) по време на почасови изследвания, като се наблюдава реакцията на животните към ръчна стимулация. Данните представляват средства. Лентите за грешки не се показват, за да се запази графичната яснота.
Втората фаза се характеризира с развитието на откровена енцефалопатия, която прогресира през всичките четири предварително дефинирани етапа, включително загуба на инстинкт за разсейване (етап I), атаксия (етап II), загуба на рефлекс за изправяне (етап III) и прогресия до кома ( етап IV) (38). Етап I HE се наблюдава 20,2 ± 0,1 h (н = 32) след инжектиране на AOM. Атаксия (HE II на етап II) се наблюдава след 24,3 ± 0,3 часа (н = 14), докато загубата на изправен рефлекс (етап III НЕ) е настъпила 33,2 ± 1,5 часа (н = 18) след излагане на AOM. Загубата на роговичните рефлекси и кома (стадий IV НЕ) се развива 36.0 ± 0.8 h (н = 25) след инжектиране, със смърт след ~ 3 часа по-късно (н = 20). Всъщност всички животни, на които е дадена 100 μg/g AOM, прогресират до смърт в рамките на 41 часа.
Хистологични находки.
AOM причинява прогресивно чернодробно увреждане, което предшества промяна в клиничното поведение. Най-ранната наблюдавана хистопатологична промяна е наличието на микровезикуларна стеатоза 2 часа след приложението на АОМ (Фиг. 2Б.; нормалният черен дроб на мишката е показан в A). Четири часа след инжектиране на AOM се наблюдава синусоидална дилатация, предимно в областта около централната вена (Фиг. 2)° С). Към момента I етап HE се е развил ~ 20 часа след експозиция на AOM, дълбоката центробуларна некроза е очевидна (фиг. 2д). При предтерминалния IV етап на НЕ животно тази некроза има предимно хеморагичен характер (фиг. 2Е.). Като се има предвид ранното наблюдение на микровезикуларната стеатоза, се чудехме дали това е свързано с митохондриално увреждане. В съответствие с AOM, действащ като митохондриален токсин, трансмисионната електронна микроскопия разкрива дълбоко увреждане на кристалите (Фиг. 2F).
Фиг. 2.Хистопатологични промени, наблюдавани в черния дроб на лекувани с AOM мишки C57BL/6J. A: нормален миши черен дроб. оцветяване с хематоксилин и еозин (H&E); увеличение = × 400.Б.: чернодробна секция на мишка, изложена на AOM в продължение на 2 часа, показваща наличие на микровезикуларна стеатоза, демонстрирана от полупрозрачни сини глобули. Толуидиново синьо оцветяване; увеличение = × 1000. ° С: чернодробна секция на мишка 4 часа след излагане на AOM, показваща центробуларна синусоидална дилатация. H&E оцветяване; увеличение = × 400.д: секцио, получено 20 часа след приложение на AOM, показващо центробуларна некроза. Известен кръвоизлив може да се наблюдава в периферията в межзоналния регион. H&E оцветяване; увеличение = × 400. Е.: чернодробна секция от претерминална енцефалопатична мишка от етап IV. Централните вени са заличени 35 часа след излагане на AOM чрез тежък кръвоизлив, като останалите жизнеспособни хепатоцити присъстват само в порталните зони. H&E оцветяване; увеличение = × 100.F: трансмисионно електронно микроскопско изследване на чернодробна секция, получена 8 часа след приложение на AOM. Жълтата стрелка идентифицира митохондрия. Двойните стени на митохондриите могат да се видят, но тези на кристите, съдържащи се в тях, не се различават. Белите стрелки показват мазнини. Осмиев тетроксид, уранил ацетат и оловно цитратно оцветяване на Рейнолдс; увеличение = × 18 000.
Фиг. 3.Хистопатологични промени, наблюдавани в мозъка на лекувани с AOM мишки C57BL/6J. A: мозъчна секция на здрава контролна мишка. Стрелките идентифицират нормално изглеждащите астроцити. H&E оцветяване; увеличение = × 400.Б.: мозъчна секция на мишка, изложена на AOM за 35 h (етап IV HE), показваща аероцитни балониране и побратимяване (стрелка), както и изместване на хроматин. H&E оцветяване; увеличение = × 400. ° С: имунохистохимия за глиален фибриларен киселинен протеин (GFAP) върху мозъчна секция от мишка в етап IV HE. Отбележете липсата на оцветяване на астроцити за GFAP в сивото вещество (стрелка). Увеличение = × 400. Вложка:имунохистохимията за GFAP остава положителна, когато се извършва на мишка от етап III (стрелка).
Биохимични изменения.
Оценихме серумен ALT, артериален амоняк, глюкоза, алкален фосфат, билирубин и креатинин при инжектирани с физиологичен разтвор контролни животни и при животни в различни времеви точки след приложението на AOM. В допълнение към всеки енцефалопатичен етап, ние оценихме животните 4 и 8 часа след доставката на лекарството, тъй като в първия момент има данни за увреждане на черния дроб, но няма енцефалопатия, докато в последния момент могат да бъдат открити фини промени в психичния статус.
Както се очакваше, наблюдавахме повишение на серумния ALT, което съответстваше на хистологичната степен на чернодробно увреждане. ALT е сходен при контролни животни (64 ± 14 U/l) и животни 4 часа след инжектиране на AOM (56 ± 5 U/l) (Таблица 2), в който момент може да се оцени само синусоидална дилатация (Фигура 2° С). Въпреки това, до времевия етап I HE и центробуларна хепатоцитна некроза (Фиг. 2д), ALT се увеличава до 5,196 ± 126 U/l и в крайна сметка достига пик при предтерминалното животно при 12 231 ± 2 068 U/l (Таблица 2). За разлика от това, няма значителни промени в билирубина (таблица 2), алкалния фосфат или креатинина (данните не са показани). Неуспехът да се открие някакво значително повишаване на серумния билирубин е подобен на описания при чернодробно увреждане поради ацетаминофен при кучето (10), но е в контраст с това, което се съобщава за тиоацетамид при плъхове (38) или галактозамин в заек (3). Вариабилността на свързаната с хепатотоксин хипербилирубинемия предполага възможността такива промени да отразяват различните ефекти на което и да е лекарство при различни видове или че тези токсини могат да имат фини, но различни ефекти върху промяната на чернодробната функция.
Таблица 2. Химични изследвания на кръв на мишки C57BL/6J с чернодробна енцефалопатия поради индуцирана от азоксиметан чернодробна недостатъчност
Стойностите са средно ± SE за минимум 3 отделни експеримента. Контролните стойности са за животни, използвани в това проучване, и за CD-1 безпородни мишки албиноси (Charles River, Wilmington, MA), както беше съобщено по-рано (13). AOM, азоксиметан; ALT, аланин аминотрансфераза; ТОЙ, чернодробна енцефалопатия; RR, десен рефлекс; NR, не се съобщава; ND, не е направено.
Таблица 3. Индуцирано от азоксиметан увреждане на черния дроб и времето до смърт зависи от дозата
По-голямата част от докладваните резултати са получени при използване на 100 μg/g AOM.
F3-150 В това число са включени само животните, пристъпващи към смърт. NA, неприложимо, тъй като животните не са умрели от AOM при тази доза.
Тъй като вариативността между партидите често се наблюдава при употребата на други хепатотоксини като галактозамин (3, 26, 33), ние също проучихме дали това може да ограничи полезността на AOM. Поради това получихме 30 отделни партиди AOM от дистрибутора (Sigma). От тези 30 партиди избрахме на случаен принцип 10 и оценихме четири животни на партида. Приложихме 100 μg/g AOM на всяко от тези животни, убихме по едно на етап I HE и етап III HE и оставихме останалите да прогресират до смърт. Във всички случаи времето на HE, прогресията на чернодробното увреждане и времето до смъртта са идентични.
В това проучване ние демонстрираме, че AOM е първият токсин, който отговаря на всички основни критерии за животински модел, доколкото той е възпроизводим, причинява смърт от чернодробна недостатъчност, има дълъг терапевтичен прозорец и представлява минимална опасност за персонала при правилно боравене с него. В допълнение, AOM-индуцираното увреждане на черния дроб генерира и четирите по-рано характеризирани етапа на HE (38), което е особено важно, тъй като енцефалопатията неизменно се свързва с FHF при хората (6, 12, 16,20). Една от най-важните характеристики на мишият AOM модел на FHF е идентифицирането на продромална фаза, отделна и различна от първия етап на HE (фиг. 1). Енцефалопатичната фаза е с дължина ~ 19 часа и се открива от загубата на разсейващ рефлекс, когато увреждането на черния дроб е вече широко (фиг. 2д). За разлика от това, продромалната фаза продължава с подобно време (фиг. 1), но се появява, когато увреждането на черния дроб е относително скромно (фиг. 2,Б. и° С). Информираността за тази продромална фаза може да бъде критична за бъдещи проучвания, опитващи се да идентифицират фактори, причиняващи ВО.
И накрая, основно предимство на индуцирания от AOM FHF е очевидната му способност да причинява чернодробно увреждане и неуспех при множество видове, включително хора. AOM е активният метаболит на циказин (36), открит в цикадовите палмови ядки само на остров Гуам. В един анекдотичен доклад от този остров през 60-те години (15), пикнотични ядра и фокална некроза в центролобуларната област са идентифицирани при хора, добитък и плъхове още 48 часа след поглъщане на немити цикадови ядки. В ретроспекция изглежда, че гуаманският FHF при хора, гризачи и добитък се дължи на хепатотоксичността на AOM.
В заключение, AOM причинява дозозависима центробуларна некроза на черния дроб, вероятно като действа като митохондриален токсин, който прогресира до чернодробна недостатъчност и смърт. Този агент причинява както неврологичен продром, така и откровен HE. Това е първият агент с човешки корелат, който може да се използва при видове, който е потенциално обратим, възпроизводим и причинява смърт от чернодробна недостатъчност.
Ние сме длъжни на д-р Майкъл Д. Норенберг (Университет на Маями, Маями, Флорида) за критичен преглед на тази статия. Ние също оценяваме прозренията за хистологичната прогресия на чернодробното увреждане от д-р Марк Дж. Чая (Колеж по медицина на Алберт Айнщайн, Ню Йорк, Ню Йорк) и естеството на увреждането на ЦНС от д-р Бети Ан Броуди (катедра по патология, Унив. от Илинойс в Чикаго, Чикаго, Илинойс). В допълнение, ние сме благодарни на д-р Робърт Г. Мъртек (Департамент по статистика, Университет на Илинойс в Чикаго) за съдействието при статистическата оценка на нашите биохимични открития. И накрая, благодарим на Дуейн Харис (Медицински център по въпросите на ветераните от Уестсайд, Чикаго, Илинойс) за експертна техническа помощ.
СТЪПКИ
Разходите за публикуване на тази статия бяха покрити отчасти чрез плащането на такси за страница. Следователно статията трябва да бъде маркирана с „реклама”В съответствие с 18 U.S.C. §1734 единствено за посочване на този факт.
ПРЕПРАТКИ
ЗАБЕЛЕЖКИ НА АВТОРА
Адрес за искания за препечатка и друга кореспонденция: Р. В. Беня, катедра по медицина, Унив. на Илинойс в Чикаго, 840 South Wood St. (M/C 787), Чикаго, IL 60612 (E-mail: [email protected] edu).
- Всички услуги; Болница за остри животни
- Бъдете купонджия и отслабвайте също
- Ползи и системи за отглеждане на патица като храна за животни и биогориво
- Разфасовки на животни от Universal Nutrition при - Най-ниска цена на разфасовки на животни!
- Преглед на разфасовките на животни (2020) - Трябва ли да го купите
