Резюме
ВЪВЕДЕНИЕ
Понастоящем Bupropion (BUP) е одобрен за лечение на депресия (Wellbutrin ®) и като помощно средство при спиране на тютюнопушенето (Zyban ®) (Ascher et al, 1995; Foley et al, 2006). Първоначално свързано с „липса на наддаване на тегло“, наскоро беше доказано, че BUP причинява лека (5%) загуба на тегло в клинични изпитвания със затлъстели хора (Gadde и Xiong, 2007). Въпреки че BUP претърпява допълнителни клинични проучвания като фармакотерапия за затлъстяване, няма контролирани изчерпателни проучвания върху животни, които оценяват как хроничният BUP влияе върху енергийния баланс.
Подобно на много антидепресанти и единственото централно действащо, одобрено от FDA дългосрочно лечение на затлъстяване, сибутрамин (Meridia ®), BUP инхибира транспортерите за обратно поемане на биогенни аминови плазмени мембрани (Ascher et al, 1995; Stahl et al, 2004; Kaplan, 2005). Чрез селективно инхибиране на обратното поемане на транспортери за допамин (DA) и норепинефрин (NE), BUP въздейства върху основните средства за изчистване на извънклетъчните катехоламини (Hoffman et al, 1998). Чрез блокада на DA и NE транспортерите, BUP причинява остро повишаване на концентрациите на интерстициален катехоламин и повишено инхибиране на обратната връзка на пресинаптичните неврони (Ascher et al, 1995; Dong and Blier, 2001).
BUP намалява приема на храна, когато се прилага остро на гризачи (Zarrindast и Hosseini-Nia, 1988; Billes and Cowley, 2007). Тъй като острото съвместно администриране на селективни инхибитори на обратното захващане на DA + NE предизвиква добавъчен инхибиторен ефект върху приема на храна при мишки, и двата катехоламина вероятно допринасят за острия хипофагичен ефект на BUP. Както DA, така и NE също допринасят за ефекта на загуба на тегло на BUP, който е документиран при хора, тъй като субхроничното (7-дневно) едновременно приложение на DA + NE инхибитори на обратното поемане също води до загуба на тегло при мишки (Billes and Cowley, 2007). Интересното е, че загубата на тегло, причинена от субхронично инхибиране на обратното захващане на DA + NE при мишки, е настъпила при липса на намаляване на приема на храна, което също е подобно на наблюдението, че хроничното приложение на BUP не влияе върху приема на калории при хора (Griffith et al, 1983; Harto-Truax et al, 1983). Това предполага, че инхибирането на обратното поемане на катехоламин може да причини загуба на тегло чрез увеличаване на енергийните разходи.
Съвременните данни за гризачи показват, че остър BUP може да увеличи енергийните разходи чрез повишаване на температурата (Liu et al, 2002, 2004). Тъй като докладите за острите ефекти на BUP върху температурата са непостоянни, са необходими допълнителни изследвания, за да се определи дали повишената термогенеза може също да допринесе за увеличените енергийни разходи от BUP (Zarrindast и Abolfathi-Araghi, 1992; Liu et al, 2002; Hasegawa et al, 2005). Ние и други показахме, че острият периферен BUP също зависи от дозата стимулира двигателната активност при гризачи, което е в съответствие с инхибирането на DA транспортера (Soroko et al, 1977; Cooper et al, 1980; Nielsen et al, 1986; Zarrindast и Hosseini-Nia, 1988; Vassout et al, 1993; Redolat et al, 2005; Mitchell et al, 2006).
Затлъстяването обикновено се разглежда като хронично заболяване, изискващо непрекъсната намеса за поддържане на ниско телесно тегло (Appolinario et al, 2004; Ioannides-Demos et al, 2005). Хроничното (5–21 дни) лечение с лекарства като BUP може да повлияе на рецепторната експресия, вътреклетъчните сигнални механизми и експресията и активността на транспортера (Frazer и Benmansour, 2002). По този начин, хроничното BUP лечение може да доведе до поведенческа толерантност и/или сенсибилизация, така че острите ефекти на BUP върху енергийния баланс да се различават от хроничните ефекти на BUP. Необходими са изследвания, които разглеждат как хроничното инхибиране на обратното захващане на DA + NE влияе върху енергийния прием и разход, за да се определи как дългосрочното приложение на лекарството влияе върху енергийния баланс.
Видно е отсъствието на данни за цялостните ефекти на хроничното лечение с BUP върху енергийния баланс при животински модели. Също така не е ясно как DA и NE допринасят за възможните метаболитни ефекти на BUP, тъй като няма проучвания, които да изследват как хроничното приложение на селективни инхибитори на обратното захващане на DA или NE влияе върху разхода на енергия. Необходими са проучвания, сравняващи ефектите на BUP с тези на селективните инхибитори на обратното захващане на DA или NE върху множество мерки за енергиен баланс (като прием на храна, двигателна активност, термогенеза и телесно тегло) за пълния анализ на ефектите на лекарства като BUP върху енергиен баланс. Целта на настоящото проучване беше да се изследват острите и хронични ефекти на инхибирането на обратното поемане на DA + NE върху енергийния баланс при мишки, по-специално да се хвърли светлина върху механизма на загуба на тегло от лекарства като BUP. За тази цел първо изследвахме ефектите от острото приложение на BUP или селективни инхибитори на обратното захващане на DA и NE върху локомоторната активност и интерскапуларната температура. След това изследвахме ефектите на субхроничния (7-дневен) BUP или селективните инхибитори на обратното захващане на DA и NE върху двигателната активност, междулопаточната температура, дневния прием на храна и дневното телесно тегло.
МАТЕРИАЛИ И МЕТОДИ
Грижи за животните и настаняване
Всички процедури с животни са одобрени от Институционалния комитет за грижа и употреба на животните в Националния център за изследване на примати в Орегон. Възрастни мъжки мишки C57Bl/6J (Jackson Labs, Bar Harbor, ME) бяха настанени индивидуално при 12 h цикъл светлина/тъмнина и постоянна температура (22 ± 1 ° C). Храна и вода бяха на разположение ad libitum, освен ако не е посочено друго. Мишките се поддържат на стандартна чау (Purina Lab Chow, № 5001). Всички хирургични процедури са извършени под анестезия на изофлуран с помощта на асептична хирургична процедура.
Наркотици
Наркотиците се приготвят пресни в деня на употреба. За интраперитонеално (i.p.) приложение BUP (Sigma, St Louis, MO) и низоксетин (NIS; Tocris, Ellisville, MO) се разтварят в стерилен непирогенен 0.9% NaCl. GBR12783 (GBR; Tocris) и GBR + NIS се разтварят в 10% диметил сулфоксид и физиологичен разтвор. На всички остро прилагани лекарства се дава i.p. в обем от 0,1 ± 0,02 ml (според телесното тегло). Контролните мишки получиха носител в съответния обем. За субхронично приложение (чрез Alzet ® минипомпи), NIS се разтваря в 10% диметил сулфоксид и стерилен непирогенен физиологичен разтвор. BUP и GBR се разтварят в 50% диметил сулфоксид и 50% стерилен Н20. По-рано публикувани данни бяха използвани за определяне на дози от лекарства, които биха имали умерен ефект върху енергийния баланс (Billes and Cowley, 2007).
Имплантация на телеметричен транспондер и измерване на двигателната активност и температура
Дистанционната биотелеметрия беше извършена с помощта на предварително калибрирани чувствителни предаватели (PDT-4000 G2 E-Mitter ® сензори, Mini Mitter Company, Sun River, OR). Под анестезия на изофлуран, E-Mitters бяха имплантирани под подложката между скапуларната кафява мастна тъкан (IBAT) между лопатките и раните бяха затворени с конци. На мишките беше разрешено едноседмично възстановяване преди започване на проучванията. Сигналите, излъчвани от предавателите E-Mitter, бяха открити от приемник, разположен под домашната клетка на животното и преобразувани в броя на активността (произволни единици) от софтуера VitalView ® (Mini Mitter) (Harkin et al, 2002). Броят на двигателната активност е относителна мярка за брутна двигателна активност. За всички експерименти се отчитат активността и измерванията на интерскапуларната температура на всеки 6 минути.
Проучвания за остра администрация на лекарства
Мишките бяха привикнали към парадигмата за поведенческо тестване от ежедневно i.p. инжектиране на 0,1 ml стерилен физиологичен разтвор и 16 часа (през нощта) на гладно всеки трети ден в продължение на поне 2 седмици. След това на мишките се имплантираха интерскапуларни PDT-4000 E-Mitter сензори, оставиха се да се възстановят и се привикнаха в продължение на 2 седмици, преди да започнат проучванията за хранене. Всички мишки бяха разпределени в групи за лечение, балансирани по телесно тегло. Сутринта на тестването, 16 часа гладни мишки получават i.p. инжекции с прясно приготвено лекарство или носител, бяха върнати в клетката им и им бяха дадени шест предварително претеглени хранителни гранули. Като положителен контрол за ефикасността на лекарството, храната се претегля на 1, 2 и 4 часа след инжектирането.
Субхронични проучвания за администриране на лекарства
Статистически анализ
РЕЗУЛТАТИ
Остра BUP причинена лека преходна хипотермия, последвана от лека хипертермия
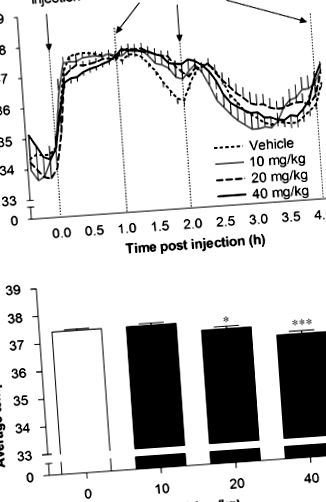
По-рано показахме, че остър BUP причинява дозозависимо и преходно увеличение на двигателната активност при мишки, което е едновременно с преходен инхибиторен ефект върху приема на храна до 1 h след инжектирането (Billes and Cowley, 2007). Времевият ход за средната интерскапуларна температура след 10, 20 и 40 mg/kg BUP е показан на фигура 1а (н= 8, животни/група за лечение; н= 22, третирани с превозни средства животни). BUP имаше значителен ефект върху средната междулопаточна температура по време на 60 минути след инжектирането (F (3, 446) = 16.40, P Фигура 3
Фигура 3д е представителна следа от средната часова температура на субхронични животни, третирани с носител или BUP на ден 3 от инфузията. В сравнение с превозното средство, субхроничното приложение на BUP значително повишава средната интерскапуларна температура по време на светлинната фаза с 0,63 ± 0,03 ° C в сравнение с контрола (т(64) = 6.12, P Фигура 4
Субхронично съвместно приложение на селективни инхибитори на обратното поемане на DA и NE Повишена активност и температура и причинена загуба на тегло
Фигура 5а е представителна следа от ефекта на субхроничните селективни инхибитори на обратното захващане на DA и NE върху двигателната активност в ден 3 на инфузията. По време на 2–7 дни от инфузията се наблюдава значителен ефект от лечението върху средната двигателна активност по време на светлината (F (3, 119) = 12,71, P Фигура 5
Фигура 5д е представителна следа от средната интерскапуларна температура на ден 3 от инфузията. Наблюдава се значителен ефект от лечението върху средната междулопаточна температура по време на светлината (F (3, 119) = 11,26, P Фигура 6
ДИСКУСИЯ
Настоящото проучване демонстрира, че субхроничното (7-дневно) комбинирано инхибиране на обратното захващане на DA + NE причинява загуба на тегло чрез повишаване на двигателната активност и междулопаточната температура, а не чрез инхибиране на приема на храна. Комбинираното инхибиране на обратното поемане на катехоламин с BUP или GBR + NIS повишава както активността, така и температурата, но BUP не причинява значителна загуба на тегло поради компенсаторно увеличаване на приема на храна. Тъй като ефектът на комбинираните селективни инхибитори на обратното захващане на DA + NE върху активността и температурата се различава от индивидуалните ефекти на тези лекарства, повишените енергийни разходи вероятно са резултат от взаимодействие между DA и NE системите. Това проучване също така предоставя нови доказателства, че загубата на тегло, наблюдавана при лечение с BUP при затлъстели хора, вероятно е резултат от повишен енергиен разход от повишена активност и термогенеза, причинени от комбиниран допаминергичен и норадренергичен механизъм.
Дистанционната биотелеметрия позволява едновременно и непрекъснато измерване на локомоторната активност и температурата в домашната клетка на животните, като минимизира объркващите променливи и дава възможност за времево събиране на данни (Harkin et al, 2002). Чрез използване на биотелеметрия за измерване на механична работа и адаптивна термогенеза при мишки по време на остра и хронична медикаментозна терапия, успяхме да регистрираме двата вида енергийни разходи, които варират в зависимост от енергийното състояние (Spiegelman and Flier, 2001).
Тъй като E-Mitters са имплантирани под IBAT, основният орган за адаптивна термогенеза при малки бозайници, температурните колебания вероятно отразяват активността на IBAT (Lowell and Spiegelman, 2000; Avram et al, 2005). Вече беше предложена идеята, че НДНТ може да бъде жизнеспособна цел за фармакотерапия на затлъстяването. Увеличаването на активността на НДНТ повишава метаболизма и предотвратява индуцираното затлъстяване при гризачи, докато генетичната мутация и фармакологичното инхибиране на НДНТ могат да причинят затлъстяване (Spiegelman and Flier, 2001; Crowley et al, 2002). Тъй като се смята, че адаптивната термогенеза допринася за намалените енергийни разходи, характерни за затлъстяването и калоричния дефицит (диета), лекарства, които повишават адаптивната термогенеза (чрез активиране на НДНТ), са предложени като възможно средство за постигане на безопасни и устойчиви енергийни разходи (Major et al, 2007).
NE, освободен от симпатиковите нервни терминали се активира β3-адренорецептори върху кафяви адипоцити при НДНТ и води до липолиза, повишена активност на разединяващия протеин-1 (UCP-1) и термогенеза (Avram et al, 2005; Fan et al, 2005). Чрез блокиране на обратното захващане на NE в терминалите на симпатиковите нерви, инхибиторът на обратното захващане на NE може да се увеличи β3-адренорецепторно активиране, като по този начин увеличава окислителното фосфорилиране и производството на топлина (Iversen, 1971). При плъхове антагонизмът на β3-адренорецепторът намалява повишената консумация на O2, причинена от BUP (Liu et al, 2004) и лекарството за отслабване сибутрамин (Connoley et al, 1999), което предполага, че активирането на НДНТ представлява значителна част от увеличените енергийни разходи с тези лекарства. Текущата констатация, че селективното инхибиране на обратното захващане на NE намалява междулопаточната температура, подчертава, че допълнителните допаминергични (при лечение с BUP) или серотонергични (при лечение със сибутрамин) са важни за поддържане на повишен симпатиков тонус и предизвикване на термогенеза.
Тъй като термогенезата чрез активиране на НДНТ е метаболитен регулаторен процес, който се контролира от хипоталамуса чрез низходящи симпатикови влакна (Lowell and Spiegelman, 2000), инхибиторите на обратното поемане на катехоламин могат да действат както централно, така и периферно, за да повлияят на интерскапуларната температура (Wellman, 2005). Доказано е, че BUP повишава DA и NE в ядрата на хипоталамуса, които регулират телесната температура като преоптичната област и предния хипоталамус (Hasegawa et al, 2005). Инхибиторите на обратното поемане на катехоламин могат също да повлияят на активността на клетките в хипоталамусната меланокортинова система, която регулира приема на калории и скоростта на метаболизма в отговор на енергийната наличност (Fan et al, 2005; Ramos et al, 2005). Например, активирането на допаминовия D2 рецептор увеличава експресията на анорексична про-опиомеланокортин иРНК и намалява експресията на орексигенен невропептид Y иРНК в дъгообразното ядро на хипоталамуса (Pelletier and Simard, 1991; Tong and Pelletier, 1992). Чрез увеличаване на извънклетъчната DA, инхибиторите на обратното захващане на DA могат индиректно да увеличат активирането на D2 рецепторите и да повлияят на активността на невроните в меланокортиновата система.
Част от ефикасността на лекарства като BUP е, че те засягат множество системи, като понякога водят до благоприятни лекарствени взаимодействия, които не могат да се предвидят въз основа на индивидуалните ефекти на селективните инхибитори на обратното захващане на DA и NE (Kaplan, 2005). Пример за лекарствено взаимодействие, което не е било предсказано, е ефектът от едновременното прилагане на субхронично DA + NE върху обратното поемане върху температурата на IBAT. По време на леката фаза, субхроничното инхибиране на обратното поемане на DA + NE причинява средно 0,4 ° C повишаване на температурата на IBAT, въпреки че температурата по същество не се влияе от инхибирането на обратното захващане на DA и намалява от инхибирането на обратното захващане на NE. Въпреки че възрастните хора нямат дефинирани периферни НДНТ отлагания, последните данни показват, че кафявите адипоцити могат да бъдат разпръснати в белите мастни отлагания. Допълнителни проучвания, свързващи човешкото затлъстяване с β3-адренорецепторите и генетичните полиморфизми на UCP-1 предполагат роля за НДНТ в енергийните разходи при хората (Avram et al, 2005).
Препратки
Ansah TA, Wade LH, Shockley DC (1996). Промени в двигателната активност, основната температура и сърдечната честота в отговор на многократно приложение на кокаин. Физиол Бехав 60: 1261–1267.
Appolinario JC, Bueno JR, Coutinho W (2004). Психотропни лекарства при лечение на затлъстяване: какво обещава? Лекарства на ЦНС 18.: 629–651.
- Чести причини за неволно отслабване - Семейни медицински центрове
- Осем често срещани причини за отслабване на котки
- Диетично и физическо поведение сред възрастни, успешни в поддържането на загуба на тегло
- Упражнението е по-важно от диетата за поддържане на загуба на тегло Физическата активност помага да се предотврати
- Дейвид Къркпатрик Малки количества физическа активност водят до отслабване