Департамент по градинарство и природни ресурси, Държавен университет в Канзас, Манхатън, KS 66506, САЩ
Департамент по градинарство и природни ресурси, Държавен университет в Канзас, Манхатън, KS 66506, САЩ
Катедра по молекулярна и човешка генетика, Медицински колеж Baylor, Хюстън, Тексас 77030, САЩ
Институт Бойс Томпсън, Университет Корнел, Итака, Ню Йорк 14853, САЩ
Служба за земеделски изследвания, Министерство на земеделието на САЩ; Катедра по педиатрия, Медицински колеж Baylor, Детски изследователски център за хранене, Хюстън, Тексас 77030, САЩ
* Автор за кореспонденция:
Служба за земеделски изследвания, Министерство на земеделието на САЩ; Катедра по педиатрия, Медицински колеж Бейлор, Изследователски център за детско хранене, Хюстън, Тексас 77030, САЩ
** Автор за кореспонденция:
Департамент по градинарство и природни ресурси, Държавен университет в Канзас, Манхатън, KS 66506, САЩ
Резюме
Изкуствената технология miRNA позволява генерирането на siRNAs да регулира експресията на целевите гени. Въпреки това, приложението на siRNAs за промяна на генната експресия е предизвикателство поради тяхната нестабилност и изисква средства за ефективно доставяне на siRNAs в гостоприемника. Тук докладваме, че siRNAs, насочени към mRNAs на животни, могат да бъдат хетероложно експресирани и стабилно произведени в маруля. Ние модифицирахме прекурсори на miRNA ориз, за да произведем siRNAs в маруля с потенциал да насочим mRNAs на миши комплемент 3 (С3) и фактор на коагулация 7 (CF7). Експресията на първични и зрели siRNAs в линиите на трансгенната маруля беше потвърдена чрез секвениране на Sanger. Нашето проучване демонстрира приложим инструмент за промяна на генната експресия в целевия гостоприемник и има потенциална полезност в siRNA-базирана орална терапия.
ОБОБЩЕНИЕ НА МЕТОДА
Персонализирахме скелет на оризова miRNA, Osa-MIR528, за да конструираме вектори за растителна експресия, съдържащи amiRNAs, насочени към РНК на миши пратеник. Тази система, която преди беше използвана за експресия на амиРНК в еднокопитни растения, сега се използва за генериране на амиРНК в селскостопански важни дикоти като маруля, позволявайки производството на siRNAs, насочени към различни медицински важни протеини, които потенциално биха могли да бъдат доставени чрез диетата.
Генезисът на тези проучвания е желанието да се предоставят точни инструменти за изследване на връзката между консумацията на генетичен материал с диетата и промените в генната експресия. Тази работа установява значението на растителните храни, експресиращи siRNAs, които са насочени към гени в черния дроб на мишката. Всички промени в експресията на чернодробни гени могат да бъдат количествено определени с помощта на прости, установени анализи, които следят експресията на функционалните протеини. Проектираните тук линии за трансгенни марули поставят масата за бъдещи диетични изследвания. Коагулацията на кръвта, регулирана от фактори на комплемента на бозайници, включително комплемент 3 (C3) и фактор на коагулация 7 (CF7) в черния дроб, е жизненоважен процес за спиране на кървенето, причинено от нараняване на кръвоносните съдове [11]. Доказано е обаче, че прекомерното производство на С3 и CF7 причинява кръвни съсиреци, които могат да представляват значителни рискове за здравето и да доведат до смърт поради неправилно функциониране на сърдечно-съдовата система [12,13].
В това проучване марулята се използва за производство на диетични amiRNAs, предназначени да се насочват С3 и CF7 пратеник РНК. Ендогенен оризов miRNA скелет, 245-bp фрагмент от osa-MIR528 [14,15], е персонализиран за проектиране на amiRNAs, насочени към C3 и CF7 протеини на мишка. C3 и CF7 amiRNA последователностите са проектирани ръчно с анотиране на миши геномни последователности и 21 bp на osa-MIR528 са заменени от C3 и CF7 amiRNA последователности с помощта на PCR (Фигура 1А).
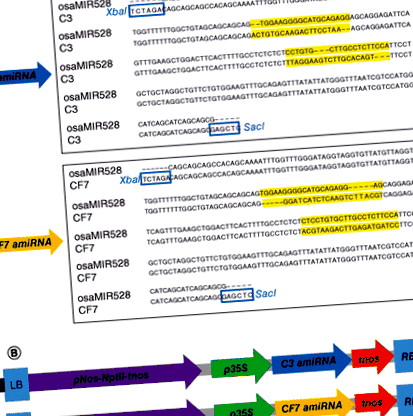
(А) 21 bp на osa-MIR528 (черни букви) от последователността на стволовия цикъл бяха заменени от последователности C3 (горен панел) и CF7 (долен панел) (червени букви), за да се създадат съответно siRNAs. Използваните сайтове за клониране бяха XbaI и SacI които вмъкват фрагмент от приблизително 259 bp след рестрикционно разграждане. (Б) Карта на T-DNA областта на бинарните вектори (горния панел, pC3amiRNA; долен панел, pCF7amiRNA), използвани за трансформация.
LB: лява граница; NPTII: Неомицин фосфотрансфераза; p35S: Промотор на 35S вирус на карфиолна мозайка; pNos: Нопалин синтаза промотор; RB: Дясна граница; tnos: Терминатор на нопалин синтаза.
Генерирахме три независими C3 (С3siRNA-1, -2 и -3) и CF7 (CF7siRNA-1, -2 и -3) трансгенни линии, които се самоопрашват и линиите на потомството са генотипирани за присъствието на Т-ДНК (Фигура 2А). 245 bp от вектора, включващ amiRNA последователности, бяха използвани като маркер за контрол на размера, за да се потвърди вмъкването на amiRNA последователности в геномна ДНК. ДНК от всички трансгенни линии показва 245-bp лента, съответстваща на размера на маркера. Не е открит PCR продукт за контролни растения (Фигура 2В). 3-месечното С3- и CF7-експресиращи маруля растения са сравними с дивия тип растения и фенотип и добив от С3- и CF7-експресиращи марули растения са неразличими от тези на дивия тип растения, отглеждани при нормални условия на растеж (Фигура 2С). Израз на С3 и CF7 не изглежда да има неблагоприятни ефекти върху цялостната морфология на растенията.
Фигура 2. Молекулярни и фенотипни анализи на C3siRNA- и CF7siRNA-изразяващи марули.
(А) PCR откриване на NPTII ген в геномно ниво на трансформирани марули. (Б) PCR откриване на C3 и CF7 изкуствени микроРНК вложки в маруля геномна ДНК. Положителен контрол, изкуствени микроРНК; отрицателен контрол, маруля от див тип. Последователностите на грундовете са показани в Таблица 1. (° С) Фенотипове на C3siRNA-изразяващ, CF7siRNA-експресиращи и WT марули.
NPTII: Ген на неомицин фосфотрансфераза II; WT: див тип.
За да се определи броят на трансгенните копия в трансформирани растения, беше извършена абсолютна количествена оценка с помощта на количествена PCR в реално време. Общият реакционен обем за всяка проба е 10 μl и пробите съдържат 60 ng геномна ДНК, 30 pmol правни и обратни праймери и 7,3 μl iQ ™ SYBR ® Green Supermix (Bio-Rad Laboratories, CA, USA). Праймерите за напред и назад са създадени, за да амплифицират оса-MI-528 скелета в Т-ДНК областта (Таблица 1). Следващият термичен цикъл беше извършен с използване на CFX96 Bio-Rad термоциклер: 94 ° C за 10 минути, последвани от 34 цикъла от 95 ° C за 30 s, 58 ° C за 20 s и 72 ° C за 30 s. Използвани са две технически копия. Поредица от петкратни разреждания на геномна ДНК бяха нанесени спрямо стойностите на прага на цикъла (Ct), за да се генерира стандартна крива (допълнителна фигура 2А). Стойностите на Ct на пробите и наклонът и пресечната точка на стандартната крива бяха използвани за изчисляване на числото на трансгенното копие като Ct (проби) = наклон (стандартна крива) × log (copy.number) + отсечка (стандартна крива) [20 ]. Анализът на броя на трансгенните копия също потвърждава успешното интегриране на две до шест копия на Т-ДНК в генома на трансгенните линии на марулята (допълнителна фигура 2Б).
| NptII PCR | 5′-gaggctattcggctatgactg-3 ′ | 5′-atcgggagcggcgataccgta-3 ′ |
| Първичен amiRNA PCR и номер на копие qPCR | 5′-cagcagcagccacagcaaaat-3 ′ | 5′-atggcatcagcatcagcagc-3 ′ |
| Първична amiRNA полуколичествена RT-PCR | 5′-cagcagcagccacagcaaaat-3 ′ | 5′-atggcatcagcatcagcagc-3 ′ |
| Количествен вътрешен контрол на PCR в реално време (вътрешен протеин на тонопласт 41) | 5′-gagagatttgctggagggaaacta-3 ′ | 5′-cctttgactgatgatgtttgga-3 ′ |
| Зряла амиРНК крайна точка PCR и количествена PCR в реално време | ||
| - Допълнение 3 | 5′-ctcagcccactgtgcaagac-3 ′ | 5′-ccagtgcagggtccgaggta-3 ′ |
| - Коагулационен фактор 7 | 5′-cacgccgggatcatctcaa-3 ′ | 5′-ccagtgcagggtccgaggta-3 ′ |
| Обратна транскриптаза на стволови контури | ||
| - Допълнение 3 | 5′-gtcgtatccagtgcagggtccgaggtattcgcactggatacgacctttag-3 ′ | |
| - Коагулационен фактор 7 | 5′-gtcgtatccagtgcagggtccgaggtattcgcactggatacgacacgtaa-3 ′ | |
Трансгенните растения, потвърдени чрез PCR, бяха допълнително подложени на полуколичествена RT-PCR, за да се провери дали интегрираната T-DNA е успешно транскрибирана в марулята. Общата РНК се изолира с помощта на реагент TRIzol ™ (Thermo Fisher Scientific) и след това се третира с ДНКаза I без РНКаза, за да се елиминира замърсяването на геномна ДНК. Един микрограм РНК е използван за cDNA, синтезирана с помощта на Oligo (dT) Primer (Bioline, Лондон, Великобритания), следвайки инструкциите на производителя на комплекта (RevertAid First Strand cDNA Synthesis Kit, Thermo Fisher Scientific). Полуколичествената RT-PCR се провежда, като се използва специфичен набор от праймери, предназначени да амплифицират 245 bp, съдържащи първични амиРНК последователности от експресионната касета. Следващата програма за термоциклиране беше използвана за откриване на нашата цел: 94 ° C за 5 минути, последвани от 35 цикъла от 94 ° C за 1 минута, 59 ° C за 45 s, 72 ° C за 1 min и 72 ° C за 10 минути. Полуколичествената RT-PCR показва 245 bp ленти, съответстващи на очаквания размер на първичните амиРНК. В контролните инсталации не е открит PCR продукт (Фигура 3А).
Фигура 3. PCR откриване на първични и зрели амиРНК и секвенция на Сангер на зрели амиРНК на С3 и CF7 с помощта на универсален обратен праймер на стволови цикли.
(А) RT-PCR откриване на първични C3 и CF7 амиРНК от C3siRNA- и CF7siRNA-изразяващи марули. Отрицателен контрол, маруля от див тип. (Б) PCR откриване на крайната точка на стволовия цикъл на зрели амиРНК C3 и CF7 от C3siRNA- и CF7siRNA-изразяващи марули. Отрицателен контрол, маруля от див тип. Последователностите на грундовете са показани в Таблица 1. (° С) Очаквани и получени последователности на зряла C3 amiRNA. (Д) Очаквани и получени последователности на зряла CF7 амиРНК.
В нашето проучване генерирахме С3- и CF7-изразяващи марули. Експресията на първични и зрели амиРНК в трансгенната маруля беше проверена чрез полуколичествена RT-PCR и съответно PCR в крайна точка и беше допълнително потвърдена чрез секвениране. Стабилното производство на животински siRNAs в годни за консумация листни растения с висока биомаса и доставянето им като хранителни siRNAs има голям потенциал за преодоляване на ограниченията на нестабилните голи siRNA приложения.
Авторски приноси
S Park и KD Hirschi са проектирали експериментите. T Kakeshpour, TM Tamang, WD Park, M Manohar и J Yang извършиха експериментите. T Kakeshpour, TM Tamang и S Park анализираха данните. Всички автори са допринесли за написването на ръкописа.
Благодарности
Благодарим на JK Park за отлична техническа помощ по отношение на трансформацията на маруля.
Разкриване на финансови и конкурентни интереси
Този проект е финансиран от конкурентна безвъзмездна финансова помощ 2016-67017-24712 от Инициативата за земеделие и хранителни продукти от Министерството на земеделието на САЩ (USDA) Национален институт по храните и земеделието (S Park), грант номер на Националната научна фондация IOS-1741090 (S Park) и USDA Служба за земеделски изследвания по споразумение за сътрудничество номер 58-3092-5-001 (KD Hirschi). Съдържанието на тази публикация не отразява непременно възгледите или политиките на USDA, нито споменаването на търговски наименования, търговски продукти или организации не предполага одобрение от правителството на САЩ. Авторите нямат други свързани или финансови ангажименти с която и да е организация или субект с финансов интерес или финансов конфликт с предмета или материалите, обсъдени в ръкописа, с изключение на тези, разкрити.
При изготвянето на този ръкопис не е използвана помощ при писането.
Свободен достъп
Това произведение е лицензирано под лиценза Attribution-NonCommercial-NoDerivatives 4.0 Unported. За да видите копие на този лиценз, посетете http://creativecommons.org/licenses/by-nc-nd/4.0/
Хартиите със специална бележка са подчертани като: • представляващи интерес; •• от значителен интерес
- Сравнение на лезии на тънките черва с помощта на капсулна ендоскопия при улцерозен колит и болест на Crohn’s
- Промяна на здравословното поведение чрез телекомуникационна технология Използване на интерактивна телевизия за лечение
- План за диетично хранене; Резултати Какво да очаквате след използване на Trifecta
- Актуализацията на коронавирус (COVID-19) FDA разрешава първия диагностичен тест, използващ At-Home Collection от
- Качество на диетата, свързано с честотата на технологиите за домашно готвене
