Първоначално калцитът се изчерпва, последван последователно от доломит-анкерит и сидерит (Blowes and Ptacek, 1994).
Свързани термини:
- Калциев карбонат
- Разтваряне
- Полев шпат
- Подземни води
- Гипс
- Руда
- Утайка
- Пирит
- Кварц
- Силикат
Изтеглете като PDF
За тази страница
Последен напредък в изследванията на ЯМР в твърдо състояние на биоминерализация
Тим W.T.Tsai, Jerry C.C. Чан, в Годишни доклади за ЯМР спектроскопията, 2011
3.1.1 Калциев карбонат
Калцитът е най-стабилната форма на калциев карбонат. Проби от 13 C-обогатен калцит са проучени от Phillips и колеги. 74 Вариацията на 13 C CPMAS сигнала като функция от времето за контакт наподобява тясно очакваната за изолирана двойка на спин 13 C - 1 H и следователно извлеченото междуядрено разстояние (1,9 ± 0,1 Å) дава сериозни доказателства за присъствието на бикарбонатни дефекти. Интересното е, че и 13 C < 1 H>CPMAS спектърът (време на контакт от 0,3 ms) и 13 C спектърът на разпадане на Bloch показват единичен резонанс при 168,7 ppm, но свързаните с тях модели на въртяща се странична лента при скорост на центрофугиране от 1 kHz са доста различни. Очевидно, изотропното 13 C химично изместване не е добър производител на спектра, за да се разграничат карбонатните групи и бикарбонатните дефекти в калцита. От 13 С < 1 H>Измерването на HETCOR, 1H сигналът при 7,4 ppm, който може да се наблюдава и в 1 H MAS спектъра, се приписва на бикарбонатните дефекти на калцита. 74 Този относително остър пик при 7,4 ppm се наблюдава и в 1 H MAS спектрите на проби от естествен калцит. 74 Отбелязваме мимоходом, че 13 C химичните измествания и CSA на K2CO3 и KHCO3 са много различни от тези на калцита, вероятно поради тяхната разлика в силата на водородната връзка. 74–76
Повърхностни и подземни води, атмосферни влияния и почви
7.2.8.4.4 Окисляване на пирит с разтваряне и неутрализация на калцит
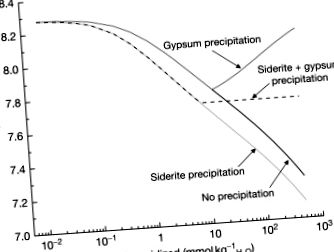
Калцитът често се среща с пирит в минерализирани райони. Варовикът също се използва за неутрализиране на AMD. Поради тези причини следващият набор от реакции, които си струва да се моделира, ще бъде смес от пирит и калцит, но трябва да се вземат решения относно дела на тези минерали и кои минерали трябва да се оставят да се утаяват като вторични фази. Най-простият случай би бил при аноксични условия, така че Fe (II) не се окислява, излишъкът от калцит би позволил утаяване на гипс и сидерит. Тази симулация е показана в Фигура 10, със и без утаяване на вторични минерали и винаги при условия на отворена система. Въпреки че рН намалява без образуване на вторични минерали, това се дължи предимно на относителните пропорции на калцит и пирит, които се разтварят. За разлика от това, позволяването на утаяване на гипса води до увеличаване на рН, тъй като за да се поддържа равновесието, по-големи количества калцит трябва да се разтворят, за да замести калция, отстранен от утаяването на гипс. При утаяване на сидерит и гипс рН се буферира, тъй като в равновесната реакция не се образуват или консумират протони:
Фигура 10. Промяна в рН като функция на пирит, окислен в присъствието на обилен калцит с линии, показващи ефектите от (i) липса на вторични минерални валежи, (ii) само утаяване на гипс, (iii) утаяване само на сидерит и (iv) валежи от гипс и сидерит.
Освен това, началото на утаяване на гипс и сидерит се случва близо до едни и същи условия, след като около 10 mmol kg H 2 O - 1 пирит се окисли (или близо 550 mg l - 1 разтворено желязо и 2000 mg l - 1 разтворен сулфат). При оксидни условия се наблюдава подобна тенденция с рН около 7,72 с утаяване както на гипс, така и на ферихидрит.
Фигура 11. (а) Промяна в рН като функция на окисления пирит и спрямо променящите се молни съотношения на калцит/пирит от 0,5 до 2 без окисляване на разтвореното желязо. Необходимо е поне молно съотношение 1: 1 за буфериране на рН близо до неутралност, но ако се оставят да се утаят вторични фази (гипс и сидерит), се изисква по-високо съотношение от около 2. (b) Промяна в рН като функция на окисления пирит и спрямо промяната на молните съотношения на калцит/пирит от 0,5 до 2 с окисляване на разтвореното желязо. Този график показва, че молните съотношения, по-високи от 2, са необходими за адекватно неутрализиране на киселинността от пиритовото окисление.
Калциев карбонат
5.1 Кристална фазова трансформация
Калцитът, стабилна безводна форма на СаСО 3, претърпява серия от структурни преходи към по-плътни фази на калцит II – IV с нарастващо налягане [108,110,111]. В допълнение към гореспоменатите форми на калцит, съществува по-плътна форма калцит VI, която може да се образува с помощта на експерименти с ударно компресиране [112]. При още по-високо налягане (> 100 kbar) е известно, че калцитът претърпява още един фазов преход, известен като калцит IV [114–116]. Обаче монохидрокалцитът, хидратната форма на калцита, не е стабилен термодинамично и ще се трансформира в други кристални фази при загуба на кристална вода (напр. Калцит и арагонит) [78, 240]. Освен това ниското съдържание на Mg във воден разтвор ще доведе до превръщането му в арагонит в продължение на 25 дни при стайна температура [373,374] .
Арагонитът, метастабилна безводна форма на CaCO3, ще остане непроменен в продължение на десетки милиони години в сухи условия при температури под 400 ° C. Ако обаче има вода, арагонитът ще се превърне в калцит за няколко месеца поради по-голямата си разтворимост във вода. Разликата в разтворимостта е една от причините арагонитът да не е толкова често срещан в геоложките легла и рядко се среща извън органично контролирани системи [225]. При стандартна температура и налягане арагонитът е термодинамично нестабилен и има тенденция да се променя до калцит [375]. При високо налягане той се превръща в стабилна фаза [117]. Бяха идентифицирани постарагонитова фаза в CaCO3 при налягане от 40 GPa и редица енергийно конкурентни структури (стабилна фаза I и метастабилни фази II – IV) [118]. Над 137 GPa, фаза I със структура от пироксен тип с вериги от CO4 4 - тетраедри става по-стабилна от постарагонита.
Ватеритът също е метастабилна безводна форма на CaCO3 при условия на околната среда и след като е изложен на вода, той се превръща в арагонит или калцит [376]. Това е рядък минерал в геоложки условия, въпреки че може да бъде важен предшественик в няколко карбонатообразуващи процеса [238] .
Аморфната форма на CaCO3 е нестабилна твърда фаза, която претърпява бърза трансформация в по-стабилни безводни форми, докато двете хидратирани форми монохидрокалцит и икаит могат да се запазят непроменени в продължение на няколко дни при температури под 0 ° C, преди да преминат в калцит. В резултат на това приготвянето на икаит се извършва при температури под - 10 ° C [62]. Mg йони бяха забелязани, за да подобрят още повече трансформацията на формата на аморфния CaCO3 в арагонит [128]. Бентов и др. подобри стабилността на аморфния CaCO3 от богати на фосфати протеини от органична матрица и от единични фосфоаминокиселини [377]. Такава стабилна форма показва подобрение на разтворимостта и бионаличността в сравнение с кристалната форма [378,379] .
Икаит, хидратна форма на CaCO3, е термодинамично стабилен при умерено налягане близо до земната повърхност. Открит е в дълбоководни и континентални шелфови седименти и в места за изхвърляне на подземни води в езера, ледникови среди, крайбрежни води и морски лед [380–383]. Той се разлага бързо, като губи по-голямата част от водното си съдържание, след като бъде отстранен от почти замръзващата вода [239]. Както аморфната, така и икаитната форма са метастабилни в околната среда и лесно се променят до по-стабилната форма на калцит [223,375] .
Контрол на минералната скала на нефтеното поле
Ping Zhang,. Мейсън Б. Томсън, в Mineral Scales and Deposits, 2015
24.2.1 Карбонатни везни
Доломит. Доломитът е минералното наименование на Ca0,5Mg0,5 (CO3). Доломитът може да се образува в геоложки формации с течение на времето от калцит, но не се наблюдава в производствените съоръжения.
Синтез на повърхността върху (10.4) повърхността на насипния изолатор Калцит
Калцит
Калцитът е най-стабилната модификация на калциевия карбонат (CaCO 3). Като такъв той е важен минерал, образуващ скали и най-разпространеният карбонат в земната кора. Той играе основна роля в много геохимични, биологични и индустриални 19 процеси. Калцитът участва в цикъла на земния карбонат и по този начин например също е от решаващо значение за съхранението на антропогенен въглероден диоксид. Освен термодинамичните по-малко стабилни модификации арагонит и ватерит, калцитът е важен компонент в много биоминерали и освен това е добре известен със своето изразено двойно пречупване ( Фигура 1А )
Фиг. 1 . (A) Снимка на калцитов кристал, (B) модел на равнината на разцепване (10.4) с елементарната клетка, маркирана с правоъгълник, и (C) AFM изображение на калцит (10.4) в UHV.
Калцитът е изолатор с лентова междина около 6 eV и кристализира в тригонална система с R3c симетрия. Примитивната единична клетка е ромбоедър, който също се нарича „структурна единична клетка“. Използвайки ромбоедричните оси на структурната единична клетка, най-стабилната равнина на разцепване е равнината (211). Въпреки това, шестоъгълната единична клетка вместо това се използва често в литературата. В тази шестоъгълна система най-стабилната равнина на разцепване се обозначава като (1014) равнина - често съкратено чрез писане (10.4), където точката е полезна за обозначаване на шестоъгълната единична клетка, която е референтна.
(10.4) равнината на разцепване има правоъгълна единична клетка с размери 0.50 nm × 0.81 nm, както е посочено в Фигура 1В . Единичната клетка съдържа два калциеви йона и две карбонатни групи. Последните имат кислороден атом в, над и под равнината, която се определя от въглеродните атоми. Двете карбонатни групи в елементарната клетка се въртят една спрямо друга. Представлява се AFM изображение с висока разделителна способност на калцит (10.4), получено при UHV при стайна температура Фигура 1С .
Дислокации в минерали
2.4 Карбонати
Калцитът и доломитът представляват значителна част от седиментните скали. Калцитът CaCO 3 има тригонална симетрия, въпреки че обикновено се описва в шестоъгълни оси. 1 3 〈02 2 ¯ 1〉 < 1 1 ¯ 04 >е предпочитаната плъзгаща система в калцит в широк температурен диапазон (Wenk et al. 1983). Над 500 ° C, калцитът може да се деформира и от 1 3 〈11 2 ¯ 0〉 (0001) плъзгане и 1 3 〈01 1 ¯ 0〉 < 1 1 ¯ 02 >(De Bresser and Spiers 1997). При ниска температура 1 3 〈02 2 ¯ 1〉 дислокациите се плъзгат не само на < 1 1 ¯ 04 >, но и нататък < 1 1 ¯ 02 >(въпреки че последната система на приплъзване има по-високо критично разрешено напрежение на срязване (CRSS); De Bresser and Spiers 1997). Механичното побратимяване е важен механизъм на деформация в калцита. Най-често срещаният закон за побратимяване на деформациите е включен < 01 1 ¯ 8 >, за които срязващото изместване е в положителния смисъл, в посока 〈0 2 ¯ 21〉 (Barber and Wenk 1979). Незначителна деформация побратимяване на < 1 1 ¯ 04 >и < 1 1 ¯ 02 >докладвани са и самолети.
- Диета на Аткинс - общ преглед на ScienceDirect теми
- Атрофичен гастрит - общ преглед на ScienceDirect теми
- Черен кимион - общ преглед на ScienceDirect теми
- Аурикулотерапия - общ преглед на ScienceDirect теми
- Преглед на космическата медицина - ScienceDirect