Райнер Й. Клемент
Отделение по лъчетерапия и лъчева онкология, болница Леополдина Швайнфурт, Густав-Адолф-Щрасе 8, 97422 Швайнфурт, Германия
Колин Е. Шампион
Катедра по радиационна онкология, Университет в Питсбърг, Институт за рак, Питсбърг, Пенсилвания, САЩ
Резюме
Заден план
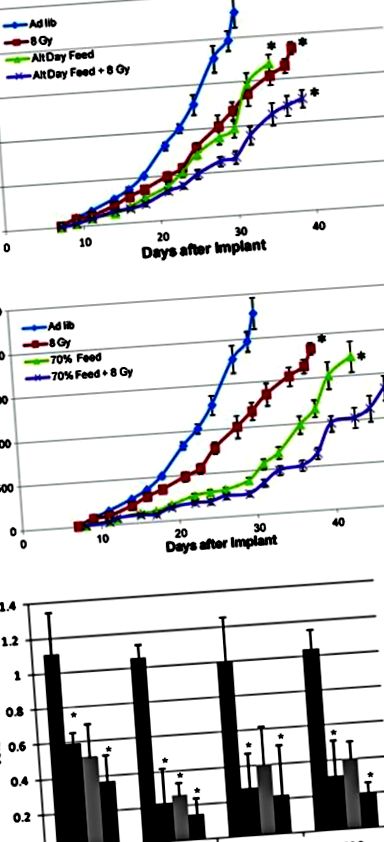
Лишаване от хранителни вещества чрез алтернативно дневно гладуване (а) или общо калорично ограничение (б) синергично работят с лъчева терапия, за да забавят значително растежа на тумора и да регулират няколко ключови пътя (° С). AL ad libitum хранене, ограничаване на калориите в CR (взето с разрешение от Saleh et al. [21])
Целта на този преглед е следователно да се повиши осведомеността за потенциалните ползи от CR и KD като допълнение към лечението на пациенти с рак по време на RT и силните предклинични данни, разкриващи, че тези начини могат да повишат ефикасността на RT. Такива ползи варират от клетъчно ниво до глобален метаболизъм и подчертават връзката между метаболизма на туморните клетки и този на неговия приемник. Фокусът се поставя и върху общите черти и разликите между тези диетични модификации, които трябва да се имат предвид при разработването на допълнителни диетични стратегии за лечение.
Калории или въглехидрати? Подобни метаболитни ефекти от ограничаването на калориите и кетогенната диета
CR обикновено се определя като 30-50% намаляване на енергийния прием без недохранване в сравнение с храненето ad libitum. Калоричният дефицит може да бъде предизвикан или чрез периодично гладуване (IF), крайната форма на което е само краткосрочно гладуване (STF), или хронично ежедневно ограничаване на енергията (DER). Въпреки това, тъй като предклиничните данни се екстраполират на хората за проектиране на клинични изследвания, важно е да се отбележи, че DER при мишки съответства на терапевтичен STF при хора. В този смисъл, гладуването за 1 ден в мишката е приблизително сравнимо с едноседмично гладуване само с вода при човек [23].
Ограничаването на калориите (CR) и кетогенната диета (KD) са насочени към същите молекулярни пътища, които също са насочени индивидуално от лекарствата за подобряване на резултатите от лечението на рака. Стрелките показват активиране, инхибиране на пресечени линии. Ограничаването на въглехидратите (СНО) нагоре регулира окисляването на мастните киселини и кетогенезата (полезно за нормалните тъкани) и уврежда гликолизата и глутаминолизата (вредно за туморните клетки). Вижте раздел 2 за повече подробности
Как ограничаването на калориите и въглехидратите може да повлияе на отговора на лъчетерапията
Илюстрация на типична крива на вероятността за контрол на тумора (плътна синя линия) и крива на вероятността от усложнения на нормалната тъкан (червена плътна линия) като функция от общата доза, доставена на тумора. Ние твърдим, че CR и евентуално KD могат да увеличат терапевтичния прозорец чрез благоприятно въздействие върху двете криви, т.е.диференциален отговор между тумора и нормалната тъкан
Петте R на радиобиологията
Възстановяване на увреждане на ДНК
Взаимодействието на йонизиращото лъчение с молекулите в тъканта води до производството на свободни електрони, оставяйки зад себе си заредени молекули с несдвоени валентни електрони, наречени радикали. Радиолизата на водата е най-честото йонизиращо събитие извън ДНК и води до образуването на реактивни кислородни форми (ROS), включително хидроксилния радикал (OH •) и неговия продукт на реакция с кислород, водороден прекис (H2O2). ROS са способни да дифузират и окисляват ДНК на различни места, включително захарно-фосфатния скелет, водещ до единични (SSB) и двуверижни скъсвания (DSB). Докато една лезия обикновено може да бъде възстановена и се счита за сублетална, натрупването на сублетални лезии с увеличаване на дозата може да доведе до тяхното взаимодействие и превръщане в летални лезии. Следователно разликите между туморите и нормалните тъкани в способността за възстановяване на сублетални увреждания са важна аргументация за фракционирана RT.
Противно на това, възможно е CR да наруши възстановяването на DSB в туморните клетки и по този начин да допринесе за повишена клетъчна смърт. Chen et al. показа, че инхибирането на mTOR чрез рапамицин или еверолимус уврежда както HRR, така и NHEJ в MCF7 клетките на рака на гърдата, без значителни промени в няколко важни протеини за възстановяване на ДНК [60]. Важно е, че зависим от дозата ефект на CR върху инхибиране на mTOR, медииран от AMPK, се наблюдава и при модел на рак на гърдата на плъхове [61], което предполага, че гладуването може да има подобни негативни ефекти върху способността за възстановяване на ДНК при тумори на млечната жлеза като рапамицин. Song et al. инкубирани миши фибросаркомни клетки с 5 mM метформин в продължение на 24 часа преди и след облъчване [62]. Третираните клетки показват по-стръмна крива на оцеляване с по-тясно рамо, което показва увеличено натрупване на сублетални лезии при дадена доза и предполага нарушено възстановяване на ДНК.
В обобщение е показано, че CR подобрява различни механизми за възстановяване на ДНК в нормални тъкани, включително HRR и NHEJ, които са от съществено значение за индуцираното от RT възстановяване на DSB. За разлика от това, капацитетът за възстановяване в раковите клетки може да остане незасегнат или дори отслабен чрез CR. Изглежда, че диференциалната устойчивост на стрес между нормалните и раковите клетки към химиотерапевтични лекарства се медиира поне отчасти от намалените нива на глюкоза и свободен IGF-1 [47, 50]; следователно може да се предположи, че KD може да постигне подобни ефекти, въпреки че това ще трябва да бъде проучено в бъдещи проучвания.
Повторно заселване на туморните клетки
В заключение, CR и KD са показали значителни инхибиторни ефекти върху растежа на тумори в проучвания върху животни, които биха предсказали ляво изместване на TCP кривата (Фиг. 3). Въз основа на механистични прозрения, че пътят IGF-1/инсулин – PI3K – Akt – mTORC1 и гликолизата играят ключова роля за пролиферацията на туморни клетки и подкрепени от положителни доказателства от проучвания с малки пациенти, ние предполагаме, че CR и KDs могат да бъдат използвани като поддържащи стратегии за целенасочена репопулация на туморни клетки по време на RT.
Преразпределение в клетъчния цикъл
Нормалните клетки прекъсват типичния клетъчен цикъл след излагане на йонизиращо лъчение, за да се осигури достатъчно време за възстановяване на ДНК, или в случай на екстремни или непоправими увреждания, да се подготвят за клетъчна смърт или стареене. Преходът от едната фаза на цикъла в другата се регулира от семейство кинази, известни като циклин-зависими кинази (CDK), чиято активност се регулира чрез три механизма: (1) асоциация с фазозависими протеини, наречени циклини; (2) фосфорилиране и дефосфорилиране; (3) инхибиране от CDK инхибитори като р21. Клетките са най-чувствителни към увреждане на ДНК по време на репликация и митоза, т.е. съответно S и M фазите на цикъла. Следователно фазите, предхождащи митозата, използват различни молекулярни пътища, известни като контролни точки, за да гарантират, че необходимите стъпки за дадена фаза са завършени и няма сериозно увреждане на ДНК, което не е поправено. В туморните клетки контролните точки често се заменят от онкогенно активиране на пролиферативно сигнализиране чрез PI3K-Akt [79, 80] и/или загуба на функция на гени на вратаря като TP53. От това следва, че с увеличаване на броя на фракциите на RT, йонизиращото лъчение води до намаляване на фракцията на нормалните клетки в чувствителни S и M фази, докато туморните клетки са най-вече незасегнати от преразпределението.
Обратно, в нормалните клетки намаляването на митогенните стимули, индуцирано от CR и може би в по-малка степен, KD благоприятства преразпределението в неразделно състояние, за да се запази и преразпредели енергията за клетъчните защитни механизми [50]. Тази находка може да се използва клинично, като пациентите са бързи преди всяка сесия на RT и/или цикъл на химиотерапия [48, 49]. Safdie et al. съобщава, че гладуването преди и/или след химиотерапия намалява симптомите на слабост и умора, като същевременно намалява стомашно-чревните странични ефекти в сравнение с нормалната диета при шест пациенти с рак, подложени на медиана от четири цикъла на химиотерапия [48]. При мишки C57BL/6J CR регулира Gadd45a и p21 по зависим от FOXO1 начин [57]. Обаче, тумори с FOXO инактивиране поради хиперактивна PI3K-Akt сигнализация не биха могли да се възползват от CR-индуциран арест на клетъчния цикъл при облъчване, предоставяйки допълнителна възможност за разширяване на терапевтичния прозорец.
В обобщение, CR организира преразпределение на нормални клетки в клетъчния цикъл, потенциално ги предпазва от последващи ДНК увреждащи обиди като RT. Ситуацията в туморните клетки изглежда съвсем обратна. Тук гладуването изглежда насърчава прогресията на клетъчния цикъл, натрупването на М фаза и енергийните разходи, като по този начин прави тези клетки синтетично уязвими към комбинацията от ограничаване на хранителните вещества с RT или химиотерапия.
Реоксигениране
Основно предизвикателство за RT е наличието на хипоксични зони в солидните тумори. Липсата на кислородни молекули в тези региони инхибира образуването на H2O2 от OH •, като по този начин намалява честотата и тежестта на увреждането на ДНК. Единична фракция от облъчване за предпочитане убива добре оксигенираните клетки, но реоксигенирането на хипоксичните зони се случва по време на фракционирано лечение, отчасти поради свиване на тумора. Хипоксията улеснява възстановяването на ДНК и води до стабилизиране на α-субединицата на индуцируем от хипоксия фактор (HIF) -1, транскрипционен фактор, който се намира след mTOR и повишава гликолизата [84]. Пътят Akt – mTOR повишава регулирането на транслацията на HIF-1α иРНК по зависим от глюкозата и реоксигенацията след облъчване [85].
Туморите притежават хетерогенна мрежа от анормални кръвоносни съдове, характеризиращи се с хаотично анатомично подреждане, задънени улици и повишена теч, което води до повишено налягане в интерстициалната течност [86]. Това води до области с хронична и остра хипоксия, като първата се появява, където доставката на кислород е ограничена от дифузия от проксималните кръвоносни съдове, а втората, където перфузията е временно свита. Анормалната васкулатура се причинява от излишък на проангиогенна сигнализация, главно поради съдов ендотелен растежен фактор 2 (VEGF). VEGF е друга цел на HIF-1α, но транскрипцията му също се увеличава чрез епигенетична модулация от възпалителни цитокини, растежни фактори и полови хормони. Противно на това, което може да се очаква от инхибиране на VEGF и следователно на образуване на нови кръвоносни съдове, се натрупват доказателства в подкрепа на хипотезата, че анти-VEGF терапията всъщност намалява хипоксията и улеснява доставката на химиотерапевтични лекарства към раковите клетки чрез нормализиране на съдовата система, което от своя страна нормализира микросредата [86].
Тъй като VEGF е регулиран нагоре като последица от сигнализирането на Akt – mTOR – HIF-1α, всяка стратегия, която инхибира този път, може да бъде хипотеза за намаляване на експресията на VEGF и прогресията на тумора. Mukherjee, Seyfried и колеги съобщават, че CR понижава VEGF и нормализира васкуларизацията в редица тумори на простатата и мозъка на гризачи и хора [87–89]. В астроцитома на мишка CT-2A, CR увеличава периваскуларното клетъчно покритие на кръвоносните съдове, намеквайки за намалена теч, по-малко налягане на интерстициалната течност и по-добро доставяне на лекарството към тумора [89].
Хипербаричната кислородна терапия (HBOT) е друг подход за преодоляване на хипоксията. Принципът на HBOT обхваща дишането на хипербарен кислород по време на облъчване с цел оксигениране и радиосенсибилизиране на хипоксични ракови клетки. Неотдавнашен преглед на Cochrane стигна до заключението, че HBOT, комбиниран с RT, може да подобри локалния контрол при рак на главата и шията и маточната шийка, но за сметка на значителни неблагоприятни ефекти [90]. Наскоро Poff et al. оценява комбинацията на HBOT с KD в миши VM-M3 модел на метастатичен рак, който имитира в близост няколко агресивни човешки рака [91]. Интересното е, че въпреки храненето ad libitum, мишките на KD са загубили около 10% телесно тегло, което предполага неволно недохранване. Докато само KD увеличава средното време на оцеляване с 57%, комбинацията от HBOT + KD увеличава времето на оцеляване с 78% в сравнение със стандартната диета. Преводът на тези резултати в клиничната практика остава открит въпрос. Може поне да се предположи, че кетонните тела могат да отслабят допълнителния оксидативен стрес към нормалните тъкани [92–94], но не и раковите клетки, които не са в състояние да ги метаболизират [95–98].
Вътрешна радиочувствителност
Ефектът на Варбург изглежда е отличителен белег на радиоустойчивите ракови клетки. Поглъщането на FDG от тумори е отрицателен предиктор за местния контрол [7, 8] и оцеляването [9] и се използва за насочване на контурите на особено радиоустойчиви зони за повишаване на дозата [10]. Високият гликолитичен процент изглежда предпазва раковите клетки от ROS-индуцирано увреждане на ДНК, като доставя големи количества редуциращи еквиваленти като пируват, лактат, глутатион и NAD (P) H, които изчистват ROS молекулите [1]. Количественото определяне на лактата чрез биолуминесцентно изобразяване при повече от 1000 отделни ксенотрансплантации на човешки HNSCC, Sattler и колеги демонстрира, че концентрациите на интратуморен лактат са в значителна обратна корелация с контрола на тумора след 6-седмична RT схема [99]. Не е открита обаче такава корелация за пирувата, което може да се обясни с факта, че концентрацията му в туморите е много по-ниска от тази на лактата.
Раковите стволови клетки притежават най-висока присъща радиочувствителност и са замесени в неуспеха да се постигне локален контрол, но проучванията, характеризиращи техния метаболитен фенотип, са оскъдни. Скорошно проучване на Vlashi et al. предполага, че такива клетки притежават висока метаболитна гъвкавост и лесно превключват между гликолиза и окислително фосфорилиране, ако е насочен само един от тези пътища [100]. Това може да означава, че - поне в случай на някои глиоми - CR или KD сами по себе си не са достатъчни за намаляване на съдържанието на ATP и радиорезистентността в раковите стволови клетки.
Клинично изпълнение
Диетичните стратегии, които включват намаляване на приема на храна по време на лечение на рак, оставят лекуващия лекар трепет, тъй като данните разкриват, че загубата на тегло по време на лечение води до по-лоши резултати [101]. Въпреки че значителната загуба на тегло от CR е проблем, загубата на мазнини при пациенти с наднормено тегло по време и след лечението може да доведе до подобрен резултат, тъй като прекомерната мастна тъкан при пациенти с рак на гърдата може да помогне за подхранване на туморни клетки [102]. Последните данни обаче разкриват, че CHO-ограничено или KD може да има по-голям ефект върху отслабващите метаболитни фактори, свързани с повишен процент на неуспех на RT, като същевременно се избягва безпокойството както на лекаря, така и на пациента по отношение на строго ограничаване на калориите [103].
Повечето изследвания на CR при животни използват намаление на калориите с 30% или повече и както беше обсъдено по-рано, такова ограничение при мишки е приблизително сравнима с едноседмично гладуване само при вода при хора [23], и двата варианта, които може да не са разумни за онкоболния. Този проблем може да бъде сведен до минимум чрез IF около RT процедури, тъй като води до по-малко загуба на тегло, когато се използва за периоди от 2-3 месеца [51], подобно на времената на RT лечение. Други важни проблеми включват възможна токсичност от CR, тъй като хроничната CR може да намали имунната функция [104] и да наруши зарастването на рани [105], както проблемите за постоперативния, така и за имунокомпрометирания пациент. Пациентите с KD трябва също да бъдат внимателно наблюдавани, за да се гарантира, че се консумират достатъчно витамини и хранителни вещества за имунопротекция и адекватно излекуване.
- Хормонална терапия за рак на гърдата Мемориал Слоун Кетъринг Център за рак
- Проспективно проучване на приема на диетична сол и честотата на рак на стомаха при определен японец
- Рак i-100629 001 Каква е същността на терапията на Николай Шевченко - рецепта, график
- Автоложни дендритни клетки и активирани цитотоксични Т-клетки като комбинирана терапия за рак на гърдата
- Остра при хронична бъбречна недостатъчност, остра при хронична бъбречна травма - съветник по ракова терапия