Елена Морозова
† Институт по молекулярна биология Енгелхард на Руската академия на науките, ул. Вавилов. 32, Москва 119991, Русия
Виталия Куликова
† Институт по молекулярна биология Енгелхард на Руската академия на науките, ул. Вавилов. 32, Москва 119991, Русия
Василий Ковал
† Институт по молекулярна биология Енгелхард на Руската академия на науките, ул. Вавилов. 32, Москва 119991, Русия
Наталия Ануфриева
† Институт по молекулярна биология Енгелхард на Руската академия на науките, ул. Вавилов. 32, Москва 119991, Русия
Марина Чернуха
‡ Национален изследователски център по епидемиология и микробиология, кръстен на почетния академик Н. Ф. Гамалея, Министерство на здравеопазването на Русия, ул. Гамалей. 18, Москва 123098, Русия
Лусин Аветисян
‡ Национален изследователски център по епидемиология и микробиология, кръстен на почетния академик Н. Ф. Гамалея, Министерство на здравеопазването на Русия, ул. Гамалей. 18, Москва 123098, Русия
Лада Лебедева
† Институт по молекулярна биология Енгелхард на Руската академия на науките, ул. Вавилов. 32, Москва 119991, Русия
Олга Медведева
‡ Национален изследователски център по епидемиология и микробиология, кръстен на почетния академик Н. Ф. Гамалея, Министерство на здравеопазването на Русия, ул. Гамалей. 18, Москва 123098, Русия
Егор Бурмистров
‡ Национален изследователски център по епидемиология и микробиология, кръстен на почетния академик Н. Ф. Гамалея, Министерство на здравеопазването на Русия, ул. Гамалей. 18, Москва 123098, Русия
Игор Шагинян
‡ Национален изследователски център по епидемиология и микробиология, кръстен на почетния академик Н. Ф. Гамалея, Министерство на здравеопазването на Русия, ул. Гамалей. 18, Москва 123098, Русия
Светлана Ревтович
† Институт по молекулярна биология Енгелхард на Руската академия на науките, ул. Вавилов. 32, Москва 119991, Русия
Татяна Демидкина
† Институт по молекулярна биология Енгелхард на Руската академия на науките, ул. Вавилов. 32, Москва 119991, Русия
Резюме
Белодробната болест, причинена от Pseudomonas aeruginosa, е основната причина за смърт при пациенти с муковисцидоза. Терапевтичната ефикасност на фармакологичните двойки, голата/капсулирана мутантна форма на Citrobacter freundii метионин γ-лиаза и субстратите, сулфоксиди на S-заместен l-цистеин, генериращи тиосулфинати, е оценена на миши модел на експериментален сепсис, причинен от мултилекарството устойчив щам P. aeruginosa 203-2. Двойките, съдържащи гол ензим и субстрати, не са имали антибактериална активност. Обработката на мишки с двойка капсулиран ензим и S-метил-1-цистеин сулфоксид, генериращ диметил тиосулфинат, доведе до пълно възстановяване на животните от модела, с заразяваща доза, равна на LD50. Двойката, генерираща диалил тиосулфинат (алицин), се оказа по-малко ефективна. Така заместителите, прикрепени към тиосулфинатната част, влияят на антибактериалната активност на тиосулфинатите срещу P. aeruginosa.
Въведение
Основната причина за смъртност при хора с муковисцидоза е белодробно заболяване. Постоянните бронхопулмонални инфекции, причинени от Pseudomonas aeruginosa, Staphylococcus aureus и други патогени, водят до хронично възпаление на дихателните пътища и система, разрушаване на тъканите и дихателна недостатъчност. 1 Повишаването на честотата на бактериите с многократна резистентност към търговски антибиотици е сериозно предизвикателство за човечеството. Изискват се изследвания на антиинфекциозни агенти с нови механизми на действие.
Насочено генериране на алицин от бинарна система от конюгирани моноклонални антитела алииназа и алиин въведе алииназата/алииновата система в ензимната пролекарствена терапия. 16-18 Антибактериални и противогъбични ефекти на системата алииназа/алиин са демонстрирани in vitro. 19 В нашите предишни доклади установихме, че пиридоксал 5′-фосфат-зависим Citrobacter freundii метионин γ-лиаза (MGL, EC 4.4.1.11) катализира нефизиологичната, нестереоселективна реакция на β-елиминиране на (±) S-alk (en) ил-1-цистеин сулфоксиди за получаване на алицин и други тиосулфинати (Схема 1). 20-22 Установено е обаче, че ензимът е инактивиран по време на реакцията на β-елиминиране на алиин, тъй като алицинът окислява три SH-групи на MGL. 21 За да се избегне инхибирането на MGL, причинено от тиосулфинатите, ние получихме мутантната форма на MGL на C115H. 22 Антимикробният ефект на бинарната система („фармакологична двойка“) C115H MGL/S-alk (en) ил-1-цистеин сулфоксиди е демонстриран in vitro срещу редица бактерии, включително мултирезистентни щамове, изолирани от пациенти с муковисцидоза. 22,23 В този доклад ние тествахме ефикасността на голи/капсулирани C115H MGL/субстратни бинарни системи върху миши модел на експериментален сепсис, причинен от щам P. aeruginosa 203-2, изолиран от пациенти с муковисцидоза.
Резултати и дискусия
Оценена е устойчивостта на щама P. aeruginosa 203-2 към антибиотици от различни групи (β-лактами, макролиди, аминогликозиди, флуорохинолони и др.). Установено е, че щамът P. aeruginosa 203-2 е устойчив на имипенем, азлоцилин, цефотаксим, цефепим, цефтриаксон, гентамицин, тобрамицин и левомицетин (данните не са показани). Резултатите ни позволиха да класифицираме щама като мултирезистентен. Вирулентността на щама P. aeruginosa 203-2 беше оценена чрез определяне на LD50 и LD100 стойности. LD50 и LD100 бяха 5 × 108 клетки/мишка и 5 × 109 клетки/мишка.
За да се избегне протеолиза, висока имуногенност и краткотрайна биологична активност на ензимния компонент на бинарната система C115H MGL беше капсулирана в PIC сфери чрез смесване на PEG-поли (α, β-аспарагинова киселина) 70 и поли- (l-лизин) 70 с ензима, както е описано по-горе. 24 Образуването на ензимно натоварени PIC сфери беше потвърдено с помощта на DLS техниката. Имаше два вида частици - преобладаващата фракция с размер около 52 ± 0,33 nm и малък брой частици с размер около 500 nm. Индексът на полидисперсност е 0,329. Зета потенциалът е 3,45 ± 0,36 mV. Експлоатацията на нанореактори с капсулирани ензими в терапията с ензимни пролекарства е много привлекателна, тъй като избягва проблемите, свързани с употребата на ензимите. Малко са документите, които описват приложението на полимерни нанореактори, произвеждащи лекарства in vivo. 25,26 Показан е in vitro потенциалът за използване на пеницилинова ацилаза на Escherichia coli, заредена в триблок-съполимерни везикули за превръщане на 7-аминодезацетоксицефалоспоранова киселина и фенилглицин метилов естер в цефалексин. 27
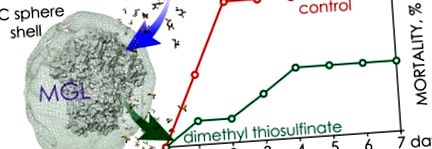
Криви на оцеляване на мишки, заразени с щам P. aeruginosa 203-2 и третирани с гол/капсулиран C115H MGL/S-alk (en) ил-1-цистеин сулфоксиди. Инфектиращата доза на патогена е равна на LD50. □, пунктирана линия - гол C115H/метиин (P> 0,99); ■, пунктирана линия - натоварени с C115H PIC сфери/метиин (P ≤ 0,05); ▲, плътна линия — натоварени с C115H PIC сфери/алиин (P = 0,5); △, плътна линия - гол C115H/алиин (P> 0,5); ● —контрол. Ленти за грешки: SE.
В допълнение, ефективността на фармакологичната двойка C115H натоварени PIC сфери/метиин беше проучена на миши модел с инфектираща доза от бактериален щам, равна на LD100 (Фигура Фигура2 2). Използвани са три различни протокола за администриране на компонентите на фармакологичната двойка и три различни протокола за прилагане на фармакологичните двойки компоненти. Няма разлика в преживяемостта при животни, когато се използват единични или четирикратни приложения на метиин (P ≤ 0,0095 и в двата случая). Преживяемостта е 50%. Загубата на тегло в групите е под 10%. Намаляването на дозата на ензимния компонент три пъти (25 U/mL) с четирикратно приложение на метиин доведе до увеличаване на смъртността при животните до 67% (P = 0,36). Оптималният начин на приложение на фармакологична двойка е интравенозно отделно еднократно инжектиране с капсулиран ензим и сулфоксид. Терапевтичните дози на натоварени с C115H PIC сфери и метиин са 75 U/kg и 100 mg/kg на животно.
Криви на оцеляване на мишки, заразени с щам P. aeruginosa 203-2 и третирани с различни дози натоварени с C115H PIC сфери/метиин. Инфектиращата доза на патогена е равна на LD100. ▼, плътна линия - същото за два протокола за администриране на фармакологични двойки компоненти CIC5H-заредени PIC сфери [75 U/kg]/метиин × 4 и C115H заредени PIC сфери [75 U/kg]/метиин × 1 (P ≤ 0,0095 и в двата случая); ▽ ∇, плътна линия — натоварени с C115H PIC сфери [25 U/kg]/метиин × 4 (P = 0,36); ● —контрол. Ленти за грешки: SE.
Заключения
Настоящото проучване демонстрира, че фармакологичната двойка C115H заредени PIC сфери/метиин е обещаваща за разработването на антибактериални лекарства с нов механизъм на действие срещу P. aeruginosa. Всеобхватни изследвания на действието на алицин върху клетките на Е. coli показват, че основните причини за инхибиране на клетъчния растеж са окисляването на цистеиновите остатъци в редица протеини и ензими и намаляването на намаленото ниво на глутатион. 30 Същият механизъм може да е отговорен за антибактериалния ефект на други тиосулфинати. Най-вероятно тези съединения няма да предизвикат устойчивост. Изследването на други S-заместени 1-цистеин сулфоксиди, получени от Alliums, и проектирането на нови сулфоксиди са обещаващи за разработването на антибактериални лекарства.
Материали и методи
Материали
Намалена форма на никотинамид аденин динуклеотид (NADH), лактат дехидрогеназа (LDH) от заешки мускул и (±) -L-алиин са закупени от Sigma-Aldrich; пиридоксал 5′-фосфат (PLP) и d, l-дитиотреитол (DTT) са от Serva; канамицинът е вътрешен продукт (OAO Biokhimik); DEAE-сефарозата беше от Амершам. 2-нитро-5-тиобензоат (NTB) се получава съгласно референция (31). S-метил-1-цистеин сулфоксид (метиин) се синтезира съгласно Morozova et al. 22 PEG – поли (а, β-аспарагинова киселина) 70 (PEG – P (Asp) 70) и поли- (1-лизин) 70 (PLL70) са синтезирани съгласно Koide et al. 32 Бурион от Luria – Bertani (LB), бульон на Mueller – Hinton, агар на Mueller – Hinton и импрегнирани с антибиотици дискове: амикацин, амоксицилин/клавуланова киселина, ампицилин, азитромицин, азтреонам, цефепим, цефтазидин, цефтоксим, цефтоксим, цефтоксим, цефтоксим, цефтаксим, цефтаксим, цефтаксим, цефтаксим ципрофлоксацин, колистин, доксициклин, еритромицин, гентамицин, имипенем, левофлоксацин, линкомицин, норфлоксацин, офлоксацин, оксацилин, рифампицин, спирамицин, тобрамицин и ванкомицин са от HiMedia Laboratories Pvt. Limited (Индия).
Пречистване на C115H MGL
Мутантната форма на M11H на MGL от C. freundii беше получена и пречистена, както е описано от Morozova et al. 22 За да се елиминира ендотоксинът, ензимът се смесва с ендотоксинов екстрактор (Sileks, Русия) и се инкубира в продължение на 30 минути при 0 ° C; след това се инкубира за 15 минути при 50 ° С и се центрофугира за 5 минути при 5000 об/мин. Прозрачната водна фаза, съдържаща ензим без ендотоксин, беше събрана. Нивото на ендотоксин беше измерено с помощта на хромогенен набор за количествено определяне на хромогенен ендотоксин Limulus Amebocyte Lysate (LAL) (Thermo Fisher Scientific, САЩ). Нивото на ендотоксин в пробите е 0,07 EU/mg.
Подготовка и характеризиране на C115H заредени PIC сфери
PEG-P (Asp) 70 и PLL70 се разтварят в 50 mM калиев фосфатен буфер с рН 7,4 при 1 mg/ml и се филтрират през мембранен филтър 0,22 μm за отстраняване на прах. Разтворите на двата полимера се смесват в равно съотношение на -COO- и -NH3 + единици чрез вихрово смесване за 2 минути. Прибавя се ензимът (6 mg/mL в 10 mM калиев фосфатен буфер с рН 7.4) и сместа се разбърква в продължение на 2 минути. За да се отстрани некапсулираният ензим, сместа се центрофугира при 12 000 rpm в продължение на 5 минути и супернатантата се обменя с 10 mM калиев фосфатен буфер четири пъти. Отсъствието на ензима в супернатанта се проверява чрез изчезването на характерната холоензимна лента при 420 nm в супернатантния спектър. 22 Средният размер на частиците и зета потенциал на натоварени с C115H PIC сфери бяха определени чрез фазов анализ на разсейване на светлина със ZetaPALS при 25 ° C (Brookhaven Instruments Corporation, САЩ).
Животни и етично одобрение
Общо 84 безпородни мъжки мишки с тегло 14–16 g са получени от Andreevka FSBI SCBT FMBA, Русия. За да се аклиматизират, мишките бяха настанени във вентилирани клетки с 12/12 цикъл светлина-тъмнина и имаха свободен достъп до храна и вода в продължение на 14 дни преди началото на експериментите. Всички експерименти са проведени в съответствие с „Правилата за работа с използване на опитни животни“ (Приложение към заповедта на Министерството на здравеопазването на СССР от 12.08 1977 г., № 755).
Определяне на антибиотичната устойчивост на щам P. aeruginosa 203-2
Щамът P. aeruginosa 203-2, изолиран от пациенти с муковисцидоза, е от колекцията на Лабораторията по молекулярна епидемиология на вътреболничните инфекции към Националния изследователски център по епидемиология и микробиология, кръстен на почетния академик Н. Ф. Гамалея. Устойчивостта на P. aeruginosa 203-2 към стандартни антибиотици, предписани за лечение на муковисцидоза, се определя чрез метода на серийно разреждане, съгласно клиничните препоръки за праговите стойности на MIC за всеки антибиотик [Определяне на чувствителността на микроорганизмите към антимикробни лекарства (версия 2015-02). Методически указания 4.2.1890-04].
Миши модели на експериментален сепсис
Щамът P. aeruginosa 203-2 е използван за индуциране на експериментален сепсис при животни. Една колония от чиста 18–24 h култура от бактерии, отгледани върху 5% кръвен агар, се отглежда за една нощ в LB при 37 ° C. Бактериите се събират чрез центрофугиране при 3000 rpm в продължение на 10 минути и гранулата се суспендира в 0.9% NaCl. Концентрацията на бактериалната суспензия се определя чрез визуално сравнение на суспензията със стандарта за мътност 0,5 MF. За да се изясни съдържанието на жизнеспособни клетки в заразяващите суспензии, се извършва засяване от няколко разреждания в плътна хранителна среда, последвано от преброяване на колониите след 24 часа инкубация.
За да се симулира инфекцията, се формират 5 групи животни (по шест мишки всяка), на четири от които се прилагат различни дози P. aeruginosa 203-2, получени чрез 10-кратно серийно разреждане на първоначалната концентрация на инокулуми (5 × 10 6, 5 × 10 7, 5 × 10 8, 5 × 10 9 KFU/мишки). На контролната група животни се прилага стерилен физиологичен разтвор. Сепсисът е моделиран чрез единична интраперитонеална инжекция от 0,5 ml инокулат на щам. Продължителността на наблюдението беше 7 дни, след което оцелелите животни бяха евтаназирани чрез прилагане на диетилов етер с помощта на импрегниран с етер памук. Като оценка на вирулентността бяха определени LD50 и LD100.
Антибактериална активност на фармакологични двойки по модела на експериментална инфекция, причинена от P. aeruginosa 203-2
Антибактериалната активност на двете лекарствени комбинации, натоварени с C115H PIC сфери/алиин и C115H натоварени PIC сфери/метиин, беше изследвана на миши модел с еднократно приложение на заразяващата доза от бактериалния щам, равна на LD50 в обем от 0,5 ml. В допълнение, ефективността на фармакологичната двойка C115H заредени PIC сфери/метиин е проучена на миши модел с инфектиращата доза на бактериалния щам, равна на LD100. За тази двойка са изследвани и различни протоколи за интравенозно инжектиране.
За модела с инфектиращата доза на P. aeruginosa 203-2, равна на LD50, мишките бяха разпределени в 5 групи (по шест мишки всяка): C115H заредени PIC сфери/метиин и C115H заредени PIC сфери/алиинови групи с отделно инжектиране съдържащ капсулиран ензим самостоятелно в доза 75 U/kg 1 час след инфекцията и четирикратно инжектиране на метиин/алиин в доза 100 mg/kg на 1, 24, 48 и 72 часа след инфекцията; голи C115H/метиин и голи C115H/алиинови групи с отделни четирикратни инжекции, съдържащи гол ензим в доза 300 U/kg и алиин/метиин в доза 100 mg/kg на 1, 24, 48 и 72 часа след инфекцията; контролна група с инжектиране на 0,2 ml буфер на 1, 24, 48 и 72 часа след инфекцията.
За модела с LD100 инфектираща доза P. aeruginosa 203-2, мишките бяха разпределени в 4 групи (по шест мишки всяка): заредени с C115H PIC сфери/метиин група 1 с отделните инжекции само на капсулирания ензим в доза от 75 U/kg и метиин при еднократна доза от 100 mg/kg 1 час след инфекцията; C115H заредени PIC сфери/метиин група 2 с отделна инжекция, съдържаща само капсулирания ензим в доза 75 U/kg 1 час след инфекцията и четирикратно инжектиране на метиин в доза 100 mg/kg на 1, 24, 48 и 72 часа след инфекцията; C115H заредени PIC сфери/метиин група 3 с отделни инжекции, съдържащи само капсулирания ензим в доза 25 U/kg 1 час след инфекцията и четирикратно инжектиране на метиин в доза 100 mg/kg на 1, 24, 48, и 72 часа след инфекцията; контролната група с инжекция от 0,2 ml буфер на 1, 24, 48 и 72 часа след инфекцията.
Препаратите от голи/капсулирани ензими и сулфоксиди се инжектират интравенозно при обем от 0,1 ml в 0,1 mM калиев фосфатен буфер, рН 7,5, с 0,1 mM PLP. Същият буфер беше използван като контрола.
Ежедневно се наблюдават телесното тегло и дискомфортът, като намалена двигателна активност. Животните, оцелели след 7-дневно наблюдение, бяха евтаназирани.
- Дебел; Отслабване; Терапия с червена светлина Какво трябва да знаете Уелнес център Greenspan
- Клинична ефикасност на адеметионин хептор при терапия на алкохолно-зависими чернодробни заболявания Прочетено от
- Clomid за мъже на тестостеронова заместителна терапия (TRT) Иновативни мъже; s Здравни клиники
- Може ли терапията със стържене да ви помогне да се възстановите от тренировки
- Диетична терапия - общ преглед на ScienceDirect теми