1 Катедра по детска и юношеска неврология, Детски медицински център Шнайдер в Израел, Медицински факултет, Университет в Тел Авив, Тел Авив, Израел
Резюме
Въпреки че кетогенната диета (KD) е широко приета като законна и успешна терапия за епилепсия и други неврологични разстройства, нейният механизъм на действие остава загадка. Използването на KD причинява големи метаболитни промени. Най-значимата от тях изглежда е ситуацията с хронична кетоза, но има и други, например високо ниво на полиненаситени мастни киселини (PUFA). Тези „първични“ влияния водят до „вторични“, отчасти адаптивни ефекти, например промени в митохондриалната плътност и генната експресия. Клинично влиянието на диетата се счита за антиконвулсивно и невропротективно, въпреки че невропротекцията може да доведе и до предотвратяване на гърчове. Обсъждат се потенциалните клинични последици от тези механизми.
1. Въведение
Стойността на кетогенната диета (KD) е призната при лечението на епилепсия, въпреки че точните механизми, чрез които тя упражнява своя ефект, остават загадка [1]. Те изглежда са различни от тези на обикновените антиепилептични лекарства (AED) [2] и откриването на това, което представляват, може да доведе до използването му и в клинични ситуации, различни от епилепсия [3].
KD се състои от четири елемента, промените на всеки от тях могат потенциално да доведат до загуба на антиконвулсантния си ефект: (1) увеличено количество мазнини, обикновено в съотношение 3 до 4 грама мазнини за всеки грам протеин и въглехидрати, (2) възможно най-ниска консумация на глюкоза, (3) ограничаване на калориите и (4) ограничаване на течностите [1]. Въпреки че има известен дебат относно последния компонент [4], клиничната практика показва, че спирането на ограничаването на течности може да доведе до рецидив на припадъците по същия начин, както при спиране на ограничаването на глюкозата.
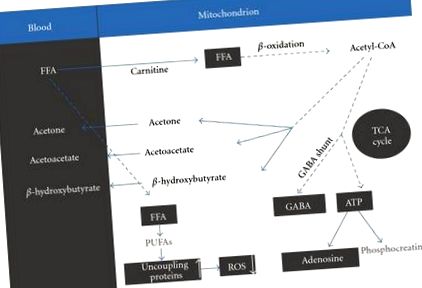
Строгото наблюдение на KD води до хронична кетоза [5] по следния начин. Най-важният резултат от спазването на диетата е повишеното ниво на свободни мастни киселини в кръвта (FFA). FFA се прехвърлят в митохондриите, процес, който изисква наличието на подходящо количество карнитин, където те се разграждат в кетонни тела чрез β окисление. Тези кетонни тела включват β хидроксибутират, ацетоацетат и ацетон [5] (Фигура 1).
1.1. Роля на кетонните тела
Посредством TCA цикъла ацетил-КоА повишава нивото на невротрансмитерите глутамат и γ-аминомаслена киселина (GABA) и съответно основните възбуждащи и инхибиторни невротрансмитери в мозъка. Нетният ефект от повишеното GABAергично влияние може да бъде отговорен за антиконвулсантното действие [5].
1.2. Роля на полиненаситените мастни киселини
Друг продукт от повишено ниво на свободни мастни киселини са полиненаситените мастни киселини (PUFA). Предполага се, че потенциалната способност на PUFA да блокират припадъчната активност в мозъка е свързана с някои доста по-сложни механизми, включително (1) директно инхибиране на напрежение-зависими натриеви и калциеви канали, (2) активиране на липид-чувствителен калиев канал, ( 3) засилване на активността на натриевата помпа за ограничаване на невроналната възбудимост, (4) активиране на активирания от пероксизома пролифератор рецептор-α (PPARα) и (5) индуциране на експресията и активността на специфични за мозъка разединяващи протеини в митохондриите, като по този начин индуцира невропротективен ефект [5]. Този последен ефект действа чрез ограничаване на генерирането на реактивни кислородни видове (ROS).
1.3. Концепцията за биоенергетика и неврозащита
Кетогенната диета е преди всичко антиконвулсантна. Въпреки това, в няколко аспекта KD е и невропротективна. Невропротекцията може да допринесе за антиконвулсантния ефект, но може да има и други ефекти, които могат да доведат до други клинични приложения на KD [3]. Като цяло използването на KD подобрява производството на енергия в мозъка. Appleton и De vivo [8] съобщават, че KD увеличава общото количество биоенергийни субстрати (аденозин трифосфат (ATP)) и повишава енергийния заряд в мозъка на плъхове. Ацетоацетат, продукт на β хидроксибутират дехидрогениране, се прехвърля в ацетил-КоА, който влиза в цикъла на трикарбоксилната киселина (TCA). Увеличеният оборот на TCA цикъла генерира протони и електрони, които се насочват към електронната транспортна верига. Това от своя страна стимулира образуването на АТФ от аденозин фосфат (АДФ) чрез АТФ синтаза. Подобреният АТФ може да бъде превърнат във фосфокреатин за съхранение на енергия или разбит в аденозин. Повишените нива на АТФ осигуряват енергийни резерви за неврона да продължи да функционира при стрес. Повишеният извънклетъчен аденозин предлага невропротективен буфер срещу обиди, намалява възбудата и предотвратява прекомерните изисквания за АТФ, като по този начин осигурява локален контрол на пристъпите и невропротекция [6].
Предполага се също така, че KD влияе върху регулирането на транскриптите, кодиращи ензимите на енергийния метаболизъм и увеличаването на плътността на митохондриите в невронния процес, което води до повишени енергийни резерви. Подобреният енергиен статус може да подпомогне предотвратяването на гърчове, например чрез подпомагане на GABAergic инхибиране [9]. Предполага се, че адаптивните процеси към метаболитните промени, индуцирани от диетата, водят до промени в генната експресия, които от своя страна водят до някои от гореспоменатите промени.
Другият път на невропротекция се модулира чрез намалено генериране на ROS, което се счита за свързано с ефекта на PUFAs върху разединяването на протеини [5].
1.4. Други клинични приложения на кетогенната диета
Фактът, че KD се счита за доказана терапия с относително малко неблагоприятни ефекти и богат клиничен опит, особено при деца, доведе до скорошни проучвания, изследващи нови потенциални приложения за други неврологични разстройства [3]. Една от най-интригуващите и активни области на изследване е ефектът от диета с високо съдържание на мазнини, калорично ограничена върху оцеляването на клетките на мозъчните тумори. Клетките от мозъчен рак имат ограничена метаболитна гъвкавост и са зависими главно от метаболизма на глюкозата. Предполага се, че митохондриалните аномалии нарушават способността на мозъчните тумори да генерират енергия от кетонни тела. За разлика от нормалните клетки, злокачествените туморни клетки имат нарушена генетична адаптивност поради техните генетични аномалии и следователно повишена податливост на стрес от околната среда, като гладуване или ограничаване на калориите. Същите геномни дефекти, които участват в създаването на мозъчни тумори, могат да бъдат използвани за тяхното унищожаване [3, 10, 11].
През 1995 г. Nebeling et al. [12] съобщава за две млади момичета с нерезектабилни мозъчни тумори в напреднал стадий, които са имали слаб отговор на лъчева и химиотерапия. Те бяха лекувани с KD и отговорът им беше забележителен, както клинично, така и според последващи сканирания на позитронно-емисионна томография. Zuccoli et al. [13] описва пациент с мултиформен глиобластом, чийто тумор, който е много злокачествен, подобрява KD. Изненадващо, въпреки привлекателната ефикасност на това лечение, не са провеждани по-нататъшни проучвания при хора или клинични проучвания на KD като терапия за мозъчни тумори. Няколко лабораторни изследвания на модели на мишки и плъхове наскоро потвърдиха, че инхибирането на растежа на мозъчния тумор е пряко свързано с намалените нива на глюкоза и повишените нива на кетонни тела. Освен това е показано, че KD намалява активните кислородни видове (ROS) в мозъка [5]. Раковите клетки се нуждаят от високи нива на ROS за индуциране на ангиогенеза и производството на туморни растежни фактори [11], така че чрез този механизъм KD може да бъде защитен.
2. Илюстративен калъф
12-годишно момиче е диагностицирано като неврокутанна меланоза със засягане на ЦНС. Туморът беше силно злокачествен и имаше много бърз ход на прогресия. Клиничните прояви са главно неразрешими припадъци, които налагат многократно постъпване в интензивното отделение, както и тежък когнитивен и бдителен спад. След като онколозите решиха, че противотуморното лечение ще бъде неефективно, тя започна на KD. След четириседмично изпитване то не е оказало ефект върху прогресията на тумора. Честотата и тежестта на пристъпите се подобриха, но тя се лекува едновременно с AED. Въпреки това имаше забележителен подобряващ ефект върху познанието, бдителността и настроението на момичето, въпреки опустошителното й състояние. Пациентът е изтекъл няколко седмици след започване на диетата.
Благоприятният ефект на KD върху познанието, бдителността и настроението е добре познат [1], а клиничният опит показва, че в много пъти той е не по-малко важен от антиконвулсантния ефект. Това може да е особено вярно за младежите в прогресиращи стадии на тяхното онкологично заболяване.
Потенциалният невропротективен ефект на KD е това, което мотивира изследванията на неговия потенциал като възможност за лечение при други неврологични разстройства [3]. Все повече са съобщенията, че кетозата, постигната чрез глад или приложение на KD, има постоянен невропротективен ефект след различни мозъчни наранявания при животински модели. Едно пилотно проучване при хора и няколко проучвания върху животински модели показват подобрение в параметрите на аутистичното поведение с лечение на KD. Остава да се изясни допълнително дали това подобрение е свързано с намалена епилептична активност, установена при до 30% от тези пациенти, или с първичен ефект на KD [3].
Фактор, който може да бъде от решаващо значение за прилагането на KD при медицински състояния, различни от неразрешима епилепсия, са присъщите трудности при използването му [14]. Диетичните ограничения могат да създадат значителен проблем при дете с прогресиращ тумор, което се подлага на масивна химиотерапия, което може би вече е кахектично. KD може да не е опция при пораснало хиперактивно дете аутист. По този начин неврологът трябва много внимателно да оцени подходящите клинични, семейни и екологични ситуации преди препоръката на KD.
В заключение, основният метаболитен ефект на KD е в снабдяването на мозъка с повишено количество свободни мастни киселини. Разграждането им в кетонни тела, заедно с натоварването на PUFAs, води до големи промени в метаболитната, биоенергийната, митохондриалната и дори генетичната констелация. Тези първични и вторични промени имат антиконвулсивни и невропротективни ефекти. KD сега е важен компонент на армаментариума на детските епилептолози. Дали това може да бъде ефективно и при други патологии, особено при лечение на злокачествени заболявания, очаква бъдещи изследвания.
Препратки
- A. L. Hartman и E. P. G. Vining, „Клинични аспекти на кетогенната диета“, Епилепсия, об. 48, бр. 1, стр. 31–42, 2007. Преглед на: Издателски сайт | Google Scholar
- A. L. Hartman и J. M. Freeman, „Дали ефективността на кетогенната диета при различни епилепсии дава представа за нейните механизми?“ Епилепсия, об. 49, допълнение 8, стр. 53–56, 2008. Преглед на: Издателски сайт | Google Scholar
- K. W. Barañano и A. L. Hartman, „Кетогенната диета: употреби при епилепсия и други неврологични заболявания,“ Съвременни възможности за лечение в неврологията, об. 10, бр. 6, стр. 410–419, 2008. Преглед на: Издателски сайт | Google Scholar
- E. C. Wirrell, „Кетогенно съотношение, калории и течности: имат ли значение?“ Епилепсия, об. 49, допълнение 8, стр. 17–19, 2008. Преглед на: Издателски сайт | Google Scholar
- K. J. Bough и J. M. Rho, „Антиконвулсивни механизми на кетогенната диета“, Епилепсия, об. 48, бр. 1, стр. 43–58, 2007. Преглед на: Издателски сайт | Google Scholar
- S. A. Masino, M. Kawamura, C. A. Wasser, L. T. Pomeroy и D. N. Ruskin, „Аденозин, кетогенна диета и епилепсия: възникващата терапевтична връзка между метаболизма и мозъчната дейност“ Съвременна неврофармакология, об. 7, бр. 3, стр. 257–268, 2009. Преглед на: Издателски сайт | Google Scholar
- N. Hasebe, K. Abe, E. Sugiyama, R. Hosoi и O. Inoue, „Антиконвулсивни ефекти на метил етил кетон и диетил кетон при няколко вида модели на припадъци от мишки,“ Европейско списание по фармакология, об. 642, стр. 66–71, 2010. Преглед на: Издателски сайт | Google Scholar
- D. B. Appleton и D. C. De Vivo, „Експериментален животински модел за ефекта на кетогенната диета върху епилепсията“, Известия на Австралийската асоциация на невролозите, об. 10, стр. 75–80, 1973. Преглед в: Google Scholar
- К. Боу, „Енергийният метаболизъм като част от антиконвулсивния механизъм на кетогенната диета“, Епилепсия, об. 49, допълнение 8, стр. 91–93, 2008. Преглед на: Сайт на издателя | Google Scholar
- B. T. Seyfried, M. Kiebish, J. Marsh и P. Mukherjee, „Насочване на енергийния метаболизъм при рак на мозъка чрез ограничаване на калориите и кетогенна диета“, Journal of Cancer Research and Therapeutics, об. 5, допълнение 1, стр. S7–15, 2009. Преглед на: Google Scholar
- P. Stafford, M. G. Abdelwahab, D. Y. Kim, M. C. Preul, J. M. Rho и A. C. Scheck, „Кетогенната диета обръща моделите на генна експресия и намалява нивата на реактивни кислородни видове, когато се използва като адювантна терапия за глиома“ Хранене и метаболизъм, об. 7, статия 74, 2010. Преглед на: Издателски сайт | Google Scholar
- L. C. Nebeling, F. Miraldi, S. B. Shurin и E. Lerner, „Ефекти от кетогенна диета върху туморния метаболизъм и хранителния статус при педиатрични онкологични пациенти: два случая“, Вестник на Американския колеж по хранене, об. 14, бр. 2, стр. 202–208, 1995. Преглед в: Google Scholar
- G. Zuccoli, N. Marcello, A. Pisanello et al., „Метаболитно управление на мултиформен глиобластом, използвайки стандартна терапия заедно с ограничена кетогенна диета: доклад за случая“ Хранене и метаболизъм, стр. 33, 2010. Преглед на: Издателски сайт | Google Scholar
- J. H. Cross, A. Mclellan, E. G. Neal, S. Philip, E. Williams и R. E. Williams, „Кетогенната диета при детска епилепсия: къде сме сега?“ Архив на болестите в детството, об. 95, бр. 7, стр. 550–553, 2010. Преглед на: Издателски сайт | Google Scholar
- Ефектът на нисковъглехидратната, кетогенна диета спрямо диета с нисък гликемичен индекс върху гликемичната
- Използването на кетогенната диета при лечението на епилептични енцефалопатии
- Ефекти от нисковъглехидратната, кетогенна диета върху синдрома на поликистозните яйчници Пилотно проучване
- Защо диетата 5 2 ми действа
- Какво представлява кетогенната диета My Hudson Valley