Адриан Пост
1 Катедра по вътрешни болести, Университетски медицински център Гронинген, Университет в Гронинген, 9713 GZ Гронинген, Холандия; [email protected]
Димитриос Цикас
2 Институт по токсикология, Основна единица протеомика, Медицинско училище в Хановер, ул. Карл Нойберг. 1, 30625 Хановер, Германия; [email protected]
Стефан Дж. Л. Бакър
1 Катедра по вътрешни болести, Университетски медицински център Гронинген, Университет в Гронинген, 9713 GZ Гронинген, Холандия; [email protected]
Резюме
1. Въведение
2. Компрометиран прием на креатин
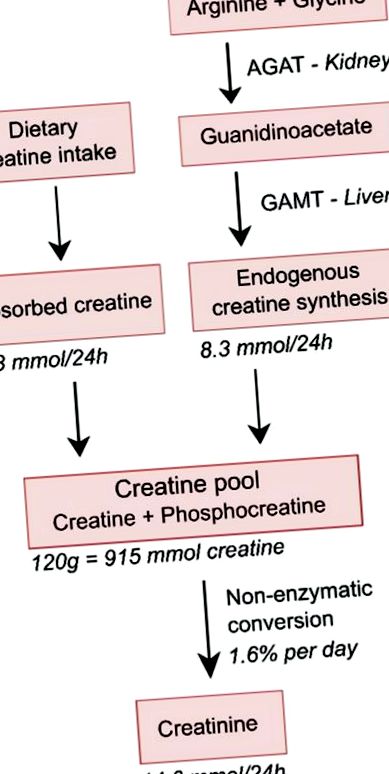
Опростен схематичен преглед на хомеостазата на креатина. Изчислено е, че младите мъже с тегло 70 kg с нормална мускулна маса съдържат около 120 g общ креатин (креатин и фосфокреатин), което се равнява на 915 mmol креатин, тъй като молекулното му тегло е 131 g/mol. При степен на конверсия от 1,6% на ден и малко по-ниско молекулно тегло на креатинин от 113 g/mol, това ще доведе до 24-часова екскреция на креатинин в урината приблизително 1,65 g, което се равнява на 14,6 mmol, и по този начин също еквивалентно на загуба от 14,6 mmol креатин, което предполага загуба на 1,91 g креатин на ден. Средната диета на млади всеядни мъже с телесно тегло от 70 kg се оценява да съдържа 7,9 mmol креатин на ден, което при скорост на чревна абсорбция от 80% ще доведе до усвояване на креатин от диетата от 6,3 mmol/ден, което води до при нужда от ендогенен синтез на креатин със скорост от 8,3 mmol/ден, необходима за поддържане на стабилно състояние. Поради тяхната по-ниска мускулна маса и хранителен прием, процентът за жените ще бъде около 70–80% от този при мъжете [27].
3. Принос на бъбреците за ендогенния синтез на креатин при хората
Ензимни функции на AGAT, показващи, че гуанидиноацетатът се метаболизира допълнително до креатин и в крайна сметка креатинин, докато хомоаргининът не се метаболизира допълнително.
маса 1
Ефект на едностранната нефректомия върху биохимичните параметри при 127 здрави донори на бъбреци. Дизайнът и методите на изследването са описани по-рано [51,52].
| Екскреция на хомоаргинин с урината (µmol/24 часа) | 127 | 4,0 ± 4,4 | 3,0 ± 2,3 | 1,1 ± 3,4 | -25 | 0,001 | ||||||
| Екскреция на урея с урина (mmol/24 h) | 125 | 420 ± 127 | 394 ± 111 | 26 ± 140 | -6 | 0,04 | ||||||
| Екскреция на натрий в урината (mmol/24 h) | 125 | 203 ± 72 | 176 ± 65 | 27 ± 82 | -13 | 2) | 127 | 95 ± 16 | 60 ± 12 | 34 ± 10 | -37 | 2 до 60,1% при недиализно зависими пациенти с eGFR 2 [59]. В бразилско проучване, при което саркопенията се оценява чрез двуенергийна рентгенова абсорбциометрия, разпространението на саркопения варира от 34,5% при пациенти с eGFR между 45 и 90 ml/min/1,73 m 2 до 65,5% при пациентите с eGFR 2 [56]. Тъй като креатинът в мускулите непрекъснато се превръща в креатинин със скорост от приблизително 1,6–1,7% от неговата маса на ден [27], 24-часовата екскреция на креатинин в урината се счита за надеждна мярка за мускулна маса, дори при пациенти с напреднала бъбречна недостатъчност, в деца и юноши, възрастни хора и пациенти със загубени условия [60,61,62,63,64]. Използвайки 24 часа екскреция на креатинин с урина като маркер на мускулната маса, наскоро установихме, че саркопенията - както се определя от ниската екскреция на креатинин - е преобладаваща при 38% от пациентите с напреднала ХБН, като разпространението се увеличава с тежестта на ХБН и риска за ниската екскреция на креатинин е 25,8 пъти по-висока при пациенти непосредствено преди началото на диализата, в сравнение с пациентите с по-малко напреднала ХБН [65]. Изследвания, използвали други методи за измерване на мускулна маса, установяват подобна връзка на нарушена бъбречна функция с ниска мускулна маса [59,66,67,68]. Важното е, че тази ниска мускулна маса не е без последствия. Едно от най-убедителните наблюдения е, че ниската мускулна маса, както се доказва от ниската денонощна екскреция на креатинин в урината, е много силен независим предиктор за смъртността при пациенти с ХБН [68]. Същото важи и за пациенти с диализно зависима ХБН, при които ниската 24 часа екскреция на креатинин в урината непосредствено преди диализата е доказана като много силен независим предиктор за преждевременна смъртност след началото на диализата [60]. По-малко очевидно, но от гледна точка на пациента, вероятно дори по-убедително, е, че ХБН - особено в напредналите си стадии - също е свързана с умора, лошо познание, депресия и ниско качество на живот [19,57,65,69,70, 71,72]. Интересното е, че тези симптоми са подобни на тези, наблюдавани при пациенти с генетичен дефицит на AGAT [73]. Важно е, че при това генетично състояние мускулните симптоми са напълно обратими чрез добавяне на креатин [73]. Ако добавянето на креатин започне в ранна възраст, появата на когнитивна дисфункция е обратима и дори предотвратима [74,75,76]. |
5. Най-податливата група пациенти
6. Хипотеза
Схематичен преглед, показващ нарастващото търсене на диетичен креатин, тъй като ендогенното производство на креатин спада по време на прогресията на хроничната бъбречна болест (ХБН).
7. Ефекти върху добавката на креатин
8. Безопасност на добавките с креатин
Тъй като броят на рандомизираните клинични проучвания, използващи добавки с креатин, нараства, нараства и подкрепата за неговата безопасност. Проучвания както при спортисти, така и сред популациите показват, че добавянето на креатин, вариращо от няколко дни до пет години, не води до неблагоприятни промени в маркерите на клиничното здраве, включително бъбречната функция [95,96,97,98,99,100] . В допълнение, неотдавнашните изследвания показват, че добавката на креатин, за разлика от това, което се е смятало досега, не води до образуването на канцерогенни хетероциклични амини [101]. Трябва обаче да се отбележи, че малко е известно относно безопасността на добавките с креатин при пациенти с ХБН. Въпреки че биологичната правдоподобност за дефицит на креатин е налице при пациенти с ХБН, особено при пациенти с диализно зависима ХБН, има твърде малко данни, за да може креатиновият дефицит да играе роля в симптомите и проблемите при пациенти с ХБН в момента като повече от хипотеза . Трябва да се направят повече изследвания в подкрепа на тази хипотеза и ако такива данни станат достъпни, трябва да се извършат рандомизирани клинични изпитвания, за да се демонстрира безопасността и ползите, преди добавянето на креатин в действителност да може да бъде препоръчано в тази обстановка.
9. Ограничения
Трябва да се обърне внимание на няколко ограничения. Първо, ние предполагаме, че синтезът на креатин намалява с увеличаване на увреждането на бъбречната функция и следователно може все повече да се превърне в основно хранително вещество. Все пак остава неизвестно до каква степен диетата може да отговори на това нарастващо търсене. Дори ако все по-често се препоръчват храни на растителна основа, повечето официални насоки все още не посочват предпочитание към приема на растителни протеини пред приема на животински протеини. Всъщност насоките на K/DOQI препоръчват най-малко 50% от приема на диетични протеини за пациенти, лекувани с поддържаща хемодиализа и хронична перитонеална диализа, да бъде с висока биологична стойност (т.е., вероятно от животински източник) [9,13,14]. В допълнение, спазването на диетата от пациентите често е лошо при пациенти с ХБН, така че е възможно потребностите от креатин все още да бъдат изпълнени [108]. Поради това са оправдани проучвания, за да се оцени дали приемът на креатин при пациенти с ХБН отговаря на повишените нужди от креатин или не.
На второ място не са установени причинно-следствени връзки между нивата на креатина и симптомите на ХБН, или саркопения, мускулна слабост, умора или нарушено познание. Тъй като тези симптоми са многостранни, други фактори вероятно допринасят. Тези други фактори включват ниско физическо бездействие, възпаление, метаболитна ацидоза, активиране на системата убиквитин-протеазома и дефектна инсулинова сигнализация, които всички са замесени в загубата на мускули и слабостта, свързани с ХБН [19,109,110,111,112].
10. Заключения
Благодарности
Данните за изследването, представени в този ръкопис, са получени от проучването Biobank and Cohort на TransplantLines Food and Nutrition (TxL-FN), финансирано от Top Institute Food and Nutrition и има етичен номер на одобрение METc2008/186 и регистрационен номер на пробата> NCT02811835.
Принос на автора
Всички автори са допринесли за ръкописа и са одобрили тази окончателна версия на произведението.
Финансиране
Това изследване не получи външно финансиране.
- Детско затлъстяване Бъдеще на хроничната бъбречна болест Национална бъбречна фондация
- Диета, чревен микробиом и индоксил сулфат при пациенти с хронични бъбречни заболявания - Ян - 2018 -
- FSHN16-9FS287 Хронична бъбречна болест калий и вашата диета
- Деца с хронична бъбречна болест Съвети за родители Национална бъбречна фондация
- Хронично бъбречно заболяване; Бъбречна недостатъчност BluePearl Pet Hospital