* Кореспонденция на: д-р Милтън Пакър, Институт за сърдечни и съдови болести Baylor, 621 N. Street Street, Далас, Тексас 75226. E-mail:
Baylor Heart and Vascular Institute, Baylor University Medical Center, Далас, Тексас
Имперски колеж, Лондон, Великобритания
Резюме
Резюме
В исторически план дългогодишно предсърдно мъждене (AF) се наблюдава в клинични условия, които се характеризират с продължителен хемодинамичен стрес. Най-честият рисков фактор за AF в общата популация е хипертонията и при тези пациенти хипертрофия на лявата камера (LV), последвана от уголемяване на лявото предсърдие (LA), създава анатомичния субстрат за AF. Активирането на ренин-ангиотензиновата система допринася за генезиса на AF при тези пациенти; в рандомизирани контролирани проучвания лечението на пациенти с хипертония или хипертрофия на ЛН с лекарства, които инхибират ренин-ангиотензиновата система, облекчава тежестта на ФП. 1 В допълнение, митралната или аортна клапна болест или систоличната дисфункция на ЛН също могат да доведат до трайно повишаване на налягането в LA, което води до плодороден субстрат за AF. Облекчаването на хемодинамичния стрес (напр. При коригираща операция на клапата) може да намали разпространението на AF при много пациенти 2; все пак, в други, разстроеният анатомичен субстрат на LA за AF не се подобрява ефективно от процедурата.
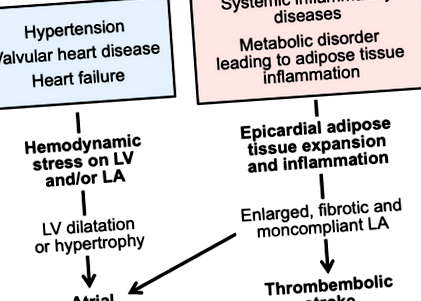
Въпреки това, през последните няколко десетилетия много пациенти, които имат АФ, нямат данни за разстройство, което причинява хемодинамични стресове в лявото предсърдие. Тези пациенти имат ехокардиограми, които обикновено не показват данни за значими клапни аномалии или дилатация, хипертрофия или нарушение на систолната функция на лявата камера. При тези индивиди сърдечните образи често разкриват аномалии в структурата или функцията на предсърдията, особено лявото предсърдие. Лявото предсърдие е разширено и често показва нарушено изпразване, както и нарушения в резервоара и функциите на тръбопровода. 3 Аномалии на структурата на LA предсказват развитието на AF, независимо от анамнеза за хипертония, сърдечна недостатъчност или миокарден инфаркт. 4 Тези пациенти имат предсърдна миопатия и най-клинично очевидната му проява е ФП (Фигура 1).
Фигура 1. Хемодинамичните и възпалителни стресове могат да доведат до предсърдно мъждене чрез отделни патофизиологични пътища.
LA показва ляво предсърдие; LV, лява камера или лява камера.
Системните възпалителни и метаболитни нарушения причиняват предсърдна миопатия, която може да доведе до ПМ
Много пациенти, които имат ФП, свързана с предсърдна миопатия, имат доказателства за дългогодишно възпаление, инициирано на място, което се намира извън сърдечно-съдовата система. Биомаркерите на системното възпаление са често срещан прецедент на AF в общата общност, 5 а системното възпаление предсказва еволюцията и развитието на неблагоприятно предсърдно ремоделиране. 6 Системният възпалителен процес може да се задейства по 2 начина.
Първо, много хронични системни възпалителни (често автоимунни) заболявания са придружени от LA миопатия и повишен риск от AF. По-конкретно, ревматоидният артрит е придружен от ≈40% увеличение на честотата на AF, 7 и този риск е очевиден дори след корекция за традиционните рискови фактори за AF (например хипертония). По подобен начин честотата на AF се увеличава с ≈40% при пациенти с псориазис 8; рискът е особено очевиден при тези, които са млади или имат клинично тежко възпалително заболяване. И при двете нарушения електрокардиографията показва аномалии на електрическото активиране в предсърдията, с доказателства за електромеханично забавяне. Сърдечните образни изследвания потвърждават наличието на значителни аномалии в предсърдната геометрия и характеристиките на пълнене (особено лявото предсърдие), които съответстват на разширението на системния възпалителен процес до предсърдната стена. По подобен начин честотата и разпространението на AF се увеличава при системна склероза, системен лупус еритематозус, анкилозиращ спондилит, възпалително заболяване на червата и хронично белодробно възпаление. 9, 10, 11, 12 Много пациенти с тези нарушения имат структурни или функционални доказателства за предсърдна миопатия (Фигура 2). 13, 14
Фигура 2. Хроничните системни възпалителни разстройства и метаболитни нарушения, свързани с възпаление на мастната тъкан, могат да доведат до разширяване на епикардната мастна маса, което може да причини миопатия на лявото предсърдие и нейните клинични последици.
LA показва лявото предсърдие.
Второ, широк спектър от метаболитни нарушения, които се характеризират с възпаление на мастната тъкан, също са придружени от повишен риск от ПМ. Затлъстяването драстично увеличава честотата и разпространението на AF, 15 и тежестта на AF значително намалява чрез бариатрична хирургия. Захарният диабет тип 2 е придружен от повишен риск от ПМ, който е пропорционален на степента на лош гликемичен контрол. 16 Други състояния на възпаление на мастната тъкан и инсулинова резистентност са придружени от повишен риск от ПМ; те включват метаболитен синдром и безалкохолно чернодробно заболяване 17, 18, както и хормонални заболявания, които насърчават адипогенезата и дисфункцията на мастната тъкан (например хипотиреоидизъм и първичен хипералдостеронизъм). 19, 20 Всяко от тези нарушения е придружено от високо разпространение на LA заболяване при неинвазивно изобразяване, обикновено характеризиращо се с LA дилатация, фиброза или анормална динамика на пълнене, а тежестта на тези аномалии често е пропорционална на степента на метаболизма нарушение или системно възпаление (Фигура 2). 21, 22, 23, 24
Тази статия се позовава на LA миопатията при пациенти с хронично системно възпалително разстройство или с адипогенно метаболитно заболяване като „свързана с възпалението предсърдна миопатия“, която може да доведе до „AF, свързана с възпалението“.
Патогенеза и идентифициране на предсърдна миопатия в състояния на системно или мастно възпаление на тъканите
Системните възпалителни разстройства могат да причинят възпалително увреждане на коронарната микроциркулация, което води до микроваскуларна дисфункция, както и миокардна фиброза. Освен това състоянията на системно възпаление или мастна тъкан могат да предизвикат трансформационни промени в мастната тъкан в епикарда, като по този начин разширяват нейната маса и променят нейната биология в провоспалително състояние. Тъй като епикардът и миокардът са свързани чрез безпрепятствена микроциркулация, всяко биологично разстройство в епикардната мазнина лесно се предава в подлежащите тъкани на миокарда. По-конкретно, секрецията на възпалителни адипоцитокини (напр. Фактор на туморна некроза-α, интерлевкин 1-β, интерлевкин-6) от дисфункционалното депо на епикардната мастна тъкан може да причини микроциркулаторно увреждане и фиброза в подлежащия съседен миокард, особено предсърдния миокард. Разширяването и възпалението на мастната тъкан на епикарда са свързани с анатомичните и патофизиологичните субстрати за ПМ в прилежащия предсърден миокард. 26, 27
Роля на провъзпалителните медиатори в патогенезата на LA миопатия
Тези наблюдения могат да обяснят няколко важни констатации. Първо, хроничните системни възпалителни и метаболитни нарушения, които са свързани с ПМ, са придружени от разширяване на масата на епикардната мастна тъкан 28, 29, 30, 31, 32, 33, 34, 35; важно е, че увеличаването на обема на епикардната мазнина е пропорционално на клиничната тежест на заболяването и интензивността на системното възпаление. Второ, при пациенти с ПМ има тясна връзка между дебелината и възпалителното състояние на епикардната мазнина и тежестта на електрическите аномалии в съседния миокард. 26, 27 Трето, обемът на епикардната мазнина предсказва честотата на AF в общността дори при липса на предварителни доказателства за сърдечно-съдови заболявания 36; само депото на епикардната мазнина (а не и други висцерални мазнини) са свързани със сърдечни аномалии 37; и масата на епикардната мастна тъкан се увеличава, тъй като AF се развива от пароксизмална до персистираща аритмия. Четвърто, има силна връзка между масата на епикардната мастна тъкан и нарушения в коронарната микроваскуларна дисфункция и предсърдната геометрия в редица системни възпалителни и метаболитни нарушения (Фигури 1 и 2). 32, 39, 40
Идентичността на провъзпалителните медиатори, освободени от депата на епикардната мастна тъкан, които са отговорни за нараняване на прилежащия предсърден миокард, е неизвестна. Въпреки това, 3 кандидати (лептин, алдостерон и натриуретични пептиди) са замесени в патогенезата на свързаната с възпалението предсърдна миопатия и ПМ. 41 Повишената активност на алдостерона и намалената активност на ендогенните натриуретични пептиди могат да насърчат епикардното затлъстяване и трансформацията на неговата биология от хранително в провоспалително състояние. 42, 43 Локалното повишаване на алдостерона може да причини коронарно микроваскуларно увреждане и фиброза 44; тези действия обикновено се противопоставят на тези на ендогенните натриуретични пептиди, 45 но тяхното влияние може да бъде сведено до минимум чрез повишен клирънс на натриуретични пептиди от хипертрофирани и възпалени адипоцити. 46 И накрая, системни възпалителни разстройства и метаболитни нарушения, свързани с възпаление на мастната тъкан, причиняват отделянето на лептин, 47, 48, който сам по себе си може да причини микроваскуларна ендотелна дисфункция и да стимулира както възпалението, така и фиброзата. 49 Интересното е, че в експериментални и клинични проучвания има тясна връзка между алдостерон и лептин с AF. 50, 51
Последици от свързаната с възпалението предсърдна миопатия
Наличието на предсърдна миопатия може да се прояви клинично по 3 начина: (1) може да предизвика предсърдни тахиаритмии; (2) може да увеличи белодробното венозно налягане и да наруши толерантността към упражненията; и (3) може да предразположи към образуване на тромби в LA, системна тромбоемболия и инсулт (Фигура 2).
Предсърдна миопатия като причина за ПМ
Най-клинично очевидният биомаркер за наличието на предсърдна миопатия е намирането на AF на повърхностната ЕКГ. Изглежда обаче вероятно предсърдната миопатия да еволюира за дълги периоди от време, преди AF да стане клинично очевидна, и може да окаже клинично важни ефекти дори преди те да проявят AF. 52 Обратно, някои пациенти, особено тези, които имат малко възпалителни съпътстващи заболявания (напр. Тези с ниски нива на циркулиращ C-реактивен протеин), могат да имат AF без функционалните последици от основната миопатия. 53, 54, 55
Предсърдна миопатия като причина за белодробна венозна хипертония
Предаването на системно или мастно-тъканно възпаление на LA миокарда уврежда неговите резервоарни, проводникови и систолни функции. В резултат на това изпразването на LA намалява, но твърдостта на камерата се увеличава, което води до непропорционално повишено налягане на LA, дори ако обемите на LA се увеличават само умерено. 54 Въпреки че възпалителният процес, който причинява предсърдна миопатия, може също да засегне лявото предсърдие и да наруши неговата разтегливост, повишаването на налягането в LA при пациенти с ПМ е резултат предимно от предсърдната миопатия, а не поради ретроградното предаване на крайно-диастоличното налягане на ЛН към лявото предсърдие. Докато налягането в белодробния клин обикновено е по-ниско от крайното диастолично налягане на LV при пациенти в синусов ритъм, обратното е вярно при пациенти с ляво сърдечно заболяване и ФП. 69 В резултат на това LA миопатията сама по себе си може да причини белодробна венозна хипертония, която може да стимулира диспнея при натоварване и да ограничи толерантността към упражненията.
Следователно, дори при пациенти с ПМ, които имат доказателства за свързани аномалии при пълнене на ЛН, измерванията на щама LA са по-тясно свързани с капацитета и резултатите от физическото натоварване, отколкото налягането на пълнене на ЛН. 70 Интересното е, че повишаването на налягането в LA също изглежда по-важно за ограничаване на функционалния капацитет при пациенти с ПМ, отколкото предизвиканата от упражнения тахикардия. Пациентите с ПМ с повишено сърдечна честота, предизвикано от физическо натоварване, не показват по-лоша физическа способност, 71 по този начин се повдигат въпроси относно ролята на съкратената диастола за ограничаване на толерантността към усилията. Най-важното е, че в многобройни маскирани рандомизирани контролирани проучвания, медикаментозният контрол на скоростта в покой или по време на тренировка е бил придружен или без подобрение, или с влошаване на толерантността към упражнения, независимо от фармакологичния механизъм на действие на агента, използван за забавяне на атриовентрикуларната проводимост 72, 73, 74, 75
Предсърдна миопатия като причина за системна тромбоемболия
Пациентите със системно възпалително разстройство, свързано с ФП, са изложени на повишен риск от тромбоемболичен инсулт. Например, пациентите с ревматоиден артрит и псориазис имат 50% до 100% увеличение на риска от исхемичен инсулт, но степента на повишения риск се повишава до 3 пъти, ако засегнатите лица са на възраст 76 години. Важното е, че увеличението на риска от инсулт значително надвишава това се предсказва от наличието на традиционни сърдечно-съдови рискови фактори, но вместо това успоредява клиничната тежест и продължителност на артритната болест и интензивността на системното възпаление. 8, 77 По подобен начин рискът от инсулт при свързани с AF метаболитни нарушения (напр. Метаболитен синдром или безалкохолна мастна чернодробна болест) е по-голям, отколкото може да се обясни с промени в кръвното налягане, серумния холестерол или телесното тегло, но изглежда да бъде тясно свързана с биомаркери на системно възпаление (т.е. С-реактивен протеин). 78, 79
И така, повишеният риск от инсулт при системни възпалителни разстройства е свързан с ПМ или с основната свързана с възпалението предсърдна миопатия? Лекарите отдавна вярват, че хаотичното свиване на AF води до образуване на тромби; въпреки това, намалената скорост на потока в лявото предсърдие, свързана с основната предсърдна миопатия, предразполага към тромбоемболизация, обяснявайки защо митралната регургитация предпазва от застой на кръв в лявото предсърдие, въпреки че увеличава риска от ПМ чрез насърчаване на дилатацията на LA. 80 Възпалителният и фибротичен процес в лявото предсърдие е основен определящ фактор за увреждането на кондуктивните функции на камерата, дори при липса на AF; освен това възпалението и фиброзата могат директно да засилят тромбогенността на предсърдния ендокард. Съответно, предсърдната фиброза предразполага към появата на LA тромбообразуване и инсулт, независимо от размера на LA камерата. 81
Съответно, тежестта на LA миопатията води до риск от инсулт и съдови мозъчни наранявания при пациенти, със или без AF. 82, 83 При пациенти, които нямат рискови фактори, отразяващи съществуването на предсърдна миопатия, рискът от инсулт при пациенти с ПМ е подобен на този при пациенти без ПМ. 3 Обратно, CHA2DS2-VASc рискови резултати (които идентифицират много пациенти с предсърдна миопатия или които имат епикардно затлъстяване 84) прогнозират появата на инсулт, дори при пациенти без ПМ, 85 и при пациенти с висок риск, риска от тромбоемболични събития което се определя от предсърдната миопатия не се увеличава допълнително от наличието на AF. 86 Забележително е, че сред индивидите с известна AF честотата на инсулт при пациенти с ревматоиден артрит и системен лупус еритематозус е по-голяма, отколкото може да се обясни с оценката CHA2DS2-VASc, 87, 88 вероятно защото оценката не включва измервания на системните възпаление или преки оценки на предсърдната миопатия. Всъщност някои предлагат оценката на риска CHA2DS2-VASc да се умножи при пациенти, които имат системно възпалително разстройство. 89
Съмненията относно предимството на AF при причиняване на инсулт са подсилени от резултатите от надлъжни проучвания, които използват устройства за непрекъснато електрокардиографско наблюдение за откриване на AF при пациенти в риск от или с анамнеза за инсулт. В тези проучвания рисковите пациенти обикновено не показват доказателства за AF през месеца, предхождащ появата на инсулт. 90, 91 Пациенти, които са претърпели тромбоемболичен инсулт, са проявявали ФП само рядко и преходно, 92 и при много пациенти АФ се наблюдава само след мозъчно-съдовото събитие. 93 Важно е, че употребата на антикоагуланти, ръководена от наличието или отсъствието на ФП при отделни рискови пациенти, не предотвратява тромбоемболични събития. 94
Освен това не е доказано, че фармакологичният контрол или процедурното премахване на ФП намаляват риска от инсулт в мащабни рандомизирани контролирани клинични изпитвания. Рандомизирани контролирани проучвания, които сравняват стратегии за контрол на скоростта и ритъм-контрол при пациенти с установена ФП, не показват намаляване на риска от системна тромбоемболия или инсулт при пациенти, назначени за контрол на ритъма, въпреки че тези пациенти имат намалена тежест на ФП. 95 Парадоксално е, че групата за контрол на ритъма е имала повишен риск от тромбоемболични събития, 96 вероятно защото пероралната антикоагулация е била прекратена при някои пациенти въз основа на погрешното убеждение, че ФП (а не предсърдната миопатия) е основният двигател на инсулта. И накрая, премахването на AF чрез катетърна аблация не намали риска от инсулт в широкомащабно рандомизирано контролирано проучване; в това проучване се поддържа перорална антикоагулационна терапия, въпреки че не е вероятно да бъде в терапевтичния диапазон при много пациенти. 97
Идентифициране на пациенти с свързана с възпаление предсърдна миопатия
Заключения
AF отдавна се разглежда като последица от хемодинамичните стресове в лявата част на сърцето, особено състоянията на претоварване на налягането и обема при хипертония и клапни сърдечни заболявания. През последните години обаче AF се е превърнало в разстройство, което често е следствие от широк спектър от системни възпалителни или метаболитни нарушения, които могат да причинят дисфункционални промени в депата на мастната тъкан, особено в епикарда. Предаването на проинфламаторното състояние на разширена маса на епикардната мастна тъкан в съседния миокард е в състояние да доведе до неблагоприятни структурни и функционални промени в лявото предсърдие, водещи до развитието на предсърдна миопатия. Предсърдният миопатичен процес се характеризира с коронарна микроваскуларна дисфункция, миокардна фиброза и нарушение на кондуктивните функции на камерата. Най-често се проявява клинично като AF и може да допринесе (независимо от аритмията) за развитието на белодробна венозна хипертония и тромбоемболичен инсулт. Пациентите с свързана с възпаление предсърдна миопатия може да не реагират добре на стратегии за контрол на скоростта или ритъма за ПМ, но антикоагулацията е от съществено значение за намаляване на риска от тромбоемболичен инсулт.
Разкриване
Наскоро д-р Пакър се консултира за Abbvie, Actavis, Akcea, Amgen, AstraZeneca, Bayer, Boehringer Ingelheim, Cardiorentis, Daiichi Sankyo, Johnson & Johnson, NovoNordisk, Pfizer, Sanofi, Synthetic Biologics и Theravance. Нито една от тези връзки не е свързана с темата на този преглед.
- Пълнотекстово пречистване и характеризиране на свързани с патогенезата клас 10
- Млечни продукти и възпаление Преглед на клиничните доказателства Критични прегледи в науката за храните
- Диетичният капсаицин и неговата сила срещу затлъстяването от механизма до клиничните последици Bioscience
- Клетъчна пролиферация при гастрит тип С, засягаща непокътнатия стомах Journal of Clinical Pathology
- Клетъчни и молекулярни подписи на индуцирана от алкохол миопатия при жени American Journal of