Мариан Боес
От * Център за изследване на рака и Департамент по биология, Масачузетски технологичен институт, Кеймбридж, Масачузетс 02139; и ‡ Център за изследване на кръвта, Харвардско медицинско училище, Бостън, Масачузетс 02135
Андрей П. Продей
От * Център за изследване на рака и Департамент по биология, Масачузетски технологичен институт, Кеймбридж, Масачузетс 02139; и ‡ Център за изследване на кръвта, Харвардско медицинско училище, Бостън, Масачузетс 02135
Тара Шмит
От * Център за изследване на рака и Департамент по биология, Масачузетски технологичен институт, Кеймбридж, Масачузетс 02139; и ‡ Център за изследване на кръвта, Харвардско медицинско училище, Бостън, Масачузетс 02135
Майкъл К. Карол
От * Център за изследване на рака и Департамент по биология, Масачузетски технологичен институт, Кеймбридж, Масачузетс 02139; и ‡ Център за изследване на кръвта, Харвардско медицинско училище, Бостън, Масачузетс 02135
Jianzhu Chen
От * Център за изследване на рака и Департамент по биология, Масачузетски технологичен институт, Кеймбридж, Масачузетс 02139; и ‡ Център за изследване на кръвта, Харвардско медицинско училище, Бостън, Масачузетс 02135
Резюме
За да се оцени ролята на естествения имуноглобулин (Ig) M в незабавния отговор срещу микробна инфекция, тествахме мутантни мишки, които имат недостиг на секретиран (и) IgM в модел на остър перитонит, индуциран от лигавица и пункция на целус (CLP). 20% от мишки от див тип умряха в рамките на 32 часа от CLP, докато 70% от мишки с дефицит на sIgM умряха за същия период от време. Повишената чувствителност е свързана с намалено ниво на фактор на туморна некроза (TNF) -α, намалено набиране на неутрофили и повишено бактериално натоварване в перитонеума и повишени нива на ендотоксин и провоспалителни цитокини в кръвообращението. Резистентността към CLP от sIgM-дефицитни мишки беше възстановена чрез разтваряне с поликлонален IgM от нормален миши серум. Разтварянето с моноклонален IgM, специфичен за фосфатидилхолин, консервиран компонент на клетъчната мембрана, има умерен ефект, но моноклонален IgM, специфичен за фосфохолин, не е защитен. Тези открития показват критична роля на естествения IgM в непосредствената защита срещу тежка бактериална инфекция.
Спонтанно възникващите имуноглобулини в човешката кръв от пъпна връв, при „мишки без антиген“ и при нормални индивиди при липса на очевидна антигенна стимулация се наричат естествени антитела (за прегледи вж. Препратки 1–3). Повечето от тези антитела са от клас IgM, продуцирани от B-1 клетки. B-1 клетките се различават от конвенционалните B клетки по това, че се генерират предимно по време на развитието на плода и новороденото (4–6). Поради преференциалното използване на JH-проксимални VH генни сегменти и липсата на терминална активност на деоксинуклеотидил трансфераза в прекурсорни В клетки по време на ранното онтогенезиране (7–9), репертоарът на естествените антитела е много по-ограничен от тези, произведени от конвенционалните В клетки. Голяма част от естествените антитела са полиреактивни на филогенетично запазени структури като нуклеинови киселини, протеини от топлинен шок, въглехидрати и фосфолипиди (4–6, 10). Например, 5–15% от миши B-1 клетки експресират IgM, специфичен за фосфатидилхолин (PtC), общ мембранен компонент, изложен след третиране на червените кръвни клетки с протеолитичен ензим бромелаин (11, 12).
Физиологичните функции на естествените антитела отдавна са предмет на интерес. Смята се, че сред много постулирани функции естественият IgM, заедно с факторите на вродения имунитет, осигурява първа линия на защита срещу микробна инфекция (1–3). В допълнение към естественото си присъствие, IgM е пентамер и потенциално може да се свърже с 10 антигенни детерминанти на молекула. Полиреактивността му позволява да реагира едновременно с широк спектър от антигени. Освен това, IgM е мощен активатор на комплемента. Активирането на комплемента може директно да доведе до лизис на нахлуващи бактерии или опсонизация на инфекциозни частици за ефективна фагоцитоза от макрофаги и полиморфонуклеарни левкоцити. Въпреки това, поради липсата на подходящи животински модели, предполагаемата функция на естествения IgM не е изследвана критично при физиологични условия.
По-рано сме конструирали мутантен миши щам, при който В клетките имат специфичен дефицит на секретиран (и) IgM, но въпреки това експресират свързан с мембраната IgM и секретират други Ig изотипове (13). За да се определи физиологичната роля на естествения IgM при бактериална инфекция, ние изследвахме чувствителността на мишки с дефицит на sIgM в модел на остър септичен перитонит, предизвикан от лигатура на цекуса и пункция (CLP [14]). Ние показваме, че мишките с дефицит на sIgM са много по-податливи от мишки от див тип, както се посочва от невъзможността да се изчистят бактериите от перитонеума, системното освобождаване на провъзпалителни цитокини и високата смъртност. Резистентността към CLP от sIgM-дефицитни мишки беше възстановена чрез разтваряне с поликлонален IgM от нормален миши серум и в по-малка степен от моноклонален IgM, специфичен за PtC, но не и за фосфохолин (PC). Нашите открития показват критична роля на естествения IgM в незабавния отговор срещу остра системна бактериална инфекция.
Материали и методи
Мишките с дефицит на sIgM са описани по-рано (13). Мутантни мишки или на смесен фон C57BL/6 × 129, или на чист 129 фон, се поддържат в специфични съоръжения, свободни от патогени и се използват на възраст 6-8 седмици. Проучванията са извършени в съответствие с институционалните насоки за употреба и грижи за животните.
Хирургичната процедура е извършена, както е описано (15). Накратко, мишките се анестезират от авертин (0,2 ml 2,5% разтвор на 10 g телесно тегло) и се прави разрез на средната линия от 0,5 cm в перитонеума. Дисталните две трети от сляпото черво бяха лигирани с копринен шев и сляпото черво беше пробито веднъж с игла 18,5 и след това внимателно изстискано, за да се гарантира, че дупките са напълно отворени. Цекумът е върнат в перитонеалната кухина, стената на тялото е зашита и разрезът е затворен с 9-милиметрови скоби за навиване от неръждаема стомана. Фиктивните контроли бяха оперирани по същия начин, но без лигиране и пробиване. В някои експерименти мишки са били убити 3 часа след CLP. Перитонеалната промивка е събрана след инжектиране на 3 ml PBS с 2% FCS и е използвана за допълнителни анализи (вж. По-долу). В други експерименти, мишки са били обезкървени през опашната вена на 1,5, 3, 6 и 12 часа след CLP и серуми са били използвани за по-нататъшни анализи. Статистически анализ за оцеляване беше извършен с помощта на програмата Stata (Stata Corp., College Station, TX).
Пречистване на IgM.
Резултати и дискусия
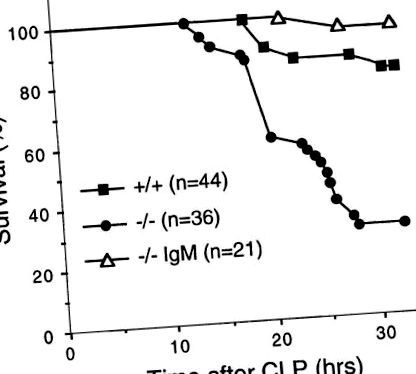
За да изследваме ролята на естествения IgM в незабавния отговор на микробна инфекция, определихме чувствителността на мишки с дефицит на sIgM към остър септичен перитонит, индуциран от CLP, който освобождава ендогенни бактерии от цекума в перитонеалната кухина. 32 часа след CLP, 70% от мишките с дефицит на sIgM умират в сравнение с 20% от мишките от див тип (фиг. (Фиг. 1), 1), което показва, че липсата на естествен IgM прави мутантните мишки много по-податливи на острата бактериална инфекция (Р (фиг. 1). 1). По същия начин мишките с дефицит на sIgM също са по-чувствителни към предизвикване от отделни видове патогенни бактерии като стрептококи от група В. Смъртоносната доза за 50% (LD50) предизвикани животни е 10 пъти по-ниска за мишки с дефицит на sIgM, отколкото за мишки от див тип (нашите непубликувани наблюдения). Мишките с дефицит на sIgM също показват повишена честота на спонтанна бактериална инфекция от опортюнистични бактерии, включително Pasteurella pneumotropica, в специфични съоръжения, свободни от патогени (нашите непубликувани наблюдения). Тези данни показват, че естественият IgM е необходим за защита срещу бактериална инфекция.
Естественият IgM придава устойчивост на CLP. Мишки с дефицит на sIgM (-/-) и див тип (+/+) на възраст 6-8 седмици бяха обект на CLP. Възстановени с IgM мишки с дефицит на sIgM (-/- IgM) са дадени като единична доза от 0,5 mg i.v. от общия IgM афинитет - пречистен от нормален миши серум 4 часа преди CLP. Мишките се наблюдават за оцеляване през първите 32 часа.
Устойчивостта на CLP зависи от комплемента, мастоцитите и TNF-α (17–20). Чувствителността на мишки с дефицит на sIgM към CLP е подобна на мишки с дефицит на компонент C3 или C4 на комплемента или мастоцити (17–19). Изискването на естествения IgM за резистентност към CLP вероятно се основава на способността му да се свързва с бактерии и да активира комплемента. За да тестваме тази възможност, определихме незабавната реакция, като анализираме нивата на TNF-α, IL-6 и LPS, инфилтрация на неутрофили и бактериално натоварване в перитонеалната промивка 3 часа след CLP. Както при мишки с дефицит на С3, нивата на TNF-α и IL-6 при мутантни мишки са приблизително наполовина тези при мишки от див тип (Таблица (Таблица 1). 1). Без CLP, както мишките с дефицит на sIgM, така и от див тип имат много малко неутрофили в перитонеума (Таблица 1, 1 и данните не са показани). Освен това 10 пъти повече Е. coli бяха възстановени от перитонеалната промивка на мишки с дефицит на sIgM, отколкото от мишки от див тип (Таблица (Таблица 1). 1). Свързано с по-високата бактериална натовареност, при мишки с дефицит на sIgM се открива приблизително двойно повече количество ендотоксин (LPS), отколкото при мишки от див тип. Разтварянето на мишки с дефицит на sIgM с общ IgM възстановява нивата на TNF-α и неутрофилите и намалява натоварването с Е. coli в перитонеалния лаваж (Таблица (Таблица 1), 1), в съответствие с увеличената преживяемост. Тези данни показват, че ефектите в резултат на отсъствието на sIgM върху индукцията на TNF-α, инфилтрацията на неутрофили и бактериалното натоварване в перитонеума са много сходни с тези, наблюдавани при липсата на C3, което показва, че естественият IgM функционира през пътя на комплемента.
маса 1
Анализи на перитонеална промивка 3 часа след CLP
| TNF-α (pg/ml) | 1,507 | 892 | 2 068 | 1,643 | 304 |
| IL-6 (pg/ml) | 2734 | 1,401 | ND | ND | ND |
| Неутрофили (%) | 81.7 | 54.8 | 83.5 | 69.6 | 22.1 |
| Е. coli (CFU) | 34,9 × 10 3 | 350 × 10 3 | 2,3 × 10 3 | 62,5 × 10 3 | 510 × 10 3 |
| LPS (EU/ml) | 36.7 | 62.9 | 23.8 | 51.2 | 64,0 |
Мишки с дефицит на sIgM (-/-), мишки от див тип (+/+) и възстановени с IgM мишки с дефицит на sIgM бяха обект на CLP. Перитонеалната промивка се извършва чрез инжектиране на 3 ml i.p. на PBS с 2% FCS 3 часа след CLP. Възстановените с IgM мишки получават еднократна доза от 0,5 mg i.v. на пречистен поликлонален IgM от нормален миши серум или моноклонален IgM, специфичен за PtC или PC 4 часа преди CLP. Перитонеалните промивки на мишки с дефицит на sIgM и див тип бяха обединени от седем мишки и бяха анализирани нивата на TNF-α, IL-6 и LPS, броя на Е. coli и неутрофилите (вж. Материали и методи). Нивата на TNF-a и LPS, броят на Е. coli и неутрофилите са анализирани при перитонеална промивка от отделни мишки, възстановени с IgM. Показана е средната стойност на четири мишки. Подобни резултати бяха получени в отделен експеримент.
IgM е най-мощният активатор на комплемента сред петте класа на Igs. Единична свързана IgM молекула е достатъчна, за да активира комплемента за лизиране на червени кръвни клетки (21). Свързването на естествен IgM с бактериите непосредствено след инфекцията вероятно води до активиране на комплемента по класическия път. Тъй като серумът на мишки с дефицит на sIgM лизира ли антиопсонизирани червени кръвни клетки също толкова ефективно, колкото серума от мишки от див тип при хемолитичен анализ (данните не са показани), повишената чувствителност на мишки с дефицит на sIgM към CLP вероятно е свързана с липсата на IgM-медиирано активиране на комплемента. Изглежда, че мишките с дефицит на C3 или C4 са дори по-чувствителни към CLP, отколкото мишките с дефицит на sIgM, както е показано със 100% смъртност в рамките на 24 часа (17). Това може да се дължи на факта, че комплементът може да се активира и по алтернативния и лектиновия път, а комплементът е важен за ефективното изчистване на бактериите. В допълнение, мишките с дефицит на sIgM имат относително нормални нива на IgGs (13), някои от които вероятно са естествени антитела. Въпреки че IgG протеините могат да допринесат за оцеляването на мишки с дефицит на sIgM, те очевидно не са достатъчни, за да компенсират напълно отсъствието на естествен IgM.
Сравнение на нивата на LPS, TNF-α и IL-6 в серума на мишки с дефицит на sIgM и див тип в различни времеви точки след CLP. Серумите се събират на 1,5, 3, 6 и 12 часа след CLP и се разделят на четири групи въз основа на генотипа на мишките и дали мишките са умрели или оцелели на 32 часа след CLP. Фалшивият контрол беше опериран без лигиране и пробиване. Концентрациите на LPS, TNF-a и IL-6 се определят чрез ELISA. Лентите за грешки показват SD. За анализа на TNF-α броят на мишките, използвани във всяка категория, е както следва: -/- мъртви, 12; -/- оцелял, 10; +/+ мъртви, 10; и +/+ оцелели, 16. Осем мишки бяха използвани във всяка категория за IL-6 анализ. Шест мишки бяха използвани във всяка категория за LPS анализ. Броят на фалшивите контроли за TNF-α, IL-6 и LPS бяха съответно 2, 1 и 1.
Благодарности
Благодарим на д-р. Leonore A. Herzenberg и J. Latham Claflin за анти-PtC и PC хибридоми, съответно; Д-р. Йонг Уанг и Джей Остин за помощ при хемолитичен анализ; Д-р Херман Айзен за критично четене на ръкописа; и членове на лабораторията за помощ и дискусия.
- 6 актьори, за които трябваше да отслабнат за роля във филма
- 1 LB Воронеж креда 100% чисти естествени всякакви примеси и Etsy
- Кайсии Естествена храна за отслабване HowStuffWorks
- Бета-адренергичните рецептори са критични за загуба на тегло, но не и за други метаболитни адаптации към
- 6 плодове за здравето на берберис; усилвател; Добавка Natural Antibacterial 1MD