Резюме
Заден план
Безалкохолната мастна чернодробна болест (NAFLD) е най-често срещаното хронично чернодробно заболяване и се превърна в опасение за общественото здраве в световен мащаб. Отличителният белег на NAFLD е чернодробната стеатоза. Следователно има спешна нужда от разработване на нови терапевтични стратегии, които са ефикасни и имат минимални странични ефекти при чернодробна стеатоза и лечение на NAFLD. Настоящото проучване има за цел да изследва ефекта на хранителната добавка с куркумин върху индуцираната от високо съдържание на мазнини чернодробна стеатоза и основния механизъм.
Методи
ApoE -/- мишките са били хранени с нормална диета, диета с високо съдържание на мазнини (HFD) или HFD, допълнена с куркумин (0,1% w/w) в продължение на 16 седмици. Тегло на тялото и черния дроб, биохимична кръв.
параметри и бяха измерени липидите на черния дроб. Анализирани са чревна пропускливост, чернодробна стеатоза и експресия на иРНК и протеини на свързана с TLR4 възпалителна сигнална молекула.
Резултати
Прилагането на куркумин значително предотвратява индуцираното от HFD увеличаване на телесното тегло и намалява теглото на черния дроб. Куркуминът атенюира чернодробната стеатоза заедно с подобрения серумен липиден профил. Освен това, куркуминът регулира експресията на протеина на червата с плътно свързване zonula occluden-1 и occludin, което допълнително подобрява дисфункцията на чревната бариера и намалява нивата на циркулиращия липополизахарид. Куркуминът също така значително регулира протеиновата експресия на чернодробния TLR4 и миелоидния диференциращ фактор 88 (MyD88), инхибира p65 ядрената транслокация и ДНК свързващата активност на ядрения фактор-кВ (NF-кВ) в черния дроб. В допълнение, mRNA експресията на чернодробен тумор некротизиращ фактор-α (TNF-α) и интерлевкин-1β (IL-1β), както и плазмените нива на TNF-α и IL-1β също бяха намалени чрез лечение с куркумин.
Заключение
Тези резултати показват, че куркуминът предпазва от HFD-индуцирана чернодробна стеатоза чрез подобряване на чревната бариерна функция и намаляване на ендотоксина и възпалението на черния дроб TLR4/NF-kB. Способността на куркумина да инхибира чернодробната стеатоза представя неговия потенциал като ефективна диетична интервенция за превенция на NAFLD.
Въведение
Безалкохолната мастна чернодробна болест (NAFLD) е най-често срещаното хронично чернодробно заболяване, засягащо 22–28% от възрастното население и> 50% от затлъстелите индивиди по света [1]. NAFLD обхваща широк спектър от чернодробни патологии, които варират от проста стеатоза до безалкохолен стеатохепатит. Отличителният белег на NAFLD е чернодробната стеатоза. Чернодробната стеатоза е прогресия на прекомерно натрупване на триглицериди, причинена от дисбаланса между притока и синтеза на чернодробни липиди от едната страна и тяхното β-окисление и износ от другата [2]. Много клинични проучвания и проучвания върху животни показват централната роля на натрупването на липиди в прогресията и патогенезата на NAFLD [3]. Поради това е важна стъпка в превенцията на NAFLD за инхибиране на чернодробната стеатоза чрез намаляване на чернодробното натрупване на липиди.
Куркуминът е естествено полифенолно съединение, присъстващо в куркумата и притежава противовъзпалителни, антиоксидантни и хепатопротективни свойства [12, 13]. В последните проучвания върху животни е показано, че куркуминът има защитен ефект върху черния дроб срещу натрупването на мазнини, предизвикано от диета с високо съдържание на мазнини [14, 15]. Точният механизъм, чрез който куркуминът намалява натрупването на мазнини в черния дроб и облекчава чернодробната стеатоза, не е напълно изяснен. TLR4 играе ключова роля в натрупването на чернодробна мастна тъкан и развитието на NAFLD, няколко проучвания показват, че приложението на куркумин е участвало в регулацията на различни възпалителни цитокини, включително TNF-α и IL-1β чрез инхибиране на активирането на сигнализирането на TLR4/NF-κB пътеки [16, 17]. Все пак дали куркуминът може да предотврати натрупването на мазнини, причинено от диета с високо съдържание на мазнини и чернодробната стеатоза, като инхибира сигнализирането на TLR4, все още не е известно. Следователно целта на това проучване е да се изследва дали куркуминът може да отслаби индуцирана от HFD чернодробна стеатоза и да потисне развитието на NAFLD при мишки ApoE -/- чрез подобряване на чревната бариерна функция и намаляване на наличността на TLR4 лиганд и потискане на възпаление, медиирано от чернодробен TLR4, както допълнително проучи защитните ефекти на куркумина върху атеросклеротично увреждане на черния дроб.
Материали и методи
Химикали
Куркумин (чистота> 98%) е получен от Sigma-Aldrich (Сейнт Луис, Мисури, САЩ). Антитела срещу TLR4 са закупени от Santa Cruz Biotechnology (Санта Круз, Калифорния). Антитела срещу p65, оклудин и β-актин са закупени от Cell Signaling Technology (Danvers, MA, USA). Антитела срещу зонула оклуден-1 (ZO-1) и MyD88 са закупени от Abcam (Cambridge, MA, USA). Комплектът за PCR в реално време на SYBR Green е закупен от Applied Biosystems (Фостър Сити, Калифорния, САЩ). TRIzol реагентът и комплектът за синтез на cDNA са получени от Invitrogen Life Technology (Carlsbad, CA, USA). ELISA комплекти за количествено определяне на TNF-α, IL-1β и LPS са закупени от R&D Systems (Minneapolis, MN, USA). Комплектът TransAM NF-κB p65 ELISA е закупен от Active Motif (Карлсбад, Калифорния, САЩ).
Животни и диети
Биохимичен анализ
Общо липиди бяха извлечени от чернодробната тъкан по метода на Bligh и Dyer. След изпаряване до сухо под поток азот, липидните екстракти се суспендират отново в разтвор на 90% изопропанол и 10% Triton X-100. След това общото съдържание на TG в черния дроб се определя количествено, като се използват търговски ензимни комплекти (BioSino, Пекин, Китай) на автоматичен биохимичен анализатор Biosystem (Мадрид, Испания) [18, 19]. Общият холестерол в серума (TC) и TG се определят ензимно чрез използване на търговски комплекти (BioSino, Пекин, Китай), в съответствие с препоръките на производителя. Серумна аланин аминотрансфераза (ALT), аспартат аминотрансфераза (AST), липопротеинов холестерол с ниска плътност (LDL-C) и липопротеинов холестерол с висока плътност (HDL-C) бяха определени с автоматичен биохимичен анализатор (Olympus AU600, Токио, Япония) [ 18, 19].
Хистологично изследване
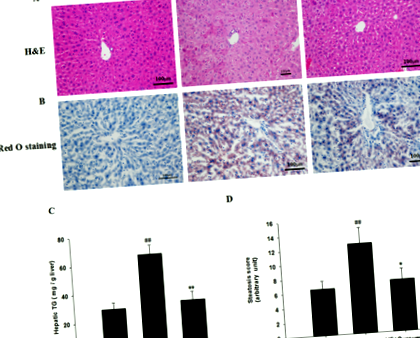
Чернодробните филийки бяха фиксирани с 10% буфериран формалин, вграден в парафин, нарязани с дебелина 5 μm и след това оцветени с хематоксилин/еозин (H&E). За оцветяване с Oil Red O, черният дроб беше вграден в Tissue-Tek OCT, замразено и съхранен при - 80 ° C. Изображенията са заснети с помощта на камера Olympus BX60 при увеличение × 200. Стеатозата се оценява числено, следвайки полуколичествен патологичен стандарт.
Имунохистохимия
За измерване на експресията на TLR4 в чернодробните тъкани се използва имунохистохимично оцветяване, както е описано по-рано [20]. Накратко, чернодробните срези бяха фиксирани в студен ацетон за 10 минути, измити с PBS за три пъти и блокирани с 3% BSA за 30 минути при стайна температура. След това срезовете бяха инкубирани със специфични антитела (TLR4 антитяло) за една нощ при 4 ° C, след това инкубирани с конюгирани с биотин вторични антитела, авидин-биотин комплекс и DAB като субстрат. И накрая, срезовете бяха оцветени с хематоксилин и след това анализирани с микроскоп Leica (DM 2500, Leica, Bensheim, Германия).
ELISA анализ
Плазмените нива на TNF-a, IL-1β и LPS в мишките се анализират чрез съответните ELISA комплекти, следвайки инструкциите на производителя. Активността на NF-кВ се изследва, както е описано по-горе [21]. Накратко бяха приготвени ядрени екстракти от чернодробни тъкани на мишки и свързването на p65 с ДНК беше измерено с комплект TransAM NF-κB p65 ELISA, съгласно инструкциите на производителя.
Количествена PCR в реално време
Общата РНК се екстрахира, използвайки реактиви Trizol от тъканите на черния дроб на мишка. Нивата на TNF-α и IL-1β иРНК са количествено определени чрез количествена PCR в реално време, както е описано по-горе [21]. Последователностите на праймерите са показани в Таблица 2. Вътрешният контрол използва GAPDH иРНК.
Уестърн блотинг
Експресията на протеин на TLR4, MyD88, ZO-1, оклудин и ядрен p65 се открива чрез Western blotting. Методите за Western blotting бяха описани по-рано [22]. Накратко, протеини (50 μg) от миши черен дроб и илеални тъкани или ядрени екстракти бяха подложени на 7,5% SDS-PAGE и електротрансферирани в нитроцелулозна мембрана. След това мембраната беше имуноблотирана със специфични антитела (TLR4, MyD88, ZO-1, оклудин, р65) и вторични антитела, конюгирани с хрянова пероксидаза. Контролът на натоварването използва β-актин и LaminB антитяло. Лентите се визуализират с помощта на системата Pierce ™ ECL и плътността на лентата се определя от софтуера Image J (NIH, САЩ).
Статистически анализ
Данните са представени като средна стойност ± стандартна грешка на средната стойност (SEM), всички данни са анализирани с SPSS 25.0 за Windows (SPSS Inc., Чикаго, IL, САЩ). Статистическият анализ беше извършен с помощта на несдвоения t-тест на Student, за да се тества средната стойност на две групи, и еднопосочен дисперсионен анализ (ANOVA), последван от теста на Student-Newman-Keuls, беше приложен за сравнение между множество експериментални групи. Стойност на P
Резултати
Куркуминът потиска индуцираното от HFD наддаване на тегло на тялото и черния дроб
Мишките ApoE -/- са хранени с нормална диета, диета с високо съдържание на мазнини и диета с високо съдържание на мазнини, допълнена с куркумин в продължение на 16 седмици, а групата с нормален режим на хранене се счита за контролна група. Както е показано в таблица 3, мишките с високо съдържание на мазнини, хранени с диета, в сравнение с контролите, значително напълняват, както и значително увеличават теглото на черния дроб. Добавките с куркумин индуцират значително намаляване на наддаването на телесно тегло и теглото на черния дроб, наддаването на телесно тегло и теглото на черния дроб на групата с куркумин е значително по-ниско от това на групата с високо съдържание на мазнини (HF) (P Таблица 3 Биохимични параметри за мишки, оценени в това проучване
Куркуминът подобрява серумния липиден профил при ApoE -/- мишки, хранени с HFD
Както е показано в таблица 3, в сравнение с контролната група, мишките с високо съдържание на мазнини, хранени с диета, показват значително по-високи нива на серумни TC, TG и LDL-C и по-ниско ниво на HDL-C. Лечението с куркумин подобрява дислипидемията, предизвикана от диета с високо съдържание на мазнини, нивата на серумни TC и LDL-C в групата на куркумин са забележително по-ниски от тези в групата с високо съдържание на мазнини (P Фиг. 1
Куркуминът намалява нивата на LPS в серума при ApoE -/- мишки, хранени с HFD
Ендотоксинът LPS, получен от червата, функционира като естествен лиганд на TLR4 и е тясно свързан с чернодробната стеатоза и развитието на NAFLD [6], следователно изследвахме влиянието на куркумина върху нивата на циркулиращ LPS. В сравнение с нормалните мишки, хранени с диета, серумните нива на LPS са драстично повишени при диети, хранени с високо съдържание на мазнини и са обърнати след прилагане на куркумин (фиг. 2).
Куркуминът подобрява чревната пропускливост при ApoE -/- мишки, хранени с HFD
Тъй като намалената експресия на протеини с плътно свързване, като ZO-1 и оклудин, води до повишена чревна пропускливост и LPS транслокация и играе важна роля в патофизиологията на NAFLD [23], ние допълнително определихме влиянието на куркумина върху чревната пропускливост. В сравнение с нормални мишки, хранени с диета, нивата на експресия на протеини на ZO-1 и оклудин в илеалните тъкани бяха значително регулирани при мишки с високо съдържание на мазнини, хранени с диета, но възстановени след прилагане на куркумин (Фиг. 3а). За по-нататъшно оценяване на разрушаването на микроструктурата на илеума, плътните връзки на илеума бяха изследвани с променлив електронен микроскоп (Фиг. 3b). В сравнение с нормалните мишки, хранени с диета, непокътнатите плътни връзки в илеалната тъкан се разширяват при диети, хранени с високо съдържание на мазнини, но се обръщат чрез лечение с куркумин (фиг. 3б и фиг. 3в). Тези резултати предполагат, че куркуминът може да подобри целостта на чревната бариера при диети, хранени с високо съдържание на мазнини.
Куркуминът намалява чернодробната експресия на TLR4 и MyD88 при ApoE -/- мишки, хранени с HFD
Активирането на TLR4 сигнализиране от LPS играе критична роля в развитието на NAFLD [6]. За да се потвърдят ефектите на куркумина върху сигнализирането за TLR4 в черния дроб, бяха проведени имунохистохимични оцветявания и Western blot с анти-TLR4 за оценка на чернодробната експресия на TLR4 и MyD88. В сравнение с нормалните мишки, хранени с диета, имунохистохимичното оцветяване показва, че експресията на TLR4 в черния дроб е значително регулирана при мишки с високо съдържание на мазнини, хранени с диета, и възстановена след прилагане на куркумин (Фиг. 4а). Последователно анализът на Western blot допълнително показва, че повишеното регулиране на експресията на чернодробен TLR4, индуцирано от диета с високо съдържание на мазнини, е обърнато от лечението с куркумин. В допълнение, добавката с куркумин значително намалява нивата на експресия на протеин в чернодробния MyD88 в сравнение с групата с високо съдържание на мазнини (Фиг. 4b).
Куркуминът потиска чернодробната NF-кВ активация при ApoE -/- мишки, хранени с HFD
Стимулирането на TLR4 води до активиране на NF-κB и последваща транскрипция на провъзпалителни гени [11]. За по-нататъшно разбиране на противовъзпалителния ефект и механизма на куркумина бяха изследвани ядрената транслокация и ДНК свързващата активност на NF-κB в черния дроб. В сравнение с контролната група, ядрените протеини от групата с високо съдържание на мазнини демонстрират значително повишена чернодробна NF-κB p65 ядрена транслокация, но възстановени след прилагане на куркумин (Фиг. 5а). Последователно повишената ДНК-свързваща активност на NF-кВ при мишки с високо съдържание на мазнини, хранени с диета, също е намалена чрез лечение с куркумин (Фиг. 5б).
Куркуминът намалява чернодробната експресия на TNF-α и IL-1β при ApoE -/- мишки, хранени с HFD
Доказано е, че TNF-α и IL-1β са важните провъзпалителни цитокини, участващи в развитието на NAFLD и могат да бъдат освободени впоследствие след активиране на TLR4/NF-kB сигнален път [6]. Следователно ние допълнително определихме ефектите на куркумина върху такива цитокини. В сравнение с контролната група, нивата на експресия на иРНК на TNF-α и IL-1β в черния дроб са значително регулирани в групата с високо съдържание на мазнини (Фиг. 6а). Съответно, серумните нива на TNF-α и IL-1β също се повишават чрез диета с високо съдържание на мазнини (фиг. 6б). Добавката на куркумин значително намалява чернодробната експресия на TNF-α и IL-1β и серумните нива на TNF-α и IL-1β, индуцирани от диета с високо съдържание на мазнини.
Дискусия
В настоящото проучване демонстрирахме, че куркуминът ефективно предотвратява индуцирана от HFD чернодробна стеатоза при ApoE -/- мишки. Освен това, нашите резултати показват, че лечението с куркумин значително инхибира индуцираното от HFD натрупване на чернодробна мастна тъкан чрез подобряване на чревната бариерна функция и намаляване на ендотоксина и възпалението на TLR4/NF-κB на черния дроб. Доколкото ни е известно, това е първото проучване in vivo, което разкрива молекулярните механизми на куркумина за предотвратяване на чернодробната стеатоза чрез модулиране на оста на червата и черния дроб.
Безалкохолната мастна чернодробна болест обхваща широк спектър от чернодробни патологии, които варират от проста стеатоза до неалкохолен стеатохепатит. Чернодробната стеатоза е отличителен белег на NAFLD и играе съществена роля в прогресията и патогенезата на NAFLD [4]. Доказано е, че храненето на животни с диета с високо съдържание на мазнини предизвиква затлъстяване, метаболитен синдром и неговата чернодробна проява, чернодробна стеатоза и NAFLD, имитирайки метаболично затлъстелия фенотип на западните страни [14, 15, 24]. В нашето проучване, HFD храненето предизвиква увеличаване на телесното тегло, дислипидемия и натрупване на липиди в черния дроб при мишки. Чернодробната стеатоза е основната хистопатологична находка, както се наблюдава при други проучвания при мишки, хранени с диета с високо съдържание на мазнини [15, 24, 25]. Пероралното добавяне с куркумин при HFD-хранени мишки противодейства на увеличеното чернодробно тегло чрез намаляване на чернодробната стеатоза, получена от намалена плазмена дислипидемия и натрупване на чернодробни триглицериди, което предполага защитен ефект на куркумин върху HFD-индуцирана чернодробна стеатоза и NAFLD.
Въпреки че е известно, че куркуминът оказва положително въздействие върху черния дроб чрез множество механизми, точният механизъм, отговорен за способността му да облекчава чернодробната стеатоза, остава непълно дефиниран. Предишни изследвания вече показват, че куркуминът предотвратява индуцирана от HFD дислипидемия и стеатоза чрез модулаторния си ефект върху чернодробната генна експресия, свързана с липидния метаболизъм, като регулиране на AMPK активиране и медиирана от SREBP липидна биосинтеза [15, 26, 27]. Нашата текуща работа демонстрира нов механизъм на куркумин за предотвратяване на HFD-индуцирана чернодробна стеатоза, т.е.за намалена транслокация на ендотоксин, получена от червата, и чернодробен TLR4/MyD88/NF-kB сигнален път.
Стимулирането на TLR4 от LPS може да взаимодейства с неговите адаптерни молекули MyD88, за да активира NF-κB транскрипционен фактор и след това да индуцира производството на възпалителни цитокини, които стимулират възпалителната реакция и причиняват чернодробната липогенеза и натрупването на липиди. Нашето текущо проучване разкри, че добавката на куркумин значително регулира намаляването на чернодробната експресия на TLR4 и MyD88, намалява p65 ядрената транслокация и NF-κB ДНК свързваща активност, което показва, че куркуминът потиска HFD-индуцираното активиране на TLR4-MyD88/NF-κB сигнализация в черния дроб и след това предотвратява натрупването на мазнини в черния дроб, предизвикано от диета с високо съдържание на мазнини при ApoE -/- мишки. Съобщава се, че куркуминът регулира сигнализирането на TLR4. Например Zhou et al. показа, че модулираната от куркумин поляризация на макрофагите чрез инхибиране на сигналния път на TLR4-MAPK/NF-κB [37]. Wang et al. показа, че куркуминът потиска индуцирания от LPS сепсис при мишки чрез инхибиране на активирането на сигнализиране на TLR4 [38]. Установено е също така, че куркуминът оказва противовъзпалителен ефект върху гладкомускулните клетки на плъхове чрез потискане на ROS-свързания сигнален път TLR4-MAPK/NF-κB [39], които са в съответствие с нашите резултати.
Заключение
В обобщение, ние демонстрирахме в това проучване, че диетичният куркумин е ефективно лечение на HFD-индуцирана чернодробна стеатоза, съвместима с механизъм за модулиране на чревната бариерна функция и свързаното с това активиране на оста на червата и черния дроб. Тази работа разкри нов механизъм, свързан с оста на куркумин в червата и черния дроб за подобряване на чернодробната стеатоза и предложи важно клинично приложение на куркумин за предотвратяване на NAFLD и атеросклеротично увреждане на черния дроб.
- Ефект от добавката на доматен екстракт срещу чернодробни лезии, предизвикани от диета с високо съдържание на мазнини
- Аналогът на куркумин CUR5–8 подобрява безалкохолната мастна чернодробна болест при мишки с високо съдържание на мазнини
- Дневен цикъл в чернодробния липиден метаболизъм при затлъстели мишки, Neotomodon alstoni Различия между половете
- Ефекти от лечението със силденафил върху термогенезата и хомеостазата на глюкозата при индуцирани от диета затлъстели мишки
- Комбинация от заобикаляне на дисекцията на стомаха и вагуса при плъхове със затлъстяване, предизвикани от диета с високо съдържание на мазнини