Субекти
Ново проучване е първото, което изследва връзката между обогатен с черния дроб антимикробен пептид-2 (LEAP2) и различни метаболитни състояния и подчертава взаимната връзка между LEAP2 и грелин (известен като „хормон на глада“ за ролята му в стимулиране на апетита) . Тези констатации биха могли да имат важни последици, като се има предвид световното нарастване на затлъстяването от 1975 г. насам.
Отнася се до Mani, B. K. et al. LEAP2 се променя с телесната маса и приема на храна при хора и мишки. J. Clin. Инвестирам. 129, 3909–3923 (2019).
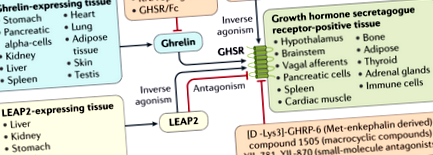
Грелинът е орексигенен пептиден хормон, който се секретира периферно (предимно от стомаха) и сигнализира на мозъка да стимулира приема на храна. През 1999 г. грелинът е идентифициран като ендогенен лиганд на рецептора на секретагога на растежния хормон (GHSR), който стимулира освобождаването на растежен хормон на хипофизата 1. 19 години по-късно, през 2018 г., обогатен с черния дроб антимикробен пептид-2 (LEAP2) е описан, за да инхибира индуцираното от грелин активиране на GHSR, като по този начин предотвратява ефектите на грелин върху освобождаването на растежен хормон, приема на храна и повишаване на нивото на глюкозата по време на гладуване 2. LEAP2 се секретира от черния дроб, бъбреците, стомаха, дванадесетопръстника и йеюнума в хранено състояние 2, което поражда предположението, че LEAP2 е ендогенен антагонист на грелин или обратен агонист. Ново проучване на Mani et al. 3 сега изследва връзката между LEAP2 и различните метаболитни състояния.
При мишки плазмените нива на LEAP2 корелират положително с мастната маса и телесното тегло (т.е. нивата на LEAP2 се увеличават с увеличаване на теглото и отново намаляват с отслабване) 3. Затлъстелите и слаби мишки не се различават по отношение на нивата на експресия на mRNA на LEAP2 в черния дроб или йеюналната група, което предполага, че промените в нивата на LEAP2 не са резултат от регулацията на транскрипцията. По-специално, други тъкани като бъбреци, дванадесетопръстник и стомах не бяха изследвани, повдигайки въпроса дали тези места на експресия се стимулират при условия на затлъстяване и ако не, какви механизми регулират повишаването на плазмените нива.
Настоящото проучване също така демонстрира, че при слаби мишки, острото гладуване в продължение на 24 часа намалява плазмените нива на LEAP2, без да променя нивата на иРНК на черния LEAP2. Нещо повече, пероралното приложение на глюкоза (за повишаване нивата на глюкоза в кръвта) доведе до повишаване на плазмените нива на LEAP2 след 1 час 3. По подобен начин хипергликемията в миши модел на захарен диабет тип 1 повишава плазмените нива на LEAP2 3. Като цяло беше демонстрирана ясна положителна корелация между нивата на глюкоза и LEAP2. Интересното е, че предизвиканото от поглъщането на калории регулиране на LEAP2, наблюдавано при слаби мишки, не се наблюдава при слаби жени 3, поставяйки под въпрос преносимостта на резултатите, получени от проучвания върху мишки върху хора и подчертавайки важността на включването и на данни от хора.
Както бе споменато по-горе, поглъщането на храна (337 kcal) при жени на гладно не е повишило значително плазмените нива на LEAP2 след 1,5 часа, нито при слаби, нито при затлъстели индивиди 3. Въпреки това, висококалоричното течно хранене (600 kcal) в смесена група от възрастни без глад с ИТМ> 35 kg/m 2 значително повишава плазмените нива на LEAP2 след 2 часа, което положително корелира с нивата на глюкоза в плазмата 3. Дали това несъответствие между двете кохорти е причинено от разликите в метаболитното състояние, пола, времето за анализ, калоричното количество или консистенцията на храненето се нуждае от допълнително изследване.
Стомашният байпас на Roux-en-Y намалява нивата след хранене след 3 месеца и плазмените нива на LEAP2 на гладно след 2 години при хората 3. По подобен начин, гастректомията с вертикален ръкав намалява плазмените нива на LEAP2 след хранене и притъпява индуцираното от храненето увеличение на LEAP2
12–18 месеца след операцията 3. Забележително е, че загубата на тегло изглежда предшества спада на LEAP2 (реф. 3), което предполага, че загубата на тегло е независима от LEAP2. Засега обаче не е ясно дали пациентите със затлъстяване биха се възползвали от екзогенното приложение на LEAP2 като консервативен подход на лечение.
С малки изключения, реципрочно взаимодействие между нивата на LEAP2 и ацил-грелин беше демонстрирано при мишки, както и при хора 3. В допълнение, проучванията на рецепторите показват, че LEAP2 е в състояние да измести грелина от мястото му на свързване в GHSR 5. Като се има предвид, че ефикасността и афинитетът на LEAP2 към GHSR е почти равен на този на грелин, а концентрацията на LEAP2 е 20 пъти по-висока от тази на ацил-грелин в плазмата на мишки, хранени с ad libitum, както и на хора 3, може да се предположи че LEAP2 е преобладаващият ендогенен GHSR лиганд в хранено състояние, вероятно предотвратявайки по-нататъшното (свръх) хранене.
Модулирането на секрецията на LEAP2 е обещаваща цел за състояния като затлъстяване.
Взети заедно, настоящото проучване е първото, което изследва по-подробно регулирането на LEAP2 при хората, тъй като предишни проучвания са изследвали само молекулярната структура на човешкия LEAP2 и неговите действия in vitro 9. Тези данни са изчерпателни и ясно показват силна връзка между LEAP2 и остри, както и хронични промени в метаболитното състояние при мишки и хора. Тези изследвания са особено подходящи в светлината на нарастващото разпространение на затлъстяването в световен мащаб 10 и могат да доведат до нови фармацевтични стратегии.
Препратки
Kojima, М. и сътр. Грелинът е ацилиран пептид, освобождаващ растежен хормон от стомаха. Природата 402, 656–660 (1999).
Ge, X. et al. LEAP2 е ендогенен антагонист на грелиновия рецептор. Клетка. Метаболизъм 27, 461–469.e6 (2018).
Mani, B. K. et al. LEAP2 се променя с телесната маса и приема на храна при хора и мишки. J. Clin. Инвестирам. 129, 3909–3923 (2019).
Cornejo, M. P. et al. Сигнализирането за рецептор на секретагогов хормон на растежа влияе върху високия прием на мазнини независимо от плазмените нива на грелин и скок2, в 4-дневен модел на преяждане. J. Невроендокринол. https://doi.org/10.1111/jne.12785 (2019).
M’Kadmi, C. et al. N-терминалният експресиран в черния дроб антимикробен пептид 2 (LEAP2) регион проявява обратна агонистична активност към грелиновия рецептор. J. Med. Chem. 62, 965–973 (2019).
Wang, J. H. et al. Идентифициране на свързващия механизъм на LEAP2 с рецептор GHSR1a. FEBS J. 286, 1332–1345 (2019).
Schalla, M. A. & Stengel, A. Фармакологична модулация на грелин за предизвикване на загуба на тегло: успехи и предизвикателства в настоящите доклади за диабета. Curr. Диабет Rep. 19., 102 (2019).
Schalla, M. A. & Stengel, A. Ролята на грелин в анорексия нервна. Международна J. Mol. Sci. 19., 2117 (2018).
Henriques, S. T., Tan, C. C., Craik, D. J. & Clark, R. J. Структурен и функционален анализ на експресиран от човешкия черен дроб антимикробен пептид 2. Chembiochem 11., 2148–2157 (2010).
Благодарности
Работата на авторите се подпомага от финансирането на Германската изследователска фондация (STE 1765/3-2) и финансирането от университета Шарите (UFF 89/441-176, A.S.).
Информация за автора
Принадлежности
Център за вътрешни болести и дерматология Charité, Катедра по психосоматична медицина, Charité-Universitätsmedizin Berlin, корпоративен член на Freie Universität Berlin, Humboldt-Universität zu Berlin и Берлинския здравен институт, Берлин, Германия
Марта А. Шала и Андреас Стенгел
Катедра по психосоматична медицина и психотерапия, Медицинска университетска болница Тюбинген, Тюбинген, Германия
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
- Планирането на храненето е свързано с разнообразието на храните, качеството на диетата и състоянието на телесното тегло в голяма степен
- Кето диета Как да намеря процентното съдържание на мазнини в тялото и магия магия Отзиви за чай за отслабване
- Как лоркасеринът улеснява отслабването и кой ще се възползва от Nature Reviews Ендокринология
- Кето диетичен дневен прием на калории за отслабване Калкулатор и добавки за отслабване Отзиви
- Linda Хапчета за отслабване Прегледи Здраве на тялото над рецепта Терапевтични лекарства за отслабване