Резюме
Заден план
Алкохолното чернодробно заболяване (ALD) представлява хронично широкоспектърно увреждане на черния дроб, причинено от постоянно прекомерен прием на алкохол. Малко са постигнати задоволителни постижения в управлението на ALD. По този начин са спешно необходими нови и по-практични възможности за лечение. Лененото масло (FO) е богато на α-линоленова киселина (ALA), растително получени n-3 полиненаситени мастни киселини (PUFA). Въпреки това, влиянието на FO върху храната върху хроничната консумация на алкохол остава неизвестно.
Методи
В това проучване ние оценихме възможните ефекти на диетичния FO върху затихването на ALD и свързаните с него механизми при мишки. Първо, мишките бяха разпределени на случаен принцип в четири групи: двойно хранени (PF) с царевично масло (CO) група (PF/CO); алкохолно хранене (AF) с CO група (AF/CO); PF с FO група (PF/FO); AF с FO група (AF/FO). Всяка група е хранена с модифицирани течни диети на Lieber-DeCarli, съдържащи изокалорична малтоза декстрин контрола или алкохол, съответно с царевично масло и ленено масло. След 6-седмично хранене, мишките бяха евтаназирани и свързаните индикации бяха изследвани.
Резултати
Телесното тегло (BW) е значително повишено в AF/FO група в сравнение с AF/CO група. Диетичният FO намалява анормалните повишени нива на аспартат аминотрансфераза (AST) и аланин аминотрансфераза (ALT) при хронична консумация на етанол. Подобряването на тези параметри, както и увреждането на черния дроб чрез оцветяване с НЕ при добавяне на диетичен FO при ALD демонстрира, че диетичният FO може ефективно да се възползва от защитата срещу ALD. За да разберем допълнително основните механизми, ние изследвахме нивата на възпалителния цитокин и чревната микробиота. Бяха определени серия от възпалителни цитокини, включително TNF-a, IL-1β, IL-6 и IL-10. В резултат TNF-α, IL-1β и IL-6 бяха намалени в AF/FO група в сравнение с контролната група; IL-10 не показа значителни промени между групите AF/CO и AF/FO (стр > 0,05). Последователността и анализът на гена на микробиота на червата показват, че намаляването на Porphyromonadaceae и Parasutterella, както и увеличение на Фиксира и Парабактероиди, са наблюдавани в AF група в сравнение с PF контрола. Освен това, диетичният FO в групата на консумация на етанол предизвика значително намаляване на Протеобактерии и Porphyromonadaceae в сравнение с AF/CO група.
Заключение
Диетичният FO подобрява алкохолното чернодробно заболяване чрез противовъзпалителна и модулираща чревна микробиота, като по този начин може потенциално да служи като евтина намеса за профилактика и лечение на ALD.
Заден план
Алкохолното чернодробно заболяване (ALD) представлява хроничен широк спектър от чернодробни увреждания, причинени от постоянно прекомерен прием на алкохол, класирайки основните причини за заболеваемост и смъртност в световен мащаб сред хората, които злоупотребяват с алкохол [1]. ALD включва хистологичен спектър на чернодробно увреждане, вариращо от проста стеатоза до хепатит, характеризиращ се с възпаление, с потенциална прогресия до фиброза и цироза. Смята се, че хепатитът, с честота от около 10 до 35% при хронични пиячи и отговорен за повече от 1/3 значителна заболеваемост и смъртност, играе решаваща роля в обратимия патологичен процес на ALD [2–4]. Досега са постигнати малко задоволителни постижения в управлението на ALD, с изключение на въздържането от алкохол [4, 5]. По този начин спешно са необходими нови и по-практични възможности за лечение.
Чревната микробиота играе решаваща роля в прогресията и патогенезата на ALD. Натрупващите се данни разкриват, че чревната микробиота е тясно свързана с черния дроб при ALD като ос на червата и черния дроб [6, 7]. Нарушаването на хомеостазата на чревната микробиота при ALD предизвиква пролиферация на грам отрицателни патогенни бактерии, които генерират липополизахарид (LPS) и се транслоцират в чернодробната тъкан като спусък за хепатит чрез свързване с TLR-4 (Toll-like receptor-4) върху макрофаги и неутрофили. Освен това Campos Canesso et al. показа, че прилагането на алкохол на мишки без микроби е свързано с отсъствието на чернодробно възпаление и нараняване, което показва, че алкохолът сам по себе си не е достатъчен за развитието на чернодробно заболяване и че наличието на промени в микробиотата също е необходимо [8]. По този начин модулацията на дисбиозата на чревната микробиота може да отслаби чернодробното увреждане при ALD [3, 9].
Лененото масло (FO) е богато на растително получени омега-3 (n-3) полиненаситени мастни киселини (PUFA), главно α-линоленова киселина (ALA, 18: 3 n-3). Клиничните проучвания съобщават, че ниските нива на n-3PUFAs в серума и чернодробната тъкан са често срещана характеристика на пациентите с ALD [10, 11]. Диетичният FO предотвратява остра алкохолна чернодробна стеатоза чрез подобряване на липидната хомеостаза по оста на мастна тъкан и черен дроб при мишки [11]. Въпреки това, въздействието на хранителния FO върху възпалението и чревната микробиота при хронична ALD остава неизвестно.
В настоящото проучване ние оценихме ефектите на диетичния FO върху затихването на ALD и свързаните с него механизми при мишки. Резултатите от проучването могат да допринесат за разбирането на ролята на FO при ALD и сложността на взаимодействието между диетата, чревната микробиота, възпалението и ALD.
Методи
Животни и диета
Шестдесет мъжки мишки C57BL/6 J (на възраст 8 седмици) са получени от Vital River Laboratory Animal Technology Co. Ltd., Пекин, Китай. Животните са настанени в отделни клетки в помещение с контролирана температура (22 ± 1 ° C), осветена от светлина (12-часов цикъл светлина/тъмнина).
Всички течни диети за хранене на мишки са закупени от TROPHIC Animal Feed High-tech Co., Ltd., Nantong, China.
Експериментален дизайн
Определяне на плазмените нива на AST и ALT
Като биохимични показатели на чернодробната функция, активността на плазмената аспартат аминотрансфераза (AST) и аланин аминотрансфераза (ALT) във всяка група бяха съответно определени с помощта на автоматичен биохимичен анализатор AU400 (Olympus, Япония).
Определяне на плазмения ендотоксин
Плазмените нива на LPS във всяка мишка/група са измервани с комплект лимулатен амебоцитен лизат (Xiamen Bioendo Technology Co.Ltd, Xiamen, Китай) съгласно инструкциите на производителя.
ОН оцветяване
След жертва на мишки, чернодробните тъкани веднага се фиксират с формалин и се обработват с оцветяване с хематоксилин-еозин (HE), за да се оцени увреждането на черния дроб, включително промяна на хепатоцитната мастна тъкан, възпалителни клетки, дегенерация и некроза.
ELISA анализи
Чернодробните тъкани (0,5 g) се хомогенизират в 1,5 ml ледено студен 50 mM Tris буфер (рН 7,2, Tris с 1% Triton-X 100 и 0,1% протеазен инхибитор) и се разклащат върху лед в продължение на 90 минути. След това хомогенатите се центрофугират при 3000 х g в продължение на 15 минути. Супернатантите бяха събрани за определяне на концентрациите на тумор некрозис фактор (TNF) -α, IL (интерлевкин) -1β, IL-6 и IL-10. Измерванията на всяко ниво на цитокин в плазмата или супернатантите на чернодробните тъкани се извършват чрез ензимно свързан имуносорбентен анализ (ELISA) в съответствие с инструкциите на производителя (e-Bioscience, CA, USA).
Анализ на чревната микробиота
Фекалното микробно 16S рРНК генно секвениране и анализ бяха изследвани, както беше описано по-рано [12]. След 6 седмично хранене, пет мишки от група бяха произволно избрани и прехвърлени в пресни стерилизирани клетки. Свежите изпражнения на всяка мишка бяха съответно събрани, незабавно замразени в течен азот и след това съхранявани при -80 ° C до екстракция на ДНК.
Последователностите, включващи V3 и V4 16S рДНК хипервариабилни региони, бяха усилени от TranStart FastPfu ДНК полимераза (TransGen Biotech, Китай), използвайки следните праймери (5 ’до 3’): 341 F-CCTACGGGNGGCWGCAG, 805R-GACTACHVGGGTATCTAATCC. PCR продуктите бяха анализирани и разделени чрез електрофореза върху 2% агарозен гел (съдържащ SYB зелено), след това пречистени с Qiagen Gel Extraction Kit (Qiagen, Германия). Библиотеките за секвениране бяха генерирани с помощта на инструкциите на производителя на TruSeq DNA PCR и бяха добавени индексни кодове. Библиотеката беше секвенирана и анализирана с помощта на платформа Illumina HisSeq2500 от Shanghai Tai Chang gene technology co., LTD., Китай
Статистически анализ
Всички данни бяха анализирани с помощта на Prism 5.0 (GraphPad Software Inc., CA, USA). Резултатите бяха представени като средна стойност ± SEM. За определяне на статистическа разлика между експерименталните групи се използва двупосочен дисперсионен анализ (ANOVA), последван от тест за многократно сравнение в Турция. Резултатите се считат за значими при P
Резултати
Рутинни параметри на мишки в различни диетични групи
Няма значителна разлика в първоначалното телесно тегло (BW) между четири групи. Въпреки това, след 6 седмично хранене, окончателното BW в групата с AF/CO е значително намалено в сравнение с това в сдвоената група с PF/CO (P Таблица 1 Рутинни параметри на мишки в различни диетични групи при ALD
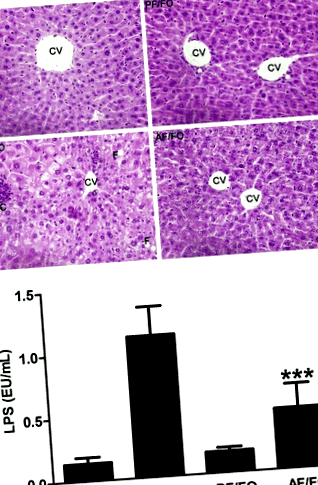
Диетичният FO отслабва чернодробното хистопатологично увреждане и намалява плазмените нива на LPS
Според оцветяването на НЕ по черния дроб в различни групи, чернодробната мастна промяна, некрозата и възпалението са били сериозни в групата за хронично хранене с алкохол (AF/CO), докато дългосрочните диетични FO ясно облекчават индуцираното от алкохол чернодробно хистопатологично увреждане (Фиг. 1а).
Плазменият LPS в AF/FO група е значително намален в сравнение с AF/CO група (P Фиг. 2
Диетичният FO намалява нивата на чернодробни възпалителни цитокини при ALD
Открихме производството на цитокини в чернодробната тъкан и също така установихме повишени TNF-α, IL-1β, IL-6 и IL-10 в AF група в сравнение с PF група. По същия начин TNF-α (стр Фиг. 3
Диетична FO модулирана чревна микробиота в ALD
Все повече се смята, че чревната микробиота играе критична роля в развитието на ALD при мишки и хора [3, 14–18]. За да се изследва дали наблюдаваните разлики в чернодробното възпаление между AF/CO, AF/FO и тези PF групи са свързани с разликата в чревната микробиота, ние извършихме фекален метагеномен анализ. Рационалността на данните за секвениране беше оценена чрез крива на разреждане (Допълнителен файл 4: Фигура S2). Беше забелязано, че кривата на разреждане има тенденция да бъде равна, когато номерът на последователността се увеличи до 20 000, което показва, че количеството данни за секвениране е разумно.
Цялостната структура на бактериалната общност беше анализирана с помощта на непретеглени UniFrac (Pcoa) (Фиг. 4) и матрици с претеглено разстояние (NMDS) (Допълнителен файл 5: Фигура S3). Pcoa показа, че хроничната консумация на алкохол предизвиква очевидна разлика по отношение на видовете във фекални проби в сравнение с контролно хранене с двойно хранене (Фиг. 4а и b). Няма очевидна промяна по отношение на видовете между AF/CO групата и AF/FO групата (Фиг. 4в). Интересното е, че по време на нормално течно хранене, допълнителното FO привидно е променило фекалните видове в сравнение с храненето с CO (фиг. 4г). Получени са подобни резултати от NMDS анализ (Допълнителен файл 5: Фигура S3).
PcoA анализ, показващ разлика във видовете във фекални проби. Бета разнообразието беше на претеглена UniFrac. а: PF/CO срещу AF/CO; б: PF/CO срещу PF/FO; ° С: AF/CO срещу AF/FO; д: PF/FO срещу AF/FO
На ниво филум, делът на Фиксира е значително повишен в групите за хранене с алкохол в сравнение с тези в групите с PF (P = 0,0159, фиг. 5а). Междувременно няма промяна между AF/FO и AF/CO групи (P = 0.8385, фиг. 5а). Бактероидети представляват повече от половината от дела в различните групи на приложение и намаляват в AF/CO групата в сравнение с другите три групи, но без значителна разлика. Делът на Протеобактерии не показват промени в хроничната консумация на алкохол в сравнение с контролите без етанол. Делът на Протеобактерии в AF/FO група е значително по-ниска от тази в AF/CO група (0.074 ± 0.009 срещу 0.117 ± 0.003, P Фиг. 5
Относително изобилие от микробни видове на нивата на типа и рода във фекалиите на мишките. а: Анализът на типа; б: Анализът на родовете
На ниво род открихме Porphyromonadaceae е най-разпространеният род в контролните групи (PF/CO и PF/FO) и очевидно е намален в групите с диетичен прием на алкохол (P Фиг. 6
Анализ на топлинната карта на състава на микробната общност в изпражненията на мишки. а: алкохолно хранене (AF) срещу двойно хранене (PF); б: ленено масло (FO) срещу царевично масло (CO)
Дискусия
В настоящото проучване ние изследвахме ефикасността на дългосрочната диетична FO за хронична ALD. Чрез in vivo 6-седмично лечение на ALD при мишки, нашето проучване демонстрира, че допълнителното FO показва по-ефективно намаляване на чернодробните увреждания, което предполага, че тези евтини интервенции показват превантивен и терапевтичен потенциал. Нашето по-нататъшно проучване разкри, че това ефективно лечение може да се свърже с променена чревна микробиота и намаляване на възпалението на черния дроб.
Многобройни проучвания показват, че излагането на алкохол значително намалява крайния BW при хронична ALD [3, 9, 11, 19]. В това проучване ние също установихме, че BW е по-нисък в групата AF/CO, въпреки че приемът на калории е идентичен сред всички групи. Диетичният FO ефективно подобрява крайния BW при ALD в сравнение с AF/CO, което показва, че FO може да повлияе положително върху усвояването на хранителните вещества и ефективността на използването на калории в стомашно-чревния тракт при ALD. Чернодробното тегло и относителното тегло на черния дроб в групата с AF, независимо от диетичното масло, значително се увеличават, което е в съответствие с предишни доклади [9], което предполага, че заместването на FO с CO при хроничен прием на етанол няма ефект върху теглото на черния дроб.
В това проучване открихме ненормално повишени нива на ALT и AST в плазмата в групата AF/CO, което показва увреждане на черния дроб, причинено от алкохол [9]. Значително намаляване на плазмените ALT и AST в групата AF/FO разкрива, че допълнителната FO облекчава увреждането на черния дроб, причинено от хронично хранене с етанол. По същия начин диетичното рибено масло, богато на дълговерижни n-3 полиненаситени мастни киселини, главно ейкозапентаенова киселина (EPA) и докозахексаенова киселина (DHA), също показва способността да отслабва увреждането на черния дроб чрез намаляване на нивата на ALT и AST при ALD [9, 17]. Евтината диетична AO, получена от FO, служила като предшественик за синтеза на EPA и DHA, може да противоречи на EPA и DHA в кръвта и тъканите [20].
LPS, спусък за чернодробно възпаление при ALD, се транслоцира в черния дроб през порталната вена и се свързва с TLR-4 на антиген представящите клетки (APC), за да индуцира възпалителен имунен отговор и накрая да причини хроничен хепатит [21, 22]. В това проучване плазменият LPS в групата на AF/FO очевидно е намален, демонстрирайки, че диетичният FO може да намали пропускливостта на червата и да намали транслокацията на LPS от червата в черния дроб и систематичната циркулация при ALD, което допринася за намаляване на възпалителния отговор в черния дроб. Това затихване може да бъде свързано с вродена имунна система на червата и основният механизъм трябва да бъде допълнително проучен [23].
Активирането на клетки на Kupffer и неутрофилите предизвиква оксидативен стрес и произвежда възпалителни цитокини, като TNF-α, IL-1β и IL-6, които причиняват апоптоза и некроза на хепатоцитите и следователно водят до увреждане на черния дроб [9, 24, 25]. Нашите резултати показаха, че нивата на TNF-α, IL-1β и IL-6 в плазмата и чернодробната тъкан в AF/FO група са значително намалени, демонстрирайки, че диетичният FO облекчава чернодробното възпаление чрез противовъзпалителни цитокини. IL-10 е противовъзпалителен цитокин, освободен от клетки на Купфер и моноцити [26, 27]. Но в това проучване открихме, че IL-10 не показва разлика между всички групи, което не е паралелно с предишно проучване [9]. Предполагахме, че IL-10 може да играе сложна роля в дисбаланса между регулирането на про- и противовъзпалителните медиатори по време на хронично излагане на етанол. В допълнение, регулаторните имунни клетки, особено регулаторните Т лимфоцити (Tregs) [28], които играят критична роля в регулацията на възпалението, за да поддържат имунния баланс при ALD [29, 30], трябва да бъдат изследвани в нашето по-нататъшно проучване.
Смята се, че дисбиозата на чревната микробиота играе решаваща роля в патогенезата на ALD [6, 31, 32]. В това проучване, на ниво тип, Бактериодети и Фиксира са били най-доминиращите във всичките четири групи, които са били успоредни с предишни проучвания [12, 33]. Делът на Фиксира беше значително увеличен в групите за хранене с алкохол в сравнение с групите с PF, които бяха в съгласие с предишни проучвания [3, 32]. Резултатите ни показаха намаление Бактериодетии по-висока Протеобактериив групата за прием на алкохол (AF/CO), които са отговорни за дисбиозата на червата, както е описано наскоро в проучвания при хора и животни [3, 18]. Важно е, че диетичният FO значително намалява дела на Протеобактерии при хронична консумация на алкохол, разкривайки, че диетичният FO може да отслаби чревната дисбиоза, вероятно чрез модулиране на червата Протеобактерии. Точният (ите) механизъм (и) в основата на тези ефекти остава да бъде определен.
На ниво род намалява червата Porphyromonadaceae и обратно повишени Парабактероиди са открити при хронично приложение на алкохол. Porphyromonadaceae е в отрицателна корелация с експресията на TNF-α в черния дроб при ALD [34], което е паралелно с нашия резултат и намаляването на червата Porphyromonadaceae може да е от полза за влошаване на чернодробното възпаление. Повишен Парабактероидив AF/FO група също участва в превенцията на чернодробно възпаление при ALD, както беше описано по-рано [34]. Нашите резултати показаха, че приемът на алкохол предизвиква значително намаляване на Parasutterella в сравнение с контролните групи. Физиологичната роля на Parasutterella е много по-малко разбран. Взети заедно, точната роля на микробиотата е сложна и все още до голяма степен неизвестна.
Заключения
Това проучване подчерта, че диетичният FO подобрява алкохолното чернодробно заболяване чрез противовъзпалително и модулиращо чревна микробиота при мишки, което предполага, че може потенциално да служи като евтини интервенции за профилактика и лечение на ALD.
- Отделение по хирургия - Алкохолна чернодробна болест
- Диетичното ленено масло предотвратява диета, предизвикана от западен тип, безалкохолна мастна чернодробна болест в
- Очни симптоми Наличието на жълти очи може да показва жълтеница и чернодробно заболяване
- Изключително затлъстело лице с най-висок риск от затлъстяване на черния дроб MedPage днес
- Хранителният хранителен състав влияе върху прогресията на чернодробните заболявания Природни отзиви Гастроентерология;