Свързани термини:
- Т клетки
- Пептид
- Имуноглобулин А
- Вложен ген
- Бактерия
- Секреция (процес)
- Ларва
- Лигавица
- Ламина Проприа
Изтеглете като PDF
За тази страница
Проблеми със здравето на жените и хирургия на Ileal Pouch
Тазова радиация и функция на торбичката
Чревната лигавица, включително лигавицата на тънкото и дебелото черво и илеалната торбичка, са уязвими на радиационно увреждане. Авторовата група демонстрира, че пациентите с лъчева терапия за асоцииран с UC колоректален рак преди изграждането на тазова торбичка могат да развият хроничен антибиотично рефрактерен пухит [80]. Предполагаме, че функцията на торбичката може да бъде повлияна и от лъчева терапия на таза за гинекологични злокачествени заболявания. В допълнение, радиационно асоциираният поухит е труден за лечение [85]. Следователно онкологичните и стомашно-чревни рискове и ползите от лъчетерапията при пациенти с гинекологични злокачествени заболявания трябва да бъдат внимателно балансирани.
Имунитет на лигавицата
Алехо Чорни,. Андреа Черути, в Напредък в имунологията, 2010
1.1 Чревни бактерии
Лечение на диария
Патофизиология на диарията и еволюцията на ORS
Принципи на нанотоксикологията
Ashok K. Singh PhD, в Engineered Nanoparticles, 2016
6.1.2.3 Бариера на чревната лигавица (Фигура 19 (С))
Чревната лигавица ограничава наночастиците до парацелуларния или трансцелуларния път по начин, зависим от размера. Поемането на лигавицата е най-ефективно в диапазона от нанометри и се възпрепятства, когато размерът е над 1 μm. Основната бариера пред парацелуларната дифузия на молекули през чревния епител е зоната на стегнатия възел или zonula occludens. Както е показано на Фигура 19 (С), лигавичната бариера се състои от слузен слой, воден слой, епителни клетки, базална мембрана и капиляри, които ограничават проникването на наночастици от червата до кръвоносните капиляри.
Развитие на асоциирани с червата лимфоидни тъкани
Мелани Флач, Андреас Дифенбах, в Мукозна имунология (четвърто издание), 2015 г.
Чревната лигавица е една от най-големите и най-откритите ни телесни повърхности, като по този начин създава жизненоважна нужда от ефективни имунни реакции. За да се координират тези, лигавичната имунна система включва няколко организирани лимфоидни структури; най-добре проучените са мезентериалните лимфни възли, пластирите на Peyer, криптопачове и изолирани лимфоидни фоликули. Техните изисквания за развитие и времеви рамки се припокриват до известна степен, но се различават значително в много аспекти. Освен това те могат да бъдат повлияни от редица въздействия върху околната среда, като храна или чревна микробиота. В следващата глава ще се опитаме да хвърлим малко светлина върху процесите, които се случват по време на развитието на лимфоидни структури в чревния тракт.
АДАПТАЦИЯ НА ЧРЕВНИ БИОТРАНСФОРМАЦИИ КЪМ ХРАНИТЕЛНА ВАРИАЦИЯ
ВЪВЕДЕНИЕ
В по-ранни проучвания е установено, че хранителният холестерол и мастните киселини, както и промяната в състава на хранителните липиди променят чревния метаболизъм на лекарствата (Hietanen and Laitinen 1977, 1978, Hietanen et al. 1975). Чревният UDP глюкуронозилтрансферазен ензим е чувствителен към модификацията на съдържанието на диетичен протеин (Hietanen and Lang 1978).
Настоящото проучване има за цел допълнително да изследва хранителни фактори, които могат да бъдат от значение за регулирането на чревния метаболизъм на лекарствата. В това отношение беше оценен ефектът от съдържанието на протеини в диетата върху индуцируемостта на монооксигеназните реакции, епоксид хидразата и дейностите на UDP глюкуронозилтрансферазата. Както е известно, че витамините могат да функционират като кофактори за окислителните ензими, влиянието на рибофлавин върху окислителните ензими на лигавицата и активността на UDP глюкуронозилтрансферазата също е оценено чрез модифициране на съдържанието на диетичен рибофлавин.
Ентерични невроимунни взаимодействия
Б Секреторен компонент
Чревната лигавица се инервира от секретомоторни неврони, които имат клетъчните си тела в ганглии на субмукозния плексус. Тези неврони, които имат морфологията на ентериалните неврони от тип I на Dogiel (Bornstein and Furness, 1988), са окончателните общи пътища от интегративните микросхеми на чревната нервна система до секреторните клетки на лигавицата (фиг. 1). Секретомоторните неврони стимулират секрецията чрез освобождаване на невротрансмитерите ацетилхолин или вазоактивен чревен пептид (VIP), които действат върху мускариновите холинергични или VIPergic рецептори върху ентероцитите (Cooke, 1986, 1989).
Активирането на субмукозни секретомоторни неврони предизвиква активна секреция на хлоридни йони от чревната лигавица. Това се потвърждава от експериментална манипулация на реакциите на ток на късо съединение, записани в камерите на потока на Усинг, и чрез измерване на трансмукозното движение на изотопно белязан хлорид (Cooke, 1986, 1989). Въпреки че експерименталните определяния обикновено са ограничени до хлорид, вероятно физиологичният секреторен отговор се състои от натриев хлорид, вода и мукопротеини.
Прилагането на антиген към сенсибилизираното черво, монтирано в камерите на Усинг, води до секреторен отговор, подобен на този, получен при активиране на субмукозни секретомоторни неврони (Perdue and Gall, 1986; Perdue et al., 1990; Baird and Cuthbert, 1987; Harari et al., 1987; Кастро, 1989). Тези отговори се потискат от невронално запушване, което показва, че засичането на антигена води до активиране на нервните механизми, контролиращи секрецията. Както вече беше посочено и както е разработено по-късно в тази глава, се смята, че невронните механизми са отговорни за координацията и ефективното време между подвижността и секреторната активност, тъй като червата реагира на появата на застрашаващ антиген в лумена си.
Серологичната и лигавичната имунологична основа на цьолиакия
На Брандцаг,. Хелге Скот, в Имунофизиология на червата, 1993
1 Производство и транспорт на секреторни имуноглобулини
Чревната лигавица представлява количествено най-важният медиаторен орган на хуморалния имунитет и използва уникални секреторни антитела, както всички останали екзокринни тъкани. Генерирането на секреторни антитела се обяснява отчасти с поразително преобладаване на лигавицата (80–90%) от продуциращи IgA бласти и плазмени клетки при липса на явно възпаление. Обикновено има около 10 10 такива имуноцити на метър човешко тънко черво (Brandtzaeg et al., 1987). Като се вземе предвид общата дължина на червата, груба оценка показва, че около 80% от всички клетки, продуциращи Ig на тялото, са разположени в чревната лигавица (Brandtzaeg et al., 1989a).
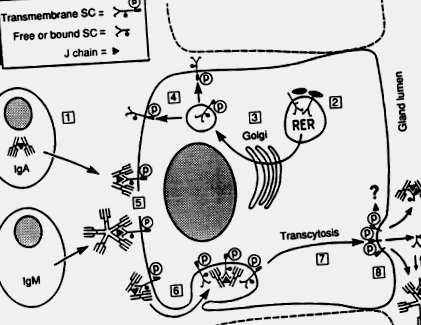
Имуноглобулин А имуноцитите на секреторни места като чревната ламина propria произвеждат предимно димери и по-големи полимери, съдържащи дисулфид-свързан полипептид, наречен „свързваща” или J верига, което редовно се среща и в пентамерния IgM (Brandtzaeg, 1985; Mestecky и McGhee, 1987 ). Полимерният IgA (поли-IgA) се транспортира през жлезист епител заедно с IgM чрез епителен трансмембранен протеин, наречен секреторен компонент (SC) или поли-Ig рецептор (фиг. 1). Човешкият SC принадлежи към семейството на супергени Ig; пълната му cDNA наскоро е клонирана и неговият ген е разположен в дългото рамо на хромозома 1 (Krajči et al., 1991).
Фиг. 1 . Модел за локално генериране на секреторен IgA (SIgA) и секреторен IgM (SIgM). (1) Производство на J-съдържащ поли-IgA и пентамерен IgM от лигавични плазмени клетки. (2) Синтез и гликозилиране на сърцевината (-) на трансмембранния секреторен компонент (SC) или поли-Ig рецептор, в груб ендоплазмен ретикулум (RER) на секреторна епителна клетка. (3) Терминално гликозилиране (•) в комплекс на Голджи. (4) Фосфорилиране (P) в някакъв по-късен етап. (5) Комплексиране на SC с поли-Ig, съдържащ J верига върху базолатералната клетъчна мембрана. (6) Ендоцитоза на комплекси и незаети SC. (7) Трансцитоза на везикули. (8) Разцепване на трансмембранния SC и освобождаване на SIgA, SIgM и излишък на свободен SC. Механизмът на разцепване и съдбата на цитоплазмената опашка на трансмембранния SC са неизвестни (?). По време на външната транслокация редовно настъпва ковалентна стабилизация на IgA-SC комплексите (два дисулфидни моста, посочени в SIgA между SC и една от IgA субединици), докато излишъкът на свободна SC в секрецията служи за стабилизиране на нековалентните IgM-SC комплекси (динамично равновесие, посочено за SIgM).
Адаптиран от Brandtzaeg et al. (1988)
J веригата е от решаващо значение за SC-свързващото място на Ig полимерите (Brandtzaeg, 1985) и следователно представлява ключов фактор за генерирането на секреторни IgA (SIgA) и секреторни IgM (SIgM) антитела. Забележителният SC-зависим епителен транспортен механизъм е отговорен за отделянето в лумена на червата на повече SIgA всеки ден, отколкото общото дневно производство на IgG в организма (Conley and Delacroix, 1987).
Мукозни макрофаги в отбраната и регулирането
Лесли Е. Смитис,. Филип Д. Смит, в Мукозна имунология (четвърто издание), 2015
Резюме
Чревната лигавица съдържа най-големия резервоар от макрофаги в тялото. Чревните макрофаги са получени от циркулиращи кръвни моноцити, които се локализират изключително в ламина проприа, където те губят определени повърхностни антигени и рецептори, включително CD11a – c, CD14 и FcRI-III, но запазват HLA-DR, CD13 и TLR3, 5-9. Липсата на CD11a и b в човешките чревни макрофаги помага да се разграничат тези клетки от чревните миелоидни дендритни клетки. Отличителният фенотип на човешки чревни макрофаги, отразен от отсъствието на CX3CR1, предизвиква пряко сравнение между макрофагите на лигавицата на човека и мишките, базирани на единични общи повърхностни антигени. Резидентните човешки чревни макрофаги са мощно регулирани надолу за производството на регулаторни цитокини като IL-10 и всички възпалителни цитокини (възпалителна анергия) чрез стромално TGF-медиирано Smad сигнализиране и NF-B инактивиране, но запазват мощна фагоцитна и микробицидна активност. По този начин човешките чревни макрофаги изчистват локалните апоптотични клетки и осигуряват защита на гостоприемника срещу микроби, които нарушават епитела по невъзпалителен начин, като по този начин допринасят за лигавичната хомеостаза.
Стомашно-чревна токсикология
10.08.1.4 Метаболизъм на ксенобиотици от лигавица
Чревните лигавични ензими, които метаболизират ксенобиотиците, могат да предотвратят системно усвояване на много потенциално токсични вещества. Например, много пептиди, които биха могли да имат дълбоки биологични ефекти, се метаболизират от лигавичните ензими преди тяхното усвояване. По същия начин много естери се хидролизират чрез взаимодействие с естерази във вилусните епителни клетки. Някои погълнати алкохол се метаболизират от стомашна алкохолна дехидрогеназа, присъстваща в стомашната лигавица, преди системно усвояване на алкохола. Докато метаболизмът в стомашната лигавица вероятно допринася малко за общия алкохолен метаболизъм, известно е, че активността на стомашния алкохол дехидрогеназа се влияе от наркотици и от хронична консумация на алкохол (Julkunen et al. 1985).
Както бе споменато по-горе, метаболизмът на ксенобиотиците може да се осъществи от луминални микроорганизми и освен това луминалните организми могат да повлияят ензимната активност на лигавицата. Факторите, влияещи върху метаболитната активност на чревната микрофлора, трябва да се вземат предвид при проучвания на биотрансформацията на погълнати през устата ксенобиотици (Rowland 1988). Например, съществуват значителни разлики в микробния състав и метаболизма на чревната флора на различни видове животни. Микробната популация може да бъде засегната от възрастта и е вероятно да се различава особено в много млада и много напреднала възраст. Факторите на околната среда, като лекарства (особено антибиотици), диета и ксенобиотици могат да модифицират микробния метаболизъм и по този начин токсичността на чужди съединения.
- Liver Fluke - общ преглед на ScienceDirect теми
- Кефир - общ преглед на ScienceDirect теми
- Твърди изпражнения - преглед на ScienceDirect теми
- Чернодробна поликистозна болест - общ преглед на ScienceDirect теми
- Инсулинова резистентност - общ преглед на ScienceDirect теми