Механизми на прогресия при безалкохолна мастна чернодробна болест
Катедра по медицина, Университет на Кънектикът, Фармингтън, CT, САЩ
Въведение
Безалкохолната мастна чернодробна болест (NAFLD) е нарастваща загриженост за общественото здраве в САЩ (САЩ). Две трети от населението на САЩ са с наднормено тегло или затлъстяване и приблизително 80% от пациентите със затлъстяване имат NAFLD [1]. Разпространението на NAFLD се изчислява на 31% през 2011-2012 г. [2] и продължава да се увеличава след нарастващата тенденция на затлъстяването. Голямо проучване по въпросите на ветераните разкри, че разпространението на NAFLD повече от два пъти от 80 на 161 на 100 000 от 2001 до 2013 г. [3].
NAFLD е континуум на заболяването, вариращ от доброкачествена чернодробна стеатоза до неалкохолен стеатохепатит (NASH) до фиброза и цироза. Не всички чернодробни стеатози ще прогресират до NASH или след него. Проучванията показват, че само 43-44% от пациентите със стеатоза са прогресирали до NASH, а 7-30% от пациентите с NASH са прогресирали до цироза [1,4–7]. Общият риск от чернодробна стеатоза да прогресира до цироза се оценява на 1-2% [8]. Към днешна дата механизмът на прогресия при NAFLD не е добре разбран. Този преглед има за цел да обсъди няколко предложени механизма за развитие на NASH и свързана с NASH цироза.
Механизми на прогресия
Най-широко приетата теория в патогенезата на NAFLD е описана чрез двустранен модел. Първият „удар“ е инфилтрацията на хепатотоксични свободни мастни киселини (FFA) в черния дроб, което го прави уязвим за втори удар. Чернодробната липотоксичност е резултат от генерирането на токсични липидни метаболити от FFA, като керамиди, диацилглицероли, лизофосфатидил холин и окислени метаболити на холестерола [2]. Метаболитите действат като реактивни кислородни форми (ROS), които налагат оксидативен стрес върху хепатоцитите [3]. Оксидативният стрес засяга главно митохондриите и ендоплазмения ретикулум и допринася за дисфункция на хепатоцитите [9]. Вторият „удар“ може да бъде произволен брой обиди, вариращи от нарушена митохондриална функция, лекарствена токсичност, претоварване с желязо, исхемия, нарушена адипокинова активност или други възпалителни увреждания [2,8].
Смята се, че чревният микробиом има известна роля в патогенезата на NAFLD. Точният принос е неясен, но има няколко възможни влияния. Първо, чревната флора може да промени метаболизма на жлъчните киселини, което може да повлияе на обработката на липиди и отлагането на мазнини в черния дроб [10].
Чревната флора може също да произвежда метаболити и/или ендотоксини, които могат да бъдат хепатотоксични и да осигурят „второто попадение“ в двуударния модел [10]. Микробиомът също така променя имунитета на гостоприемника, което може да допринесе за възпаление [10]. Чревните бактерии могат да освободят свързани с патогени молекулни модели (PAMPs) за свързани с увреждане молекулярни модели (DAMPs), които действат върху тол-подобни рецептори (TLR), за да стимулират възпалителния отговор [11].
FFA също взаимодействат със звуковия таралеж от лиганд (SHH), който играе ключова роля в чернодробната регенерация чрез набиране на възпалителни медиатори на мястото, за да изчисти остатъците от увредените клетки. SHH се освобождава от балонирани дегенерирани хепатоцити като сигнал за клетъчна регенерация [12]. При мастна инфилтрация и увреждане на хепатоцитите, SHH се регулира нагоре и активира чернодробни звездни клетки, синусоидални ендотелни клетки и други възпалителни клетки [12]. Тези клетки от своя страна освобождават провъзпалителни цитокини и други фиброгенни медиатори, които допринасят за възпалението и фиброзата.
Възпалителните цитокини са от решаващо значение за развитието на стеатохепатит. Настоящата литература цитира няколко специфични цитокини, които имат роля, включително TNF-a, IL-6, IL-1β, IL-17 и IL-18 [2,8,11]. JNK-1 е киназа, участваща в сигналната каскада за апоптоза и възпалителен отговор. При наличие на излишна мастна тъкан и инсулинова резистентност, активирането на пътя JNK-1 увеличава нивата на циркулация на тези възпалителни цитокини [2]. Освен това, мастната инфилтрация в черния дроб повишава TGFβ. В условията на възпаление чернодробните звездни клетки се активират от TGFβ и секретират извънклетъчен матрикс, което в крайна сметка причинява чернодробна фиброза [2].
Адипонектинът е адипокин с противовъзпалителна и антифиброгенна активност, който предпазва чернодробния паренхим срещу стеатоза и апоптоза [10]. При пациенти със затлъстяване нивата на адипонектин са намалени. Изследване при мишки показва намалено сигнализиране за чернодробен адипонектин в черния дроб на мишки NASH в сравнение с мишки с доброкачествена чернодробна стеатоза [13]. Въпреки че подобни проучвания все още не са провеждани при хора, данните върху животни показват, че липсата на адипонектин играе роля в развитието на NASH.
Генетичните фактори, факторите на околната среда и начина на живот вероятно ще окажат някакво влияние върху прогресирането на мастната чернодробна болест. Те обаче все още не са добре проучени. Някои гени, включително пататин-подобен фосфолипазен домейн, съдържащ 3 (PNPLA3), трансмембрана 6 суперсемейство 2 (TM6SF2) и глюкокиназен регулаторен протеин (GCKR), са замесени като предразполагащи фактори при прогресирането на NAFLD към NASH [10,12].
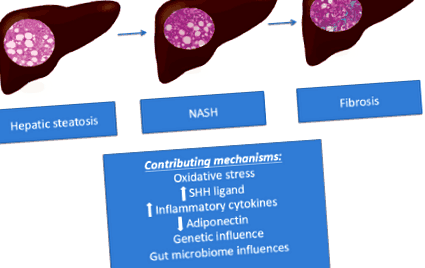
Фигура 1 изобразява хистологичната прогресия на NAFLD и обобщава потенциалния механизъм, който допринася за прогресирането на заболяването.
Фигура 1 Напредъкът на NAFLD и допринасящите механизми
Заключение
С нарастващото си разпространение NAFLD в момента е втората водеща индикация за чернодробна трансплантация в САЩ и се очаква скоро да надвиши HCV като водеща причина. Ключът към обръщането на тази тенденция е предотвратяването на прогресирането на NAFLD към NASH и NASH цироза. Първо трябва да имаме ясно разбиране на механизмите, които са в основата на прогресията. Въпреки че има много предложени механизми, допринасящи за напредъка на NAFLD, са необходими допълнителни изследвания, за да се разбере как всеки от описаните по-горе механизми се вписва в цялостната патогенеза. Това може също така да позволи възможностите за нови интервенции, като използване на антиоксиданти, противовъзпалителни средства или агенти, които медиират адипокини, да спрат развитието на заболяването.
Препратки
- Satapathy SK, Sanyal AJ (2015) Епидемиология и естествена история на безалкохолната мастна чернодробна болест. Semin Liver Dis 35: 221-235. [Crossref]
- Peverill W, Powell LW2 Skoien R (2014) Развиващи се концепции в патогенезата на NASH: отвъд стеатозата и възпалението. Int J Mol Sci 15: 8591-8638. [Crossref]
- Beste LA, Leipertz SL, Green PK, Dominitz JA, Ross D, et al. (2015) Тенденции в тежестта на цироза и хепатоцелуларен карцином от основно чернодробно заболяване при американски ветерани, 2001-2013. Гастроентерология 149: 1471-1482. [Crossref]
- Golabi P, Sayiner M, Fazel Y, Koenig A, Henry L, et al. (2016) Текущи усложнения и предизвикателства при скрининг и диагностика на неалкохолен стеатохепатит. Експерт Rev Gastroenterol Hepatol 10: 63-71. [Crossref]
- Traussnigg S, Kienbacher C, Halilbasic E, Rechling C, Kazemi-Shirazi L, et al. (2015) Предизвикателства и управление на чернодробната цироза: Практически въпроси при терапията на пациенти с цироза поради NAFLD и NASH. Dig Dis 33: 598-607. [Crossref]
- Singh S, Allen AM, Wang Z, Prokop LJ, Murad MH, et al. (2015) Прогресия на фиброзата при неалкохолен мастен черен дроб спрямо неалкохолен стеатохепатит: системен преглед и мета-анализ на проучвания с двойна биопсия. Clin Gastroenterol Hepatol 13: 643-654. [Crossref]
- McPherson S, Hardy T, Henderson E, Burt AD, Day CP, et al. (2015) Доказателства за прогресия на NAFLD от стеатоза до фиброзиращ стеатохепатит при използване на сдвоени биопсии: последици за прогнозата и клиничното управление. J Hepatol 62: 1148-1155. [Crossref]
- Hassan K, Bhalla V, El Regal ME, A-Kader HH (2014) Безалкохолна мастна чернодробна болест: изчерпателен преглед на нарастващата епидемия. World J Gastro 20: 12081-12101. [Crossref]
- Ashraf NU, Sheikh TA (2015) Стрес на ендоплазмения ретикулум и оксидативен стрес в патогенезата на неалкохолната мастна чернодробна болест. Безплатен Radic Res 49: 1405-1418. [Crossref]
- Caligiuri A, Gentilini A, Marra F (2016) Молекулярна патогенеза на NASH. Int J Mol Sci 17. [Crossref]
- Takaki A, Kawaku D, Yamamoto K (2014) Молекулярни механизми и нови стратегии за лечение на безалкохолен стеатохепатит (NASH). Int J Mol Sci 15: 7352-7379. [Crossref]
- Machado MV, Diehl AM (2016) Патогенеза на неалкохолен стеатохепатит. Гастроентерология 150: 1769-1777. [Crossref]
- Handa P, Maliken BD, Nelson JE, Morgan-Stevenson V, Messner DJ, et al. (2014) Намалената адипонектинова сигнализация поради увеличаване на теглото води до неалкохолен стеатохепатит чрез нарушена биогенеза на митохондриите. Хепатология 60: 133-145. [Crossref]
Редакционна информация
Главен редактор
Марсел CC Мачадо
Бразилски университет
- Хепатопротективен ефект на формулата Jianpi Huoxue върху безалкохолната мастна чернодробна болест, предизвикана от
- Билкови лекарства, използвани за лечение на безалкохолни мастни чернодробни заболявания Мини-преглед Nikkhajoei
- Хепатопротективен ефект на инхибитора SGLT2 върху безалкохолната мастна чернодробна болест
- Хипертония и безалкохолна мастна чернодробна болест, доказана с преходна еластография - Wang - 2016
- Слабите американци с безалкохолна мастна чернодробна болест имат по-ниски нива на цироза