Мечислав Литвин
Отдел по нефрология и артериална хипертония, Детски мемориален здравен институт, Варшава, Полша
Анна Нимирска
Отдел по нефрология и артериална хипертония, Детски мемориален здравен институт, Варшава, Полша
Резюме
Въведение
маса 1
Определения на метаболитен синдром, издадени от Групата за лечение на възрастни (ATP) и Международната федерация по диабет (IDF)
| Централно затлъстяване (дефинирано като обиколка на талията със специфични за етническата принадлежност ценности) | Поне три от следните: | |
| И всякакви две от следните: | ||
| • Триглицериди:> 150 mg/dl (1,7 mmol/l) или специфично лечение за тази липидна аномалия | • Централно затлъстяване: обиколка на талията ≥ 102 см или 40 инча (мъже), ≥ 88 см или 36 инча (жени) | |
| • HDL холестерол: 130 или диастоличен BP> 85 mmHg, или лечение на предварително диагностицирана хипертония | • Дислипидемия: HDL-C 100 mg/dl (5,6 mmol/l) или предварително диагностициран диабет тип 2 | • Кръвно налягане ≥ 130/85 mmHg |
| • Плазмена глюкоза на гладно ≥ 6,1 mmol/l (110 mg/dl) | ||
| Ако FPG е> 5,6 mmol/l или 100 mg/dl, силно се препоръчва орален глюкозен толеранс, но не е необходимо да се определя наличието на синдрома | ||
| Ако ИТМ е> 30 kg/m 2, може да се приеме централно затлъстяване и не е необходимо да се измерва обиколката на талията |
HDL липопротеин с висока плътност; АН кръвно налягане; ИТМ индекс на телесна маса
Таблица 2
Дефиниция на метаболитен синдром при деца - критерии на IDF
| 6 до 16 | Използвайте съществуващите критерии за IDF за възрастни: | ||||
| Централно затлъстяване (определено като обиколка на талията ≥ 94 cm за мъжете Europid и ≥ 80 cm за жените Europid, със специфични стойности за етническата принадлежност за други групи) | |||||
| плюс всеки два от следните четири фактора: | |||||
| • повишени триглицериди: ≥ 1,7 mmol/l | |||||
| намален HDL-холестерол: 1). Процесът е дифузен и засяга цялото артериално дърво. Основният рисков фактор за уремична артериопатия е ниската скорост на гломерулна филтрация (GFR) с последици от нея като вторичен хиперпаратиреоидизъм, водещ до нарушения на калциевата и фосфатната хомеостаза. Решаващата стъпка в патогенезата на уремичната артериопатия е процесът на диференциация на съдовите гладкомускулни клетки в медиалния слой на артериалната стена в остеобластоподобни клетки [35–38]. Артериопатията се ускорява с началото на диализата и се увеличава с възрастта [38, 39]. Експериментални проучвания показват, че атерогенната диета причинява хиперлипидемия както при субтотално нефректомизирани, така и при фалшиво оперирани плъхове, но е по-изразена при уремични плъхове. Въпреки това, въпреки хиперлипидемията с повишаване на концентрациите на VLDL и LDL холестерол, концентрациите на липиди не се повишават в артериалните стени на уремични плъхове [40]. Сравнение на коронарните артерии на пациенти, починали с нормална бъбречна функция и артериите на диализирани пациенти, показва, че уремичните пациенти имат по-голяма дебелина на медиалния слой на коронарните артерии. Освен това лезиите при уремични пациенти се характеризират с наличието на калцирани плаки и по-малък брой плаки с извънклетъчни липидни отлагания [41]. Аортите на уремичните пациенти също имат по-голямо съдържание на калций и фосфор и по-голяма експресия на маркери за трансформация на остеобластния фенотип дори в не-калцирани области, отколкото аортите на не-уремични пациенти. Това беше придружено от по-малко отлагане на фетуин А в уремичните аорти, което показва, че системата от естествени инхибитори на калцифилаксията участва в патогенезата на уремичната артериопатия [42]. При деца с уремична артериопатия, увеличена дебелина на сънната интимна среда (cIMT) и скованост на общата каротидна артерия, корелиращи с намаляващата GFR [35]. Въпреки че ниският HDL-холестерол, апопротеините А и В корелират с cIMT, нито един от тези фактори не е намерен като независим предиктор на IMT. | |||||
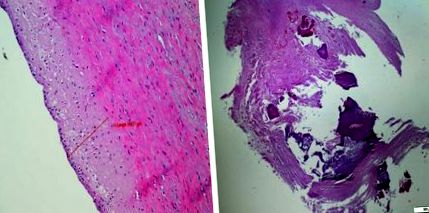
Лява уремична артериопатия. Аортна стена на 20-годишно момче, диализирана в продължение на 8 години. Удебеляване на средата на аортната стена. Нормален ендотел. Дясна атеросклероза на бъбречна артерия при 60-годишен мъж (с любезното съдействие на д-р W. Grajkowska)
Основата за развитие на уремична кардиомиопатия е дифузна интермиокардиоцитна фиброза (фиг. 2). Основните рискови фактори за уремична кардиомиопатия са същите като за уремичната артериопатия, а както уремичната артериопатия, така и кардиомиопатията са преувеличени от традиционните рискови фактори за СС и ускоряват в стадий 5 на ХБН [43].
Ляв нормален миокард. Дясна биопсия на миокарда на 13-годишно момиче, диализирана в продължение на 5 години. Хипертрофия на миокардиоцитите (стрелки). Дифузна интермиокардиоцитна фиброза (двойни стрелки) и стеатоза. Количество на съединителната тъкан - 3% (нормално 1%) (с любезното съдействие на д-р W. Grajkowska)
Различните патологични основи на сърдечно-съдови усложнения, причинени от уремия, и тези, причинени от метаболитни аномалии, типични за МС, водещи до атеросклероза, обясняват несъответстващите резултати от лечението с антиатеросклеротични лекарства по отношение на стадия на ХБН.
Разпространението на метаболитния синдром сред деца и юноши.
Използвайки дефиницията на IDF, данните от Националното проучване на здравето и храненето на САЩ от 1999-2004 г. показват, че сред подрастващите на възраст 12-17 години, разпространението на МС е 4,5%. Той се е увеличил от 1,2% на 12 години до 7,1% на 16-17 години [44]. В Европейското младежко сърдечно проучване разпространението на МС, определено според IDF, е 0,2% при 10-годишни и 1,4% при 14-годишни деца [45]. Подобни данни за разпространението на МС сред 10-годишни деца са съобщени в Гърция [46]. В Полша разпространението на МС сред юноши от градско население варира от 1,4 до 2,2%, но сред децата с РН е десет пъти по-високо от общото население и варира от 15 до 20% [6, 8].
Разпространението на метаболитни аномалии и метаболитен синдром при ХБН
Метаболитни аномалии, промени в телесния състав с неуспех в растежа, намаляване на LBM и увеличаване на висцералната мастна тъкан корелират с намаляването на GFR. Съществуват обаче сравнително оскъдни данни за разпространението на МС при деца с ХБН. Децата с ХБН са по-ниски и тежат относително повече от здравите деца, което е видно от стадий 3 ХБН [47–49]. Този ефект сега се модулира от промените в околната среда и начина на живот и се съобщава, че в днешно време децата с ХБН са с наднормено тегло повече от преди две десетилетия [50, 51]. Дислипидемията и непоносимостта към глюкоза са типични метаболитни аномалии на ХБН. Докладите от проучването CKID показват, че най-типичната аномалия при деца с ХБН етап 2–4 е хипертриглицеридемия [52]. Изчислено е, че на всеки 10 ml/min/1,73 m 2 намалението на GFR е свързано с повишаване на серумната концентрация на TTG с 8%, повишаване на концентрацията на LDL холестерол с 2% и намаляване на концентрацията на HDL холестерол с 3% . Протеинурията е свързана с тези аномалии и те се появяват при деца с нефротична протеинурия два пъти по-често в сравнение с непротеинурични деца.
Метаболитен синдром при деца след бъбречна трансплантация
Нормализирането на метаболитни аномалии, причинени от уремия и дори известно обръщане на уремичните артериални и сърдечни увреждания след Rtx, зависи от GFR на трансплантирания бъбрек [57, 58]. Въпреки това, имуносупресивната терапия за предотвратяване на отхвърляне на органи също причинява значителни метаболитни аномалии като атеросклеротична дислипидемия, IR и риск от нововъзникващ диабет след трансплантация (NODAT). Тези аномалии, типични за МС, са придружени от висцерално затлъстяване и намаляване на LBM. Следователно полученото зависи от GFR и страничните ефекти на имуносупресивните лекарства.
Средното разпространение на МС при възрастни след Rtx е приблизително 60–70%. Затлъстяването е основният рисков фактор за развитието на МС след Rtx и МС увеличава СС риск [59, 60]. Средните резултати от педиатрични проучвания показват, че разпространението на МС значително се увеличава след Rtx и е по-високо в сравнение с общата популация и при диализирани деца. Wilson et al. съобщава, че разпространението на МС при деца 1 година след Rtx е 37,6% и две трети от тях развиват МС de novo [61]. Höcker et al. установи, че разпространението на МС след Rtx зависи от времето от Rtx и употребата на кортикостероиди (CS) и варира от 40% през първите месеци след Rtx до 20% след 2 години [62].
Деца след Rtx, които са имали МС, също са имали по-голяма маса на лявата камера и хипертрофия на лявата камера се е развила при 55% от тях в сравнение с 32% без МС [61]. Ексцентричната хипертрофия на лявата камера, характерна за затлъстяването и МС, е установена при 34% от децата с МС, в сравнение с 15% при деца без МС.
МС след Rtx се свързва с по-ниски нива на оцеляване на присадката [63, 64]. Мадуран и др. съобщава, че независимо от употребата на CS, децата, които са имали МС, също са имали значително по-нисък GFR [65].
CS играят решаваща роля в патогенезата на МС след Rtx. Höcker et al. показа, че при пациенти, при които кортикостероидите са оттеглени, разпространението на МС е спаднало до 5% след 1 година [62]. По същия начин излагането на фактори на МС значително намалява в тази група в сравнение с децата, при които лечението с CS е продължило. Използването на по-големи дози CS е производно на епизодите на HLA съвпадение и отхвърляне. Установено е, че разпространението на МС е три пъти по-ниско сред получателите на живи донорски присадки, отколкото сред получателите на трупни донорски присадки [66].
Най-тежкото метаболитно усложнение на CS след Rtx е NODAT. Изглежда, че първото описание на NODAT след Rtx е дадено от Starzl през 1964 г. [67]. Въпреки че употребата на азатиоприн също е свързана с увреждане на панкреаса, изглежда разпространението на NODAT се е увеличило значително с въвеждането на инхибитори на калциневрин (CNI) в средата на осемдесетте години на XX век [68]. Циклоспоринът (CSA) и особено такролимусът (TAC) имат потенциал да повредят директно β клетките на панкреаса [69]. Сравнението на данните в регистъра от последните три десетилетия предполага, че разпространението на NODAT се е увеличило от под 10% през 80-те години на 20-30% през последното десетилетие [70]. Анализът на американската система за бъбречни данни показа, че разпространението на NODAT при трансплантирани деца се е увеличило от 2-3% в края на 80-те години на миналия век до 7,5% [71]. Докладът NAPRTSC показва повишено разпространение на NODAT при деца след Rtx, но промяната представя само статистическа тенденция [72]. Въпреки това и двата доклада показват тенденцията за повишено разпространение на NODAT при трансплантирани деца през последните десетилетия.
Патогенезата на NODAT е многофакторна и всички рискови фактори за диабет, включително CS и CNI, играят роля. ОДУ е по-силен рисков фактор за NODAT от CSA [72]. Рисковите фактори за NODAT обаче действат вече по време на диализния период и включват перитонеална диализа и затлъстяване [73]. Другият рисков фактор е хипергликемията по време на следоперативния период [74]. Перитонеалната диализа, наднорменото тегло, употребата на CNI и посттрансплантационната хипергликемия изглежда са рискови фактори за NODAT.
Метаболитен синдром като рисков фактор за ХБН при деца
Закъснението във времето между излагане на метаболитни аномалии и увреждане на бъбреците обяснява, че първите аномалии са само заместващи маркери на прогресивна ХБН. Установено е, че при затлъстели деца и деца с безалкохолна мастна чернодробна болест излагането на критерии на МС нарушава глюкозния толеранс и IR корелира с микроалбуминурия и хиперфилтрация [82–84]. Kolouridis et al. установи, че излагането на критериите на МС корелира положително с GFR. GFR обаче намалява, когато децата са изложени на повече от четири критерии за MS [85]. Проспективно проучване на юноши и млади хора (средна възраст 18 години) установи, че наднорменото тегло, хипертонията и ниската концентрация на HDL холестерол увеличават вероятността от хиперфилтрация 6,6 пъти. Нещо повече, високият метаболитен риск корелира с хиперфилтрацията и предшества развитието на явна нефропатия [86]. Общото заключение е, че първата аномалия, наблюдавана при деца с МС, е хиперфилтрация и албуминурията се развива на по-късни етапи, последвана от намаляване на GFR.
Въпреки че патогенезата на прогресиращото бъбречно увреждане, свързано с МС, е многофакторна, тя поне отчасти се обяснява с явления, наблюдавани при гломерулопатия, свързана със затлъстяването (ORG). Първият доклад за връзката между затлъстяването и увреждането на бъбреците идва от Preble, който съобщава през 1923 г., че затлъстяването е свързано с протеинурия [87]. Въпреки това, Weisinger et al. за първи път е описано както клинично протичане, така и находки от биопсия в бъбреци на четирима затлъстели възрастни, които са имали МС и нефротична протеинурия [88]. Протеинурията намалява със загуба на тегло, но при пациенти, които отново напълняват протеинурия се появява отново. Сърдечната катетеризация установи повишено дясно предсърдно налягане. Бъбречните биопсии разкриват сегментарна склероза.
- Успешни планове за хранене с хронична бъбречна болест Щаб на менюто за бъбречна диета
- Резултати от бъбречната функция и рискови фактори за рискови фактори за етап 3В хронично бъбречно заболяване след
- Следоперативно остро бъбречно увреждане Фокус върху дефинициите за възстановяване на бъбреците, прогресия на бъбречната болест
- Бъбречна храна за котки с бъбречна болест Само натурален домашен любимец
- Калиева хомеостаза, хронична бъбречна болест и обогатена с растения диета Американско общество на