Резюме
запасите от липидни мускули представляват важен енергиен източник за мускулните функции [напр. по време на продължително мускулно упражнение (18, 35) или по време на гладуване (17)]. В допълнение, нивото на липидите в мускулите е станало от значителен интерес за индустрията на селскостопански животни, тъй като силно влияе върху качеството на месото по отношение на неговата хранителна стойност и сензорни свойства (1, 36, 44). Понастоящем диетичните манипулации и генетичният подбор са основните инструменти, използвани за управление на съдържанието на мускулна мазнина в селскостопанските животни. Приемът на енергия и генетичните фактори също имат голямо влияние върху затлъстяването при хората (30).
Увеличаването на хранителните запаси насърчава отлагането на мазнини в цялото тяло, включително мускулите при повечето риби (1, 36), както и при други селскостопански животни (11, 45). Салмонидите имат висока способност да съхраняват мазнини в мускулите и показват широк спектър от вариации на съдържанието на липиди в мускулите при диетични манипулации, от 3% до цели 18% (12, 36, 8), като по този начин правят сьомгите особено подходящи видове, при които за изучаване на механизмите, свързани с отлагането и мобилизирането на мускулни мазнини.
Експериментална риба и диети
Двете линии на дъговата пъстърва, проектирани като L (чиста мускулна линия) и F (мастна мускулна линия), са получени след три поколения дивергентна селекция за високо или ниско съдържание на мускулни мазнини, използвайки неразрушаващ метод (Distell Fish Fatmeter). Процесът на подбор е подробно описан от Quillet et al. (32). Рибите се отглеждат в експерименталните съоръжения на Institut National de la Recherche Agronomique (INRA) (PEIMA, Drennec, Sizun, Finistère, Франция) при постоянна температура на водата от 11,5 ± 0,5 ° C. Експериментът е проведен след Насоки на националното законодателство за грижата за животните на френското министерство на научните изследвания.
Две експериментални диети, проектирани като LE (нискоенергийна диета) и HE (високоенергийна диета), са формулирани от INRA и произведени от производител на фуражи като екструдирани пелети. Те бяха направени от същата смес на основата на рибено брашно. Около 15% рибено масло е добавено към HE диетата, за да предизвика голяма разлика в съдържанието на липиди между двете диети. Диетата LE съдържа 9,8% липиди, осигурени от рибно брашно, докато HE диетата съдържа 23% липиди (Таблица 1), което е близо до най-високите стойности на масленост в търговските диети за млада дъгова пъстърва. Увеличението на диетичното съдържание на сурови мазнини е придружено от намаляване на пропорциите на протеини и нишесте в диетата с високо съдържание и повишено съотношение н-3 /н-6 полиненаситени мастни киселини (Таблица 1).
маса 1. Приблизителен състав на експерименталните диети
LE, нискоенергийна диета; НЕ, високоенергийна диета; DM, сухо вещество; FA, мастни киселини.
Проба за хранене
Точно преди първото време за хранене, рибите от всяка линия бяха разпределени в шест резервоара от 500 животни (средно телесно тегло: 0,16 g). Трикратни групи от всеки генотип бяха хранени или с LE, или с HE диета за 6 месеца. През първите 4 месеца храната беше разпределена в излишък, за да се гарантира, че предлагането на храна не е ограничаващо. От петия месец размерът на хранителните гранули беше достатъчно висок, за да позволи събирането на неизядена храна. Рибите се претеглят на групи на всеки 2 седмици и се броят, за да се изчисли средното телесно тегло. Приемът на фураж се записва ежедневно през последните 2 месеца от опита и ефективността на фуража се изчислява за периода от 2 месеца.
Процедура за вземане на проби
За да се проучи дългосрочният ефект от диетичното лечение, а не ефектът от тестовото хранене, от пробите се вземат проби 24 часа след храненето, за да се гарантира, че храносмилането и транзитът са завършени. Това време след хранене не съответства на гладно състояние, тъй като при пъстървите, както и при други екзотермични животни, базовите метаболитни нива се достигат по-късно, отколкото при бозайниците. Това се дължи на по-бавен транзит и по-дълго време за изпразване на стомаха при ниска температура в сравнение с това при ендотермични животни. В началото на „периода на измерване на приема на фураж“ (5-ти месец) и в края (6-ия месец) бяха взети проби от десет риби на резервоар. Те бяха обединени в резервоар, смляни и лиофилизирани, преди да бъдат анализирани за съдържание на протеини и мазнини в цялото тяло.
В края на 6-месечното изпитване за хранене, всички риби бяха анестезирани с 2-феноксиетанол в препоръчителната доза за хирургични процедури (0,2 ml/l) 24 часа след хранене. Те бяха измервани индивидуално за тегло и дължина. Деветнадесет риби на резервоар бяха убити с остър удар в главата. Черният дроб и вътрешностите се претеглят, за да се изчисли хепатозоматичният индекс [HSI (%) = 100 × (чернодробно тегло/телесно тегло)] и висцерозоматичният индекс [VSI (%) = 100 × (общото тегло на вътрешните органи/телесно тегло)]. Парчета бял мускул бяха изрязани от гръбното дясно филе за измерване на ензимната активност. Филетата от лявата страна на рибата се съхраняват след подрязване и отнемане на кожата като проби за анализ на липидното съдържание. Три допълнителни риби на резервоар бяха взети за чернодробни и бели мускули при условия без RNase, за да се извърши анализ на генната експресия. Всички проби от тъкани бяха замразени в течен азот и съхранявани при -80 ° C до анализ.
Химичен анализ
Химичният състав на диетите и лиофилизирани проби от цялото тяло, събрани през петия и шестия месец, се анализира, като се използват следните процедури: сухо вещество след сушене при 105 ° C в продължение на 24 часа, липиди след екстракция с петролен етер при 160 ° C, протеин по метода на Kjeldahl, брутна енергия в калориметър с адиабатна бомба и нишесте в диетите по метода глюкоза-амилаза-глюкоза-оксидаза (40). Общото съдържание на липиди в мускула се измерва по метода на Folch (10) с дихлорометан вместо хлороформ като разтворител.
Метаболитни пътища
Ефектите от генетичния подбор и диетичното лечение върху липогенезата, окисляването на мастните киселини, гликолизата и производството на енергия бяха изследвани чрез анализ на генната експресия и активността на ключовите ензими, участващи в тези пътища. Липогенният ензим ацетил-КоА карбоксилаза (ACC; EC 6.4.1.2), както и глюкозо-6-фосфат дехидрогеназа (G6PDH; EC 1.1.1.49) и ябълчен ензим (ME; EC 1.1.1.40), които осигуряват NADPH за мастна киселина синтез, бяха анализирани само за активност поради липсата на информация за последователността на дъговата пъстърва в базите данни. Експресията на гена на активирания от пероксизома пролифератор транскрипционен фактор рецептор α (PPARα) беше измерена като ключов регулатор на окисляването на мастните киселини.
Анализ на генната експресия: количествена RT-PCR.
Таблица 2. Номер на присъединяване и съответна база данни за целеви генни последователности
Таблица 3. Последователности от праймери на дъгова пъстърва, използвани за амплификация на целеви гени чрез qRT-PCR
Ензимни дейности.
Ензимната активност се измерва върху размразени проби от черен дроб и бели мускули. Дейностите на синтазата на мастни киселини (FAS; EC 2.3.1.85), ACC, G6PDH и ME бяха измерени в черния дроб, както е описано от Richard et al. (34), като се използват хомогенати, получени от отделен цял черен дроб. Активността на липопротеинова липаза (LPL; EC 3.1.1.34) е измерена в мускулни проби, както е описано от Richard et al. (34).
Дейностите на следните ензими бяха измерени в проби от черен дроб и мускули. Ензимната активност на хидроксиацил-КоА дехидрогеназа (HAD; EC. 1.1.1.35) се извършва съгласно Kobayashi et al. (22). Пътят на гликолизата беше изследван чрез измерване на активността на хексокиназа 1 (HK1; EC 2.7.1.1) и пируват киназа (PK; EC 2.7.1.40), както е описано по-рано (21). Цитрат синтаза (CS; EC 4.1.3.7) беше измерена съгласно Singer et al. (38), следвайки намаляване на DTNB при 412 nm. За измерване на активността на NADP-зависимата изоцитрат дехидрогеназа (ICDH-NADP; EC 1.1.1.42) пробите се хомогенизират в ледено студен буфер (20 mM Tris · HCl, 250 mM манитол, 2 mM EDTA, 100 mM NaF, 10 mM меркаптоетанол и 0,5 mM PMSF), обработени с ултразвук и центрофугирани при 12 000 ж. Активността се оценява след намаляване на NADP при 340 nm след добавяне на 89,7 mM тетраетиламониев хлорид при pH 7,4, 41 mM NaCl, 0,34 mM NADP, 0,43 mM MnSO4 и 4,17 mM d, 1-изоцитрат към супернатантите. Една единица ензимна активност се определя като количеството ензим, което катализира хидролизата на 1 μmol субстрат в минута при пробна температура. Ензимната активност се изразява на милиграм разтворим протеин. Концентрацията на протеин се определя по метода на Брадфорд, като се използва комплект за анализ на протеин Bio-Rad (Мюнхен, Германия) с говежди серумен албумин като стандарт.
Статистика
Данните са средно ± SE. Ъгловата трансформация беше приложена към пропорциите (съдържание на липиди, протеини и влага, VSI и HSI) преди извършване на анализи, за да се отговори на предположенията за анализ на дисперсията (хомогенност на дисперсията и нормално разпределени остатъци). Ефектите от диетичните лечения, линиите и линията × диетични взаимодействия върху различните параметри бяха тествани с помощта на статистическия софтуер SAS посредством двупосочен дисперсионен анализ (линия и диета) (ANOVA). Разликите се смятаха за значими, когато нивото на вероятност беше
Таблица 4. Ефективност на растежа и използване на хранителни вещества на пъстърва от L и F линии, хранени с LE и HE диети за 6 месеца
Таблица 5. Състав на цялото тяло, морфологични параметри и съдържание на липиди в мускулите на пъстърва от L и F линии, хранени с LE и HE диети за 6 месеца
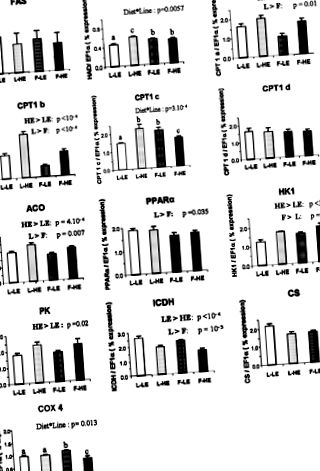
Фиг. 1.Експресия на гени на избрани ензими в черния дроб на дъговата пъстърва с чиста мускулна линия (L) и мастна мускулна линия (F), хранена с високо (НЕ) или нискоенергийна (LE) диета, измерена с количествена RT в реално време -PCR. Липиден метаболизъм: синтаза на мастни киселини (FAS), хидроксиацил-КоА дехидрогеназа (HAD), карнитин палмитоилтрансфераза 1 изоформи (CPT1a, CPT1b, CPT1c и CPT1d), ацетил-CoA оксидаза (ACO) и пероксизомен пролифератор PPARAR α). Гликолиза: хексокиназа 1 (HK1) и пируват киназа (PK). Енергичен метаболизъм: изоцитрат дехидрогеназа (ICDH), цитрат синтаза (CS) и цитохром оксидаза 4 (COX4). иРНК се приготвя от отделен черен дроб (н = 9 на група). Данните са средни стойности ± SE на 9 проби, извършени в три екземпляра. Стойностите на изразяване се нормализират с транскрипти, изразени с α-коефициент на удължение 1 (EF1α). a, b, c, d P
Таблица 6. Специфични ензимни активности в черния дроб на пъстърва от L и F линии, хранени с LE и HE диети за 6 месеца
Фиг. 2.Експресия на гени на избрани ензими в белия мускул на дъговата пъстърва от L и F линии, хранени с HE или LE диета, измерена чрез количествена RT-PCR в реално време. Липиден метаболизъм: липопротеин липаза (LPL), HAD, CPT1a, CPT1b, CPT1c, ACO и PPARα. Гликолиза: HK1 и PK. Енергичен метаболизъм: ICDH, CS и COX4. иРНК е получена от отделни проби от бели мускули (н = 9 на група, с изключение на HAD, CPT1a, CPT1b и PPARα, за които н = 8). Данните са средни стойности ± SE на 9 проби, извършени в три екземпляра. Стойностите на израза се нормализират с EF1α-изразени преписи.
Таблица 7. Специфични ензимни активности в мускулите на пъстърва от L и F линии, хранени с LE и HE диети за 6 месеца
- Хаплотипен анализ на генетични варианти на ендотелната азотна оксид синтаза (NOS3) и метаболизъм
- Загубата на CD36 предпазва от затлъстяване, предизвикано от диета, но води до увреждане на мускулните стволови клетки
- По какъв начин мастният усет в устата, солеността или сладостта на диетите допринасят за енергийния прием на храна
- Как да се храним за целодневна енергия и атлетично представяне Разкъсваща мускулатура
- Начин на живот и диетични промени при ендометриоза
- 6 автоимунни заболявания, които се забъркват с вашата профилактика на теглото
- Променлив график за кърмене и формула за кърмене и адаптирано мляко на 9 месеца; Лудият
- Защо гладуването отново е на мода Духовната история зад днешната тенденция в диетата на International
- Здравни условия
- Отслабване Начини, по които тялото ви не ви позволява да отслабнете и как да го поправите, The Times of
