Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Автора за кореспонденция. Факс: +49 89 2180 77093 Потърсете още статии от този автор
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Германия
Автора за кореспонденция. Факс: +49 89 2180 77093 Потърсете още статии от този автор
Резюме
Много протеини, разположени в междумембранното пространство (IMS) на митохондриите, се характеризират с ниска молекулна маса, съдържат силно запазени цистеинови остатъци и координират метални йони. Проучвания върху един от тези протеини, Tim13, разкриват, че нетната транслокация през външната мембрана се задвижва от метално зависимо сгъване в IMS [1]. Идентифицирахме съществен компонент, Mia40/Tim40/Ykl195w, със силно запазен домейн в IMS, който може да свързва цинкови и медни йони. В клетките, в които липсва Mia40, ендогенните нива на Tim13 и други свързващи метали IMS протеини са силно намалени поради нарушен внос на тези протеини. Освен това Mia40 взаимодейства директно с новоимпортирания протеин Tim13. Заключваме, че Mia40 е първият съществен компонент на специфичен път на транслокация на свързващи метали IMS протеини.
1. Въведение
2. Материали и методи
2.1 Плазмиди и щамове
За пречистване на Mia40 от дрожди, последователността, кодираща прекурсора Mia40, кондензиран до осем хистидинови остатъка, беше вмъкната в pVTU плазмида [15] и трансформирана в див тип W303‐1B. За израз в Ешерихия коли, последователността, кодираща остатъци 68–403 от Mia40, се амплифицира чрез PCR и се субклонира в плазмида pMAL-CRI (NEB, Beverly). За регулиран израз на Mia40, a GAL10 промоторът е вмъкнат нагоре от MIA40 рамка за четене в див тип щам YPH499. За изчерпване на Mia40, получените GAL-MIA40 култури бяха изместени от лактатна среда, съдържаща 0,1% галактоза, към лактатна среда, съдържаща 0,1% глюкоза. Свръхекспресията на Mia40 се получава чрез растеж на същия щам в присъствието на 0,5% галактоза.
2.2 Процедури за пречистване на протеини и определяне на съдържанието на метали
MBP-фузионните протеини се експресират в присъствието на 100 μM цинков ацетат или меден сулфат. Пречистването на протеини и определянето на металното съдържание се извършва по същество, както е описано, като се използват безметални буфери [1]. Радиомаркирани химически количества Tim13 бяха приготвени и използвани за реакции на импорт по същество, както е описано [1], с изключение на това, че клетките се отглеждат в среда с ниско съдържание на сулфат (50 μM) в присъствието на 5 mCi [35 S] сулфат.
2.3 Лечение с трипсин на ендогенна Mia40
Митохондриите се превръщат в митопласти чрез инкубация в 60 mM сорбитол, 1 mM ATP, 4,5 mM β-меркаптоетанол и 20 mM HEPES-KOH, рН 7,4, за 20 минути върху лед. След допълнителна инкубация в продължение на 10 минути в присъствието или отсъствието на 10 mM EDTA и 2 mM батофенантролин-дисулфонова киселина, митопластите бяха изложени на 5-25 μg/ml трипсин в продължение на 30 минути върху лед. След избистрящо въртене, протеините във супернатантната фракция се утаяват чрез добавяне на 12% трихлороцетна киселина и се анализират чрез имуноблотинг с антитела срещу Mia40.
2.4 Разни
Вносът на протеини в изолирани митохондрии, субклетъчно и субехохондриално фракциониране, омрежване на препротеин и ко-имунопреципитация се извършват, както е описано [1, 16, 17]. Антителата бяха събрани срещу С-краен пептид от дрожди Mia40 (CVKKEPLNEESKP) при зайци. За определяне на зрелия N-край на Mia40, С-терминална октахистидинил-маркирана форма на Mia40 се експресира в дрожди, пречистена чрез Ni-NTA хроматография [16] и анализирана чрез N-терминално секвениране в TopLab GmbH (Martinsried, Германия).
3 резултата
3.1 Mia40 разкрива голям домейн в IMS
3.2 Mia40 е основен свързващ мед и цинк протеин
Хомолозите на Mia40 присъстват в цялото еукариотно царство. Те споделят силно консервиран домен от около 60 аминокиселинни остатъка, който съдържа шест инвариантни цистеинови остатъци, образуващи мотив CXC-CX9C-CX9C- (Фиг. 2 А). Установено е, че този мотив е от съществено значение за Mia40, тъй като вариантът, при който първите три цистеинови остатъка се обменят със серинови остатъци, не е в състояние да спаси Δmia40 деформация при прекъсване (данните не са показани).
За да оценим потенциалния метален свързващ капацитет на Mia40, ние рекомбинантно експресирахме и пречистихме IMS домейна на Mia40 (аминокиселинни остатъци 68–403) като синтетичен протеин с свързващия малтоза протеин (MBP-Mia40ΔTM). Индукционно свързана плазмена атомно-емисионна спектроскопия (ICP-AES) разкри значителни количества цинкови и медни йони в MBP-Mia40ΔTM (фиг. 2В). Други метали, като желязо и никел, не са открити. Това показва, че Mia40 има способността специфично да свързва цинкови и медни йони.
Наличието на метален кофактор в Mia40 беше допълнително подкрепено от значително повишена чувствителност на трипсин на ендогенния протеин в присъствието на хелатори (фиг. 2С). Това предполага, че in vivo сгъването на IMS домейна на Mia40 се стабилизира от метални йони.
3.3 Mia40 се изисква за внос на малки IMS протеини
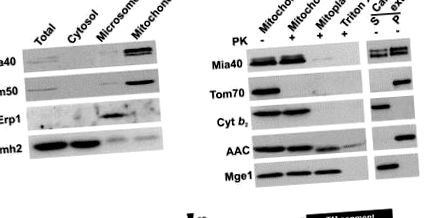
За да идентифицираме функцията на Mia40 в митохондриите, ние конструирахме щам, приютяващ MIA40 ген под контрол на глюкозно-репресируемата GAL10 промоутър. Около 22 часа след преминаването от среда, съдържаща галактоза към глюкоза, Mia40 се изчерпва от митохондриите и клетките се забавят в растежа си (фиг. 3 А). Интересното е, че ендогенните нива на малките координиращи метала IMS протеини Tim13, Tim10 и Cox17 бяха силно намалени в митохондриите, изчерпани от Mia40 (Mia40 ↓) (Фиг. 3В). За разлика от тях, IMS протеините, които не съдържат метални кофактори, не са засегнати (цитохром б 2, цитохром ° С и цитохром ° С хем лиаза). Нивата на митохондриалните протеини на външната мембрана (Tom40), вътрешната мембрана (Tim23, AAC) и матричното пространство (Tim44, Mge1) също бяха непроменени. Протеинът на вътрешната мембрана Tim22 беше намален до известна степен, вероятно защото биогенезата на Tim22 зависи от наличието на малки Tim протеини в IMS [7, 20]. Това предполага, че Mia40 е специално необходим за биогенезата или поддържането на съдържащи метали IMS протеини.
След това извършихме експерименти за внос в изолирани митохондрии, за да тестваме ролята на Mia40 в този процес (фиг. 3С). Вносът на Tim13 беше силно зависим от присъствието на Mia40, независимо дали Tim13 беше пречистен от рекомбинантен Е. coli клетки („химични количества“) или синтезирани в ретикулоцитен лизат („радиохимични количества“). Вносът на Tim10 и рекомбинантен Cox17 също беше засегнат в Mia40 ↓ митохондрии. За разлика от тях, нивата на внос на цитохром ° С хем лиаза, IMS протеин, който не координира метални кофактори, както и на протеини на външната мембрана (порин) и матрицата (pSu9DHFR) не бяха намалени (фиг. 3С). Заключваме, че Mia40 е жизненоважен за вноса на свързващи метали протеини в IMS. Интересното е, че при свръхекспресия на Mia40, нивата на внос на Tim13 бяха значително увеличени, което предполага, че Mia40 представлява фактор, ограничаващ скоростта за внос на Tim13 (фиг. 3D).
3.4 Mia40 взаимодейства с малки протеини на Tim
След това тествахме чрез химическо омрежване дали нововъведеният Tim13 директно взаимодейства с Mia40. Радиомаркиран Tim13 е внесен в митохондриите в присъствието или отсъствието на омрежващ реагент 1,5-дифлуоро-2,4-динитробензен (DFDNB). След лизис на митохондрии при денатуриращи условия, Mia40 се изолира чрез имунопреципитация. Както е показано на фиг. 4 А, омрежен продукт на Tim13 от около 75 kDa се утаява със специфични за Mia40 антитела. Този продукт отразява специфично взаимодействие на Tim13 с Mia40, тъй като отсъства, когато не е добавен омрежващ компонент или в контролни утайки с преимунен серум (Фиг. 4А, ляв панел). Освен това не се наблюдава кръстосано свързване с Mia40 с мутант Tim13 SSSS, при който четирите консервирани цистеинови остатъци на Tim13 са заменени със серинови остатъци (Фиг. 4А, десен панел). Този вариант Tim13 не е в състояние да свързва метални йони и вследствие на това не се натрупва стабилно в IMS на митохондриите [1]. Взаимодействието между Mia40 и новоимпортирания Tim13 също беше открито чрез ко-имунопреципитация, използвайки антитела срещу Mia40 (фиг. 4В). Ендогенният Tim13 не е имунопреципитиран с Mia40 (данните не са показани). По този начин Mia40 взаимодейства физически с Tim13 по време или директно след неговото преместване в IMS на митохондриите.
4. Дискусия
Ние демонстрираме, че Mia40 излага голям метален свързващ домейн в IMS и е от решаващо значение за вноса на малки метални съдържащи протеини в IMS. Интимният контакт на Mia40 с новоимпортирания Tim13 предполага пряка роля на Mia40 в улавянето и/или сгъването на Tim13 в IMS. Тъй като металозависимото сгъване и внос на Tim13 изглежда са механично и кинетично свързани събития [1], трудно е да се обърне внимание на основната молекулярна функция на Mia40 в този процес. Наблюдението, че Mia40 има способността да свързва цинкови и медни йони, е интригуващо и прави възможно активната роля на Mia40 в трансфера на метали към нововъведените IMS протеини. Като алтернатива, Mia40 може да играе роля като рецептор за подклас на IMS протеини. Такава функция би била в съответствие с наблюдаваното свързване на новоимпортирания Tim13 към Mia40.
По време на подготовката на ръкописа две публикации съобщават за идентификацията на Ykl195w/Mia40/Tim40 [21, 22]. Техните резултати и представените тук са съгласни относно ролята на този протеин в биогенезата на малки IMS протеини. Комплексът от Mia40 към новоимпортирани малки Tim протеини, които ние идентифицирахме чрез експерименти за омрежване и коимунопреципитация, също беше разкрит в тези проучвания, макар и чрез алтернативен гелен подход. Способността за свързване на метали на Mia40 обаче не е докладвана преди. Освен това успяхме да изясним топологията и местоположението на Mia40. В двете неотдавнашни публикации имаше противоречиви възгледи. Предполага се, че Mia40 е закрепен към вътрешната мембрана с хидрофобен сегмент [22]. Другият съобщава за второ събитие за обработка, което задейства пускането на Mia40 в IMS на митохондриите [21]. Ние определихме чрез разграждане на Едман N-крайната последователност на Mia40 в митохондриите. Това разкри, че обработката на прекурсорния протеин се осъществява N-крайно на хидрофобния сегмент, което показва, че трансмембранният сегмент присъства в зрелия протеин Mia40.
Идентифицирането на Mia40 като компонент за внос на Tim13 и други IMS протеини отваря нов аспект на вътреклетъчния трафик на протеини. Бъдещите изследвания ще трябва да се съсредоточат върху молекулярните механизми, чрез които Mia40 медиира векторната транслокация на IMS протеини през външната мембрана на митохондриите.
Благодарности
Благодарни сме на Ulrike Gärtner и Heiko Germeroth за отлична техническа помощ, Helmuth Hartl за определяне на метали и проф. Alex Tzagoloff за антитела срещу Cox17. Благодарим на проф. Мат Харми за критичното четене на ръкописа. Тази работа беше подкрепена от безвъзмездни средства от Deutsche Forschungsgemeinschaft HE 2803/2, SFB 594 (B3, B13) и от Фонда на химическата индустрия.
- Човекът губи 129 килограма, за да може да тича със синовете си близнаци, които дадох на децата си бащата, който заслужават
- Как влияят протеините върху отслабването
- Хипноза за отслабване с помощта на хипнотерапия за проливане на лири Грация Космическа хипноза
- Lite - Център за отслабване със сърце (WLC) Идеален протеин - Lite - Център за отслабване със сърце (WLC) е
- Как успях да изхвърля дебелите си гащи, докато се хранех в Азия