Резюме
Заден план
МикроРНК (miRNAs) са клас малки некодиращи РНК, които участват в регулирането на клетъчната диференциация. Предишни проучвания демонстрират, че miR-9-5p играе ключова роля в развитието на раковите клетки, но механизмите, чрез които miR-9-5p регулира адипогенезата, остават слабо разбрани. Настоящото проучване има за цел да изследва значението му при производството на зайци с висококачествено месо чрез наблюдение на регулаторния ефект на miR-9-5p в преадипоцитите и намиране на свързаните с тях цели.
Методи
В това проучване е използван анализ на репортер с двойна луцифераза, за да се потвърди целевата връзка между miR-9-5p и лептин ген. Също така използвахме количествена PCR с обратна транскрипция (qRT-PCR), Western blot, анализ на оцветяване с маслено червено-O и определяне на съдържанието на триглицериди, за да анализираме регулирането на miR-9-5p и лептин ген по време на диференциация на адипоцитите.
Резултати
Заключение
Резултатите от настоящото проучване показват, че miR-9-5p регулира диференциацията на белите преадипоцити при зайци чрез насочване към лептин ген.
Въведение
В настоящото проучване изолирахме и култивирахме заешки периренални мастни клетки. След това изследвахме ефекта на свръхекспресията или инхибирането на miR-9-5p върху диференциацията на адипоцитите. Освен това предвидихме и проверихме това лептин е целевият ген на miR-9-5p. И накрая, открихме, че miR-9-5p може да повлияе на диференциацията на адипоцитите чрез понижаване на експресията на лептин ген.
материали и методи
Събиране на животни и тъкани
Всички експериментални процедури с използване на зайци в това проучване са проведени по протокол, одобрен от Институционалния комитет за грижи и употреба на животните в Колежа по животновъдни науки и технологии, Сечуански аграрен университет, Китай. Зайците бяха убити чрез сгъване на врата. Периреналните мастни тъкани са събрани от 3 новородени зайци от Нова Зеландия, които са отгледани при стандартни условия във фермата на земеделския университет в Съчуан (Яан, Съчуан, Китай).
Изолация на клетките, култивиране и индуциране на адипогенеза
Мастната тъкан се изплаква три пъти с PBS и след това се смила и смила с 0,25% колагеназа тип I (Gibco, Карлсбад, Калифорния, САЩ) при 37 ° С за 1 h. След това сместа се добавя към пълната среда (СМ; DM/F12, 10% фетален говежди серум, 2% пеницилин-стрептомицин) (Gibco), последвано от филтриране през 70-nm и 40-nm клетъчни сита, съответно. Крайната смес се центрофугира при 1200 х g в продължение на 5 минути за събиране на преадипоцитите. След това преадипоцитите се посяват в културална колба с пълна среда и се инкубират при 37 ° С в овлажнен инкубатор с 5% СО2. Културната среда се сменя на всеки 2 дни и клетките се замразяват за бъдещи изследвания. След като клетките достигнат около 70% сливане, адипогенен коктейл (0,5 тМ 3-изобутил-1-метилксантин, 10% FBS, 1 цМ дексаметазон и 1,7 цМ инсулин) се добавя към растежната среда, за да предизвика диференциация. Клетките бяха допълнително инкубирани в продължение на 72 часа, след което средата беше заместена с поддържаща среда (среда за растеж, допълнена с 1,7 тМ инсулин на 50 ml) и инкубирани за допълнителни 72 часа. След това клетките се култивират в среда за растеж до узряване на 10 дни.
Трансфекция на клетки
Преадипоцитните клетки се посяват в 24-ямкови или 6-ямкови плаки и се трансфектират с помощта на Lipofectamine 3000 (Invitrogen, Carlsbad, CA, USA), съгласно инструкциите на производителя, след като клетките достигнат 70% сливане. Крайните концентрации на имитиращата отрицателна контрола miRNA (NC miR-Mimic), инхибитора на отрицателната контрола (NC инхибитор) и отрицателната контрола лептин siRNA (siRNA NC) са съответно 50 nM, 100 nM и 100 nM. Бяха направени три независими повторения за всяка лечебна група. Клетките се събират на различни интервали от време след трансфекцията и се използват за изследване на адипогенна диференциация.
Изолация на РНК и анализ на qPCR
Уестърн блотинг
Общият протеин от клетъчните проби беше извлечен с комплект за обща екстракция на протеини (Sangon, Шанхай, Китай), следвайки протокола на производителя и съдържанието на протеин беше количествено определено с BCA Protein Assay Kit. Протеините (40 mg) се разтварят върху 8-12% SDS-полиакриламидни гелове и се прехвърлят в PVDF мембрана (Bio-Rad). Мембраната на PVDF се изплаква с TBS-Tween20 (TBST) и се блокира за 2 часа в обезмаслено мляко. След това мембраните бяха инкубирани цяла нощ с анти-PPARγ (Santa Cruz Biotechnology,) и анти-β-актин (Abs, Пекин, Китай) съгласно съответните инструкции. След това PVDF мембраните бяха промити три пъти и инкубирани с вторичен кози антимиши IgG (H + L) (Transgen, Illkirch-Graffenstaden, Франция) в продължение на 2 часа. Протеиновите ленти бяха инкубирани с хемилуминесцентни реагенти (Beyotime) след измиване четири пъти. Изображенията са получени със система Bio-Rad GelDoc, оборудвана с Universal Hood III (Bio-Rad) и интегрираната оптична плътност (IOD) е изчислена с помощта на Gel-Pro Analyzer 4.0.0.4. Актинът се използва като вътрешен контрол.
Маслено червено-O оцветяване и определяне на съдържанието на триглицериди
Адипоцитите се промиват три пъти с буфериран с фосфат физиологичен разтвор (PBS) и се фиксират в 4% параформалдехид за 30 минути. Фиксираните клетки се оцветяват с 1% филтриран маслено-червен-О разтвор за около 30 минути на тъмно. След това адипоцитите се промиват и наблюдават под фазов контрастен микроскоп. Накрая, маслото червено-О се елуира от оцветените клетки с изопропанол и се определя количествено чрез измерване на стойностите на оптичната плътност при дължина на вълната 510 nm. Съдържанието на вътреклетъчен триглицерид (TG) е количествено определено с TG Assay Kit (Applygen, Пекин, Китай) съгласно протокола на производителя. Съдържанието на TG (nmol/mg протеин) се нормализира до клетъчната концентрация на протеин и концентрациите на протеини се измерват с BCA Protein Assay Kit (Beyotime, Шанхай, Китай).
Прогнозиране и проверка на целевия ген на miR-9-5p
MiRwalk (http://zmf.umm.uni-heidelberg.de/apps/zmf/mirwalk2/) е използван за прогнозиране на целевите гени на miR-9-5p. Лептин е установено, че е целевият ген на miR-9-5p. 3’UTR на лептин, съдържащ целевия сайт miR-9-5p, беше клониран в сайта Sac I-Xba I на pmirGLO Vector (Promega, Madison, WI) за конструиране на луциферазни репортерни плазмиди. Праймерите, използвани за плазмидно изграждане, са изброени в Таблица 1. Множество места за клониране са разположени след гена на луцифераза на светулка. HeLa клетки се засяват в 24-ямкови плаки в три екземпляра. След това, pmirGLO-лептин-3 ′ UTR от див или мутант тип беше ко-трансфектиран със синтетичен miR-9-5p имитиращ в HeLa клетки, след като клетъчната плътност достигна 70–80%. Активността на светулка луцифераза (luc2) беше измерена 48 часа след трансфекцията и нормализирана до активност на Renilla луцифераза съгласно инструкциите на комплекта за анализ на двойна луцифераза TransDetect®® (Transgen, Пекин, Китай).
Статистически анализ
Резултатите от RT-qPCR от експресията на иРНК бяха нормализирани до геометричната средна стойност на Актин идентифицира стабилност и нивото на експресия на miRNA се нормализира до експресията на U6 snRNA, чрез оптимизиран сравнителен метод за стойност на Ct (2 - ΔΔCt). Целите данни са представени като средна стойност ± стандартна грешка (SEM). T-тестът на ученика в GraphPad Prism7 (GraphPad Software, La Jolla, CA, USA) беше използван за оценка на разликата между групите. P
Резултати
Експресионно профилиране на miR-9-5p по време на диференциация на заешките преадипоцити
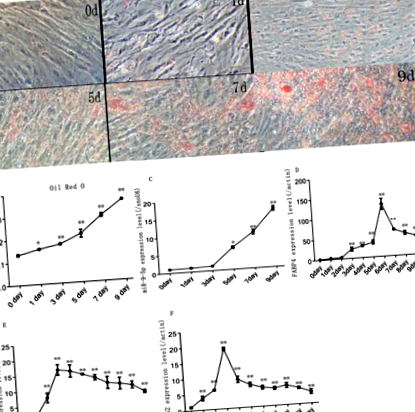
В процеса на индуциране на диференциация адипоцитите достигат пълна диференциация, отлагайки големи липидни капчици (фиг. 1а). Резултатите от оцветяването с маслено червено-O показват, че капките липиди бързо се увеличават по време на диференциацията на преадипоцитните клетки (фиг. 1б). Едновременно с това експресията на miR-9-5p нараства бързо след 3 дни индукция и достига своя връх на деветия ден (фиг. 1в). Съответно, адипогенен маркер ген FABP4 имаше най-високата експресия на иРНК на шестия ден, докато PPARγ и CEBPα имаше най-високата експресия на третия ден след индукцията (фиг. 1г, д, е).
Модел на диференциация на заешки преадипоцити (а) Маслено червено-оцветяване на липидни капчици; (б) количествено откриване на маслено червено O оцветяване; (° С) Нива на експресия на MiR-9-5p по време на диаференция на преадипоцитите при нормални условия на култивиране; (д) FABP4 нива на експресия по време на диференциация на преадипоцитите при нормални условия на култивиране; (д) CEBPα нива на експресия на иРНК по време на диаференция на преадипоцитите при нормални условия на култура; (е) PPARγ нива на експресия по време на диференциация на преадипоцитите при нормални условия на култивиране ("*", P ≤ 0,05; „**“, P ≤ 0,01)
Повишаването на регулирането на miR-9-5p насърчава диференциацията на заешките преадипоцити
За да изследваме функцията на miR-9-5p в диференциацията на заешките преадипоцитни клетки, първо открихме нивото на експресия на miR-9-5p в клетките, трансфектирани с имитации на miR-9-5p и NC по време на диференциацията. След индукция, miR-9-5p показа по-високо ниво на експресия в имитиращата група, отколкото в NC групата (P Фиг. 2
Свръхекспресията на miR-9-5p стимулира диференциацията на заешките преадипоцити (а) Нива на експресия на MiR-9-5p по време на диференциация на преадипоцитите след трансфекция с имитация на miR-9-5p и NC, (б) Маслено червено-оцветяване на липидни капчици на ден 9; (° С) Количествено откриване на маслено червено О оцветяване на ден 9; (д) Натрупване на триацилглицерол на ден 9; (д) PPARγ нива на експресия по време на диференциация на преадипоцитите след трансфекция с имитатори на miR-9-5p и NC; (е) CEBPα нива на експресия по време на диференциация на преадипоцитите след трансфекция с имитатори на miR-9-5p и NC; (ж) FABP4 нива на експресия по време на диференциация на преадипоцитите след трансфекция с имитатори на miR-9-5p и NC (з, i) PPARγ нива на протеини по време на диференциация на преадипоцитите след трансфекция с имитатори на miR-9-5p и NC („*“, P ≤ 0,05; „**“, P ≤ 0,01)
Понижаването на регулирането на miR-9-5p инхибира диференциацията на заешките преадипоцити
След това изследвахме диференциацията на преадипоцитите, когато ендогенният miR-9-5p беше ефективно инхибиран с инхибитора miR-9-5p. Както е показано на фиг. 3а, нивата на експресия в инхибиторните групи са значително по-ниски, отколкото в NC групата на третия, 5-ия, 7-ия и 9-ия ден след трансфекцията (P Фиг. 3
Инхибирането на miR-9-5p инхибира диференциацията на заешките преадипоцити (а) Нива на експресия на MiR-9-5p по време на диференциация на преадипоцитите след трансфекция с инхибитора на miR-9-5p и INC, (б) Маслено червено-оцветяване на липидни капчици на ден 9; (° С) Количествено откриване на маслено червено О оцветяване на ден 9; (д) Натрупване на триацилглицерол на ден 9; (д) PPARγ нива на експресия по време на диференциация на преадипоцити след трансфекция с инхибитор miR-9-5p и INC; (е) CEBPα нива на експресия по време на диференциация на преадипоцити след трансфекция с инхибитор miR-9-5p и INC; (ж) FABP4 нива на експресия по време на диференциация на преадипоцити след трансфекция с инхибитора miR-9-5p и INC (з, i) PPARγ нива на протеини по време на диференциация на преадипоцитите след трансфекция с инхибитора miR-9-5p и INC („*“, P ≤ 0,05; „**“, P ≤ 0,01)
Лептин е целеви ген на miR-9-5p
За да се определи допълнително функцията на miR-9-5p, беше извършен биоинформатичен анализ за прогнозиране на директни цели на miR-9-5p. Софтуерът MiRWalk2.0 (http://zmf.umm.uni-heidelberg.de/apps/zmf/mirwalk2/) разкри, че лептин съдържа целевите сайтове за miR-9-5P (фиг. 4а). За да се провери съществуването на места за директно свързване между miR-9-5p и лептин, извършен е анализ на луцифераза-репортер и резултатите показват, че активността на луциферазата на светулката значително намалява по време на ко-трансфекция на pmirGLO-LEPTIN-3 ′ UTR и miR-9-5p агомири (Фиг. 4b).
MiR-9-5p е регулиран надолу лептин експресия на иРНК
За да разберем по-добре ролята на miR-9-5p по време на диференциацията на преадипоцитите, ние допълнително потвърдихме ефекта на miR-9-5p върху експресията на лептин. Както е показано на фиг. 5а, свръхекспресията на miR-9-5p доведе до очевидно намаляване на нивата на иРНК на лептин. За разлика от това, когато ендогенният miR-9-5p беше инхибиран с инхибитора miR-9-5p, експресията на лептин увеличен в сравнение с NC групата (Фиг. 5б).
MiR-9-5p отрицателно регулиран лептин израз: аЛептин израз, базиран на количествена полимеразна верижна реакция в реално време (QRT-PCR) по време на адипогенеза с свръхекспресия на miR-9-5p. бЛептин експресия, базирана на QRT-PCR по време на адипогенеза с miR-9-5p нокдаун. („**“, P ≤ 0,01)
Понижение на експресия на лептин насърчава диференциацията на заешките преадипоцити
За допълнително потвърждение дали лептин участва в диференциацията на заешките преадипоцити, si-лептин е бил използван за събаряне на ендогенни лептин. Установихме, че натрупването на липиди и триацилглицерол се ускорява в клетките на преадипоцитите (фиг. 6а, б, в). Кога лептин беше свален, нивата на иРНК на PPARγ и C/EBPα бързо се увеличава през първия и третия ден след трансфекцията, докато FABP4 бързо се увеличи на 5-ти и 7-ми (фиг. 6г, д, е). освен това, PPARγ нивото на експресия на протеин значително се повишава в si-лептин група от NC група, 3 дни след трансфекцията (P Фиг. 6
Инхибиране на лептин генетично стимулирана диференциация на преадипоцити на заек (а) Маслено червено-оцветяване на липидни капчици на ден 9; (б) Количествено откриване на маслено червено О оцветяване на ден 9; (° С) Натрупване на триацилглицерол на ден 9; (д) PPARγ нива на експресия при диференциация на преадипоцитите след трансфекция с si-лептин и NC; (д) CEBPα нива на експресия при диференциация на преадипоцитите след трансфекция с si-лептин и NC; (е) FABP4 нива на експресия при диференциация на преадипоцитите след трансфекция с si-лептин и NC; (ж, з) PPARγ нива на протеин по време на диференциация на преадипоцитите след трансфекция със si-лептин и NC. iЛептин. нива на експресия при диференциация на преадипоцитите след трансфекция с si-лептин и NC („*“, P ≤ 0,05; „**“, P ≤ 0,01)
Дискусия
През последните години се съобщава, че miRNAs се експресират в адипоцитите на бозайници и играят важна роля в регулирането на адипогенезата [39]. Предишни проучвания откриха функционално взаимодействие между глюкозозависимата секреция на инсулин, нивата на mir-9 и Sirt1 протеин в β-клетките на панкреатичните островчета [30]. Установено е също, че miR-9 и Sirt1 участват в глюкозозависимата секреция на инсулин в β клетките на островчета и е доказано, че Sirt1 е целеви ген на miR-9 [27]. В допълнение, miR-9-5p може да регулира отрицателно Sirt1 експресия и играе важна роля в регулирането на клетъчната пролиферация и миграция [29]. Sirt1 може да се свърже с два коензимни фактора на PPARγ, които инхибират свързването на PPARγ към целевия ген и диференциацията на адипоцитите [25]. Доказано е също така, че miR-9-5p подпомага секрецията на Granuphilin-a и намалява секрецията и синтеза на инсулин чрез насочване Onecut2 [26]. Резултатите показаха, че PPARy лигандът засилва усвояването на глюкоза в мастната тъкан чрез засилване на експресията на GLUT-4, което може да подобри инсулиновата чувствителност [13]. освен това, PPARγ е маркерен ген на преадипоцитна диференциация. Така че, miR-9-5p може да регулира диференциацията на адипоцитите.
Заключение
В обобщение, нашите данни показват, че miR-9-5p може да насърчи диференциацията на заешките преадипоцити и лептин действа като една от целите надолу по веригата на miR-9-5p. В допълнение, нокдаун на лептин насърчава адипогенната диференциация. Като цяло стигаме до извода, че miR-9-5p насърчава диференциацията на заешките преадипоцити чрез потискане на експресията на лептин иРНК.
Наличност на данни и материали
Всички данни, генерирани или анализирани по време на това проучване, са включени в тази публикувана статия.
- Производителност, чревна пропускливост и генна експресия на избрани протеини с плътно свързване в
- Моногенни форми на детско затлъстяване, дължащи се на мутации в лептиновия ген Molecular and Cellular
- Многостранна дерегулация на генната експресия и синтеза на протеини с възрастта PNAS
- Пълнотекстовият AEDG пептид без молекули (Epitalon) стимулира генната експресия и синтеза на протеини
- Средиземноморската диета за една година насърчава чревните бактерии, свързани със здравословното стареене. Може да помогне за ограничаване