Резюме
Вроден лептинов дефицит е рядък автозомно-рецесивен моногенен синдром на затлъстяване, причинен от мутации в лептиновия ген. Този преглед описва молекулярните и клетъчните характеристики на осемте различни мутации, открити досега при хората.
Въведение
През последните четири десетилетия разпространението на затлъстяването в детска възраст се е увеличило драстично и затлъстяването се е превърнало в епидемично заболяване с повече от 5% от всички деца, засегнати в развитите страни [1]. Промените в условията на живот могат да повлияят на поведението на децата и да благоприятстват развитието на затлъстяване поради индивидуална генетична чувствителност [1].
При по-голямата част от затлъстелите деца не може да се диагностицира синдромна или моногенна причина за затлъстяването и поради това се предлага полигенна причина. Като цяло моногенните форми на детско затлъстяване са много редки [2]. Известно е, че мутациите само в няколко гена причиняват развитието на тежко затлъстяване в ранна детска възраст [2]. Повечето от тези гени участват в централната нервна регулация на глада и ситостта, където системата за лептин/лептинов рецептор играе ключова роля [3]. От всички моногенни форми на затлъстяване единствената причинно лечима е вродената лептинова недостатъчност, причинена от хомозиготни мутации на лептиновия ген [4]. Лептинът е протеин, секретиран главно от адипоцити и неговите циркулиращи нива корелират положително с индекса на телесна маса и телесната мастна маса. Чрез централно, както и периферно действие, лептинът влияе на различни физиологични процеси, включително енергиен баланс, метаболизъм, ендокринна регулация и имунна функция [3]. Една от основните функции на лептина е да контролира телесната мастна маса, като инхибира приема на храна чрез централната нервна система. Рекомбинантен човешки лептин (метрелептин) може да се прилага на пациенти с вроден дефицит на лептин, за да компенсира липсата на лептин [5].
Настоящите клинични препоръки предполагат, че децата с нормално тегло при раждане, но бързо наддаване на тегло през първите няколко месеца от живота, водещо до екстремно затлъстяване, трябва да бъдат тествани за вроден дефицит на лептин, когато показват нарушена ситост, интензивна хиперфагия и поведение, търсещо храна (вж. фенотип на пациенти с вроден дефицит на лептин) [6], [7]. Повечето пациенти, описани досега, са имали родители от роднини. Пациентите обикновено развиват метаболитни и хормонални промени, включително хиперинсулинемия, инсулинова резистентност, тежка чернодробна стеатоза, дислипидемия, както и хипогонадотропен хипогонадизъм (вж. Клиничен фенотип на пациенти с вроден лептинов дефицит) [7], [8]. Освен това, някои пациенти показват имунологични промени в ранна детска възраст, които се проявяват в повтарящи се тежки бактериални инфекции, които могат да доведат до смърт в детска възраст (вж. Клиничен фенотип на пациенти с вроден дефицит на лептин) [4]. При заместителна терапия с рекомбинантен човешки лептин, прилаган чрез ежедневни подкожни инжекции, пациентите отслабват, телесната мастна маса намалява и метаболитните, хормоналните и имунологичните отклонения се нормализират [4], [8], [9].
Клиничен фенотип на пациенти с вроден дефицит на лептин
Нормално тегло при раждане
Бързо наддаване на тегло след раждането
Тежко затлъстяване с ранно начало
Постоянно търсене на храна
Повтарящи се тежки и вероятно летални бактериални инфекции в ранна детска възраст (някои пациенти)
Развитие на хиперинсулинемия
Развитие на тежка чернодробна стеатоза
Развитие на дислипидемия
При хората в литературата са описани осем различни лептинови мутации, които водят до вроден дефицит на лептин, когато са налице в хомозиготно състояние. На клетъчно ниво тези мутации водят до дефекти в синтеза и/или секрецията на лептин. В следващите параграфи обобщихме молекулярните и клетъчните характеристики на тези мутации.
Преглед
Лептинов ген и протеинова структура
Генът, кодиращ лептин (LEP или OB) е открита чрез позиционно клониране през 1994 г. [10]. The LEP генът се намира на хромозома 7q31.3 и се състои от три екзона, разделени от два интрона [11] [Ensembl: ENSG00000174697].
Лептинът е цитокин от тип I и член на семейството на дълговерижните спиралови цитокини, който също включва интерлевкин 6 (IL-6), гранулоцитен колониестимулиращ фактор (G-CSF) и растежен хормон (GH) [12]. Той се синтезира като незрял 167-аминокиселинен протеин, обхващащ N-краен 21-аминокиселинен сигнален пептид [10] [Ensembl: ENST00000308868]. Разцепването на сигналния пептид дава негликозилиран, зрял 146-аминокиселинен протеин [10] [Ensembl: ENST00000308868]. Структурата му включва четири основни α спирали A до D, както и изкривена малка α спирала E, локализирана във веригата, свързваща спирали C и D [12]. Приемайки ориентация нагоре-надолу-надолу, спиралите A до D образуват сноп от четири спирали, който е стабилизиран от единична вътремолекулярна дисулфидна връзка, обхващаща от началото на цикъла между спиралите C и D до C-края на протеин [12].
Молекулярни и клетъчни характеристики на човешки лептинови мутанти
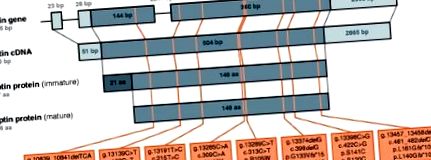
Обозначенията, използвани за описване на позицията и характера на човешките лептинови мутации, са били противоречиви досега [13] - [23]. Следователно ние предоставяме последователна нотация и преглед на осемте отделни лептинови мутации, описани досега при хора (Фигура 1), картографирани към човешкия лептинов ген, транскрибирани лептинова иРНК (тук cDNA) и преведени незрели и обработени зрели лептинови протеини. В текста на този преглед даденото положение на аминокиселините в лептиновия протеин еднообразно се отнася до тяхното положение в непреработения, незрял протеин. Освен това обобщихме информация за осемте известни лептинови мутации при хора, включително броя на пациентите, за които се съобщава, че носят тези мутации (Таблица 1). Освен ако не е посочено друго, избраната номенклатура се придържа към препоръките на Обществото за вариация на човешкия геном (HGVS).
Преглед на човешки лептинови мутанти. Картиране на осемте различни мутации на човешки лептин към човешкия ген на лептин, кДНК на лептин и незрели, както и зрял лептинов протеин. Където е приложимо, размерите на отделните порции са дадени или в двойки основи (bp) или в аминокиселини (aa). За лептиновия ген екзоните са изобразени като запълнени кутии, докато интроните и фланговите области са изобразени като тънки линии. Частите от екзон 2 и екзон 3, които образуват отворената рамка за четене (ORF), са оцветени в по-тъмен нюанс. За лептиновата cDNA 5 'и 3' нетранслируемата област (UTR) са оцветени в по-светъл нюанс, докато ORF е оцветен в по-тъмен нюанс. За незрелия лептинов протеин сигналният пептид, който се отделя по време на процеса на зреене, е оцветен в по-тъмен нюанс. За зрелия лептинов протеин избраната номенклатура не е в съответствие с препоръките на HGVS. Цялата информация за последователността се основава на [Ensembl: ENSG00000174697, Ensembl: ENST00000308868].
Трета мутация е описана през 2008 г. при две индивиди от популация, населяваща малко туркменско планинско село [G (p.S141C) в хомо и хетерозиготни форми на човешкия лептинов ген. Russ J Bioorg Chem 2008, 34 (6): 768–770. doi: 10.1134/s1068162008060198 10.1134/S1068162008060198 "href ="/articles/10.1186/s40348-014-0003-1 # ref-CR17 "> 17]. Трансверсия на цитозин в позиция 13398 на лептиновия ген до гуанин (g .13398C> G), съответстваща на позиция 422 от транскрипта (c.422C> G), доведе до мисенс мутация на протеина, променяйки серина в позиция 141 на цистеин (p.S141C) [G (p.S141C) в хомо и хетерозиготни форми на човешкия лептинов ген. Russ J Bioorg Chem 2008, 34 (6): 768–770. doi: 10.1134/s1068162008060198 10.1134/S1068162008060198 "href ="/articles/10.1186/s40348-014-0003-1 # ref -CR17 "> 17]. Не се съобщава за измерване на серумните нива на лептин при тези пациенти [G (p.S141C) в хомои и хетерозиготни форми на човешкия лептинов ген. Russ J Bioorg Chem 2008, 34 (6): 768–770. doi: 10.1134/s1068162008060198 10.1134/S1068162008060198 "href ="/articles/10.1186/s40348-014-0003-1 # ref-CR17 "> 17]. Чехранова и др. предложиха, че мутацията p.S141C може да доведе до неправилно нагъване на протеини и/или загуба на биологична активност чрез въвеждане на трети цистеин в протеина, пречещ на правилното образуване на вътремолекулната дисулфидна връзка [G (p.S141C) в хомо и хетерозиготни форми на човешкия лептинов ген. Russ J Bioorg Chem 2008, 34 ( 6): 768–770. Doi: 10.1134/s1068162008060198 10.1134/S1068162008060198 "href ="/articles/10.1186/s40348-014-0003-1 # ref-CR17 "> 17]. Доколкото ни е известно, все още не е публикувано проучване, изследващо синтеза или секрецията на този мутант.
Пета мутация е описана от нашата група през 2010 г. при дете от австрийско родословие без известна кръвна връзка [20]. Преходът на тимина в позиция 13191 от лептиновия ген към цитозин (g. 13131T> C), съответстващ на позиция 215 от транскрипта (c.215T> C), доведе до миссенс мутация на протеина, променяйки левцина на позиция 72 до серин (стр. L72S) [20]. При този пациент серумните нива на лептин, измерени чрез RIA, са били на границата на откриване (0,4 ng/ml) [20]. Нещо повече, лептин не може да бъде открит в серума на този пациент чрез имунопреципитация и последващо Western blot [20]. Анализирайки получената от пациента мастна тъкан, експресията на мутантния протеин може да бъде открита в адипоцитите чрез qRT-PCR, Western blot, както и имунохистохимия [20]. освен това, инвитро-диференцирани адипоцити, получени от пациент, показват експресия на мутантния протеин [20]. Трансфекцията на HEK293 клетки потвърди, че р.L72S лептинът наистина се синтезира, но не се секретира [20]. Чрез генериране на плазмиди, кодиращи p.L72A, p.L72I, p.L72V или p.L72T лептин и трансфектиране на тези плазмиди в клетки HEK293, нашата група успя да определи липсата на хидрофобност на страничната верига в позиция 72 на протеина като основна причина за липсата на секреция [20].
При друго дете, делеция на цитозин-тиминов дублет в позиции 13457 и 13458 на лептиновия ген (g. 13475_13458дел CT), съответстващи на позиции 481 и 482 от транскрипта (c.481_482delCT), доведоха до мутация на белтъка, измествайки левцина в позиция 161 на белтъка на глицин и вмъквайки допълнителни осем последващи аберантни аминокиселини, преди да спрат (стр. L161Gfs* 10) [21]. При този пациент нивото на серумния лептин, измерено чрез ELISA, е много ниско (0,2 ng/ml) [21]. Фатима и сътр. предложи в случая на p.L161Gfs* 10 мутация, загубата на С-терминала p.C167 и следователно загубата на вътремолекулната дисулфидна връзка, както и въвеждането на аберантен участък от аминокиселини може да доведе до неправилно сгъване, нарушен вътреклетъчен транспорт и секреция, както и загуба на биологичната активност на секретирания протеин [21]. Няма проучване, изследващо синтеза или секрецията на p.I35дел или p.L161Gfs* Досега е публикуван 10 мутант.
Най-поразителното е, че досега не всички известни мутанти на миши лептин проявяват дефектен синтез и/или секреция на лептин.
н-етил-н-нитрозоурея (ENU) -движена мутагенеза доведе до генерирането на лептин-мутант миши щам, показващ едновременно съществуване на високи серумни нива на лептин и фенотип, много подобен на този на затлъстяване щамове на мишки [30]. В този щам е открита мисенс мутация на лептиновия протеин, променящ валина в позиция 145 на глутамат (p.V145E), която е причинена от трансверсия на тимина в позиция 12971 на лептиновия ген до аденин (g. 12971T> A), съответстващ на позиция 434 от преписа (c.434T> A) [30] [Ensembl: ENSMUSG00000059201, Ensembl: ENSMUST00000069789].
В две обширни инвитро проучвания, Peelman et al. и Iserentant et al. генерира голям брой различни миши лептинови мутанти с единични или множество аминокиселинни промени, покриващи по същество цялата повърхност на лептиновия протеин [31], [32]. Интересното е, че при използване на COS-1 клетки като еукариотна експресионна система се установи, че всички мутанти, с изключение на тези, насочени към p.L34, се синтезират и секретират към клетъчната супернатанта, от която могат да бъдат пречистени за по-нататъшни експерименти [31], [32] . Няколко от тези мутанти показват изразени промени в способността им да свързват и/или активират лептиновия рецептор, като по същество доказват, че мутациите, които правят миши лептин биологично неактивен, не трябва непременно да влияят върху синтеза и/или секрецията на лептин [31], [32].
Това повдига въпроса дали съществуват форми на човешки вроден дефицит на лептин, при които производството на биологично неактивен лептин е забулено от наличието на подозрителни или дори повишени серумни нива на лептин.
Позовавайки се на настоящите клинични препоръки, последователността на лептиновия ген при пациенти с екстремно ранно затлъстяване се препоръчва само при наличие на неоткриваеми или много ниски нива на серумен лептин [6]. Следователно не може да се изключи, че случаи на вроден дефицит на лептин с ясно откриваеми нива, но биоинактивен хормон съществуват при хората.
Болестите, причинени от биоактивни хормони, са много редки, но все още съществуват. Например, случаи на биологично неактивен протеин са докладвани за хормони като ACTH, TSH, както и свързания с лептин GH [33] - [36]. Следователно съществуването на вродена лептинова дисфункция определено трябва да се има предвид.
Заключения
Вроденият дефицит на лептин, причинен от хомозиготни мутации в лептиновия ген, води до нарушаване на ситостта, интензивна хиперфагия и екстремно затлъстяване в началото, придружено от множество метаболитни, хормонални и имунологични аномалии. Досега са идентифицирани осем различни мутации на лептин, характеризиращи се с неоткриваеми до ниски нива на серумния лептин. В механично отношение за някои от тези мутации са предложени и демонстрирани дефекти в синтеза и/или секрецията на хормона. Засегнатите пациенти могат да бъдат успешно лекувани с рекомбинантен човешки лептин. Настоящите клинични препоръки предполагат секвениране на лептиновия ген в случаи на екстремно затлъстяване в ранна детска възраст, за предпочитане в присъствието на неоткриваеми до ниски серумни нива на лептин. По този начин може да се наложи промяна в практиката, за да се идентифицират нови лептинови мутации, които не показват дефекти в синтеза и секрецията, а в биологичната активност на хормона.
- Мутации в един ген, свързани с тежко затлъстяване
- Тежко затлъстяване, свързано с новоидентифицирани генни мутации - ScienceDaily
- Изследване казва, че рискът от затлъстяване е свързан с мутации в гена MRAP2
- Моногенни форми на затлъстяване SpringerLink
- PPT; Детско затлъстяване PowerPoint презентация безплатна за гледане - id 154656-YjRhO