Парк Mi-Kyoung
1 Катедра по вътрешни болести, Изследователски център за медицински науки, Център за регулиране на хитовете в Митохондрия, Университетски колеж Dong-A, Пусан 602-714, Корея.
Ин Хан
1 Катедра по вътрешни болести, Изследователски център за медицински науки, Център за регулиране на хитовете в Митохондрия, Университетски колеж Dong-A, Пусан 602-714, Корея.
2 Катедра по фармакология, Изследователски център за медицински науки, Център за регулиране на хитове в Митохондрия, Университетски колеж Dong-A, Пусан 602-714, Корея.
Ми Сун Ким
1 Катедра по вътрешни болести, Изследователски център за медицински науки, Център за регулиране на хитовете в Митохондрия, Университетски колеж Dong-A, Пусан 602-714, Корея.
2 Катедра по фармакология, Изследователски център за медицински науки, Център за регулиране на хитове в Митохондрия, Университетски колеж Dong-A, Пусан 602-714, Корея.
Eunhui Seo
2 Катедра по фармакология, Изследователски център за медицински науки, Център за регулиране на хитове в Митохондрия, Университетски колеж Dong-A, Пусан 602-714, Корея.
Soojeong Kang
2 Катедра по фармакология, Изследователски център за медицински науки, Център за регулиране на хитовете в Митохондрия, Университетски колеж Dong-A, Пусан 602-714, Корея.
So-Young Park
2 Катедра по фармакология, Изследователски център за медицински науки, Център за регулиране на хитовете в Митохондрия, Университетски колеж Dong-A, Пусан 602-714, Корея.
Хьонджонг Кох
2 Катедра по фармакология, Изследователски център за медицински науки, Център за регулиране на хитовете в Митохондрия, Университетски колеж Dong-A, Пусан 602-714, Корея.
Duk Kyu Kim
1 Катедра по вътрешни болести, Изследователски център за медицински науки, Център за регулиране на хитовете в Митохондрия, Университетски колеж Dong-A, Пусан 602-714, Корея.
Hye-Jeong Lee
2 Катедра по фармакология, Изследователски център за медицински науки, Център за регулиране на хитовете в Митохондрия, Университетски колеж Dong-A, Пусан 602-714, Корея.
Резюме
Фенофибрат е селективен активатор на активиран от пероксизомен пролифератор рецептор α (PPARα) и се предписва за лечение на хиперлипидемия. Механизмът, чрез който агонистите на PPARα намаляват приема на храна, телесното тегло и затлъстяването, остава неясен. Едно от обясненията за намаляването на приема на храна е, че фенофибратът насърчава окисляването на мастните киселини и увеличава производството на кетонни тела при стандартна експериментална доза от лекарството (100
ВЪВЕДЕНИЕ
Понастоящем фенофибратът се използва за контрол на липидните аномалии при хора с дислипидемия [1] и действа като лиганд, активиран от пероксизомен пролифератор α (PPARα), който регулира експресията на редица гени, които са важни за метаболизма на липидите и глюкозата. Наскоро няколко проучвания изследват ефектите на агонистите на PPARα върху енергийния прием, телесното тегло и телесните мазнини при модели на затлъстяване при гризачи. При селективно отглеждани плъхове, склонни към затлъстяване, фенофибратът (100 mg/kg на ден) намалява наддаването на телесно тегло, затлъстяването, приема на храна и ефективността на храненето [2]. Диетичният фенофибрат (100 mg/kg на ден) също намалява приема на храна, телесното тегло и затлъстяването на плъхове Otsuka Long-Evans Tokushima Fatty (OLETF) [3]. При db/db мишки лечението с фенофибрат (0,2%, w/w) е свързано с намален прием на храна [4]. Въпреки че механизмът на намален прием на храна от фенофибрат не е установен, няколко доклада показват, че PPARα агонистите насърчават окисляването на мастни киселини и увеличават производството на кетон в тялото [5-7]. Когато кетонното тяло, бета-хидроксибутират, се прилага периферно [8,9] или централно [10], това води до намаляване на приема на храна. Тези резултати предполагат, че фенофибратът може да намали приема на храна поради кетогенеза чрез повишено окисление на мастните киселини.
Забелязахме обаче, че лечението с ниски дози фенофибрат (30 mg/kg/ден), което не увеличава производството на кетон, намалява количеството на приема на храна при плъхове Long-Evans Tokushima (LETO), които са физиологично нормални двойници на OLETF плъхове. За разлика от това, плъховете OLETF, които са дефектни в холецистокинин (CCK) -А рецепторите, не показват никаква промяна в приема на храна при лечението с ниски дози на фенофибрат. Това наблюдение може да покаже, че CCK играе роля за намаляване на приема на храна, когато фенофибрат, който не повишава плазменото ниво на кетонните тела, се прилага в ниска доза.
CCK е хормон, който се секретира от дванадесетопръстника и йеюналните мукозни клетки в отговор на мазнини и протеини [11]. CCK има редица физиологични ефекти, като забавяне на изпразването на стомаха, модулиране на стомашно-чревната подвижност и потискане на енергийния прием [12]. Насищането след хранене може да се отдаде предимно на CCK, освободен в червата и действащ чрез ваго-вагусния рефлекс, а не директно върху центъра на ситост в ЦНС [13]. Има два рецептора за CCK, CCK-A (CCK1r) и CCK-B (CCK2r). Плъховете на OLETF генетично нямат CCK-A рецептори в резултат на мутация [14]. Накъсаната мишка, която е намалена с експресията на CCK-B рецептор, се характеризира с прогресивна дегенерация на ретината и кохлеята и затлъстяване с късно начало [15]. Плъховете OLETF консумират много по-големи хранения и са напълно устойчиви на инхибиторните ефекти на екзогенния CCK, както и на стомашна или чревна инфузия на хранителни вещества, при енергиен прием [16]. За да се изследва връзката между фенофибрат и CCK, плъховете OLETF могат да се използват като експериментален модел вместо плъхове с дефицит на CCK рецептор.
В настоящото проучване предположихме, че анорексигенният механизъм на фенофибрата може да бъде свързан с индуцирането на CCK. Открихме, че фенофибратът увеличава синтеза на CCK и че индуцирането на CCK от фенофибрат не влияе върху апетита на дефицитни на CCK рецептори OLETF плъхове. Тези резултати предполагат, че индуцирането на CCK може да бъде свързано с един от анорексигенните механизми, причинени от фенофибрат.
МЕТОДИ
Животни и лечение
Десетседмични мъжки плъхове LETO (n = 10) и OLETF (n = 10) бяха любезно дарени от Otsuka Pharmaceutical (Tokushima, Япония). Плъховете бяха държани в отделни клетки в контролирана от околната среда стая в Университетския център за грижи за животните на Dong-A със свободен достъп до вода и стандартна чау-чау по време на експерименталния период. Когато плъховете бяха на 17 седмици, LETO плъховете бяха разделени на две групи. Групата LETO-фенофибрат (n = 5) е хранена със стандартна чау-чау и фенофибрат (Laboratoires Fournier, Green Cross, Южна Корея) (30 mg/kg/ден) в продължение на 11 седмици. LETO-контролната група (n = 5) е хранена само със стандартна чау-чау за същия период. Плъховете OLETF също се разделят на група OLETF-фенофибрат (30 mg/kg/ден) (n = 5) и група OLETF-контрола (n = 5). За целия период на експеримента всички плъхове са били обгрижвани съгласно Насоките за експерименти с животни, препоръчани от Корейската академия на медицинските науки. Измервахме дневния прием на храна и телесното тегло на всички плъхове, като редовно претегляхме специалните контейнери за храна и клетките на плъховете. След 18 часа на гладно се изтегля кръв от вената на опашката, за да се измери кръвната захар на гладно (FBS) и плазмените нива на лептин и β-кетон. На 28-седмична възраст всички плъхове се упояват и се жертват за по-нататъшен анализ.
Измерване на кръвната захар, кетон и лептин на гладно
Нивата на FBS са измерени с GlucoDr (Allmedicus, Сеул, Южна Корея). Нивата на β-кетон в кръвта са измерени с MediSense Optium (Abbott Laboratories, Abbott Park, IL). Плазмените нива на лептин са анализирани с ELISA комплект за лептин за плъхове (Linco Research, St. Charles, MO).
PCR анализ в реално време
Общата РНК беше изолирана с реагент Trizol (Invitrogen, Carlsbad, CA) и едноверижна cDNA беше синтезирана от 2 µg обща РНК с Oligo (dT) 15 Primer, M-MLV Reverse Transcriptase, M-MLV 5X реакционен буфер, dNTP и инхибитор на рибонуклеаза (Promega, Madison, WI). PCR анализите в реално време бяха извършени с помощта на ABI PRISM 7000 Sequence Detection System (Applied Biosystems, Foster city, CA). Всяка реакция се провежда с 12.5 ul 2X SYBR основна смес, 1 ul cDNA, 2.5 ul 3 μM правни и обратни праймери и 6.5 ul вода. Експериментите са проведени в три екземпляра и 18S РНК е използвана като инвариантна контрола за всички изследвания.
PPARα агонисти лечение на Caco-2 клетки
Човешка чревна епителна клетъчна линия, Caco-2 [17], е закупена от Korean Cell Line Bank (Сеул, Южна Корея) и е поддържана в минимална есенциална среда (Invitrogen) с 10% фетален говежди серум (ThermoFisher Scientific, Waltham, MA) и 1% от пеницилин/стрептомицин (Invitrogen) при 37 ℃ в овлажнен инкубатор с 5% CO2. Клетките Caco-2 се култивират в присъствието на фенофибрат, безафибрат или клофибрат (Sigma-Aldrich, St. Louis, MO) в продължение на 24 часа.
Измерване на експресията на PPARα и CCK
Общите протеини бяха изолирани от клетки Caco-2 и тънките черва на плъхове, използвайки радиоимунопреципитационен буфер за анализ, съдържащ протеазни инхибиторни коктейли и фосфатазни инхибиторни коктейли (Sigma-Aldrich). Концентрацията на протеин се определя в три екземпляра, като се използва разтвор на бицинхронова киселина с разтвор на меден сулфат (Sigma-Aldrich). Протеиновите проби се смесват с буфер за проби на Laemmli и се поставят във вряща водна баня за 5 минути. Протеините се разтварят в 8
12% SDS-полиакриламиден гел електрофореза (SDS-PAGE; във всяко платно се зареждат равни количества от общия протеин) и се прехвърлят в нитроцелулозни мембрани. Петната бяха изследвани с антитела към PPARα, CCK и β-актин (Santa Cruz Biotechnology, Santa Cruz, CA). Блоти са разработени с помощта на конюгирани с пероксидаза хрян вторични антитела, последвано от инкубация с ECL Plus Western Blotting Detection Reagents (Amersham, UK) и сигнали са открити с помощта на Fuji LAS 4000 Imaging station (Токио, Япония).
Статистически анализ
Всички резултати са изразени като средни стойности ± SE. Значимостта на разликите между групите се анализира чрез t-тест на Student и еднопосочен ANOVA. Използвахме статистически програми в SPSS 9.0 за Windows. Различията се считат за значими, когато р стойност е по-малка от 0,05.
РЕЗУЛТАТИ
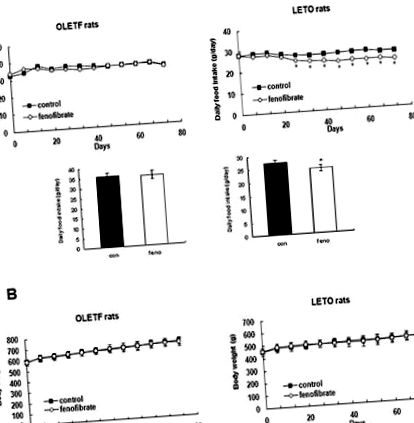
Ефекти от ниските дози фенофибрат върху дневния прием на храна и телесното тегло
Ефекти на ниските дози фенофибрат върху метаболитните параметри
Ефекти на фенофибрата върху експресията на PPARα и CCK в тънките черва на плъхове LETO и OLETF. (А) Относителните количества PPARa и CCK иРНК се анализират чрез RT-PCR в тънките черва на LETO плъхове. Показаните стойности (означава ± SEM) се нормализират спрямо GAPDH иРНК. n = 5. * p Фиг. 3А). В допълнение, експресията на PPARα се увеличава чрез лечението с фенофибрат в чревни клетки Caco-2. За да изследваме дали индукцията на експресията на CCK е уникален ефект на фенофибрат, тествахме други видове PPARα агонисти като безафибрат и клофибрат. Експресията на CCK в клетки Caco-2 също се индуцира от безафибрат и клофибрат (фиг. 3В). И трите PPARα агонисти повишават нивата на протеин на CCK и PPARα в Caco-2 клетки.
Ефекти на фенофибрата върху експресията на PPARα и CCK в Caco-2 клетки. (А) Експресията на CCK се увеличава в зависимост от дозата при лечение с ниски дози на фенофибрат (3, 10 и 30 цМ) за 24 часа. (B) Експресията на CCK в Caco-2 клетки се индуцира от няколко вида PPARα агонисти; фенофибрат 100 цМ (фено), безафибрат 100 цМ (беза) и клофибрат 250 цМ (кло). Показаните експерименти бяха повторени три пъти, за да се потвърди възпроизводимостта.
ДИСКУСИЯ
Обичайната експериментална доза (висока доза, 100
300 mg/kg) лечение с фенофибрат повишава нивата на β-кетон в кръвта [2,5,6] и намалява приема на храна [3,4,18]. В настоящото проучване с ниски дози нивото на β-кетон в кръвта в групата на фенофибрат при плъхове LETO не се различава значително от това на контролната група. Нивото на плъховете OLETF изглежда е малко по-ниско в сравнение с плъховете LETO, но нормалният диапазон на нивото на β-кетон в кръвта е под 1,0 mmol/l. Нивото на плазмен лептин при плъхове OLETF показва по-високо от LETO плъхове, тъй като телесното тегло на плъховете OLETF е по-високо. След 11 седмици лечение с фенофибрат, плазмените нива на лептин в групата на фенофибрат при плъхове LETO обикновено са по-ниски от тези на контролната група. Групата с фенофибрат на плъхове LETO е намалила приема на храна, въпреки че техните нива на лептин изглеждат по-ниски в сравнение с контролната група. Лечението с фенофибрат причинява хепатомегалия [19]. Увеличението на теглото на черния дроб се използва за маркер за ефект на фенофибрат.
В допълнение, ние изследвахме индуцирането на CCK от фенофибрат на клетъчно ниво, използвайки клетки Caco-2, човешка чревна епителна клетъчна линия. Клетките Caco-2 показаха дозозависима експресия на CCK и PPARα след третиране с фенофибрат. Клетките Caco-2 показват повишена експресия на CCK не само след лечение с фенофибрат, но и след лечение с други PPARα агонисти, безафибрат и клофибрат. Наскоро беше съобщено, че PPARα е важен транскрипционен регулатор в тънките черва [20]. Това откритие предполага, че PPARα може да регулира експресията на CCK. Необходими са допълнителни проучвания за определяне на транскрипционния регулаторен механизъм на CCK чрез PPARα.
Това проучване е първият доклад, че експресията на CCK се увеличава от фенофибрата. За щастие тази находка беше възможна, защото експериментирахме с физиологично нормалните LETO плъхове. Има няколко съобщения за физиологично нормални плъхове, като плъхове Wistar и Sprague Dawley, които не показват намаляване на приема на храна чрез фенофибрат [21,22]. Напротив, склонните към затлъстяване мишки, като db/db [4] и ob/ob мишки [18], показват анорексични ефекти при лечение с фенофибрат. Тези доклади предполагат, че физиологично нормалните условия могат да бъдат устойчиви на ефектите на фенофибрат поради разликата в щамовете, докато фенофибратът може да бъде ефективен при затлъстяване.
Клиничното значение на това проучване е възможното приложение на фенофибрат за лечение на затлъстяване. Имаше няколко мащабни, рандомизирани контролирани проучвания с използване на фенофибрат. Промяната в приема на храна обаче не е включена в параметрите на тези проучвания. Ефектът от лечението с фенофибрат върху приема на храна не е проучен. По този начин може да се наложи пилотно проучване за оценка на способността на фенофибрата да намалява приема на храна при затлъстяване. Пациентите с хипертриглицеридемия с леко до умерено затлъстяване биха били добри кандидати за такова проучване.
В заключение, относително ниска доза терапия с фенофибрат намалява приема на храна при плъхове LETO чрез увеличаване на експресията на CCK в дванадесетопръстника. Повишената експресия на CCK може да бъде един от факторите за анорексигенните ефекти на фенофибрата.
ПРИЗНАВАНИЯ
Тази работа беше подкрепена от Националната изследователска фондация на Корея (NRF), финансирана от корейското правителство (MEST) (2010-0001943) и от Университетския фонд за изследвания Dong-A през 2010 г.
- Безалкохолната мастна чернодробна болест е свързана с прекомерен прием на калории, а не с
- Безалкохолната мастна чернодробна болест е свързана с прекомерен прием на калории, а не с
- Приемът на сол все още е висок въпреки години на инициативи за намаляване The Japan Times
- Бавно освобождаване Рибна храна Защо трябва да я избягвате!
- Седем отслабващи SuperFoods Clean Food Crush