Департамент по дерматология, Университет в Нант, Нант, Франция
Департамент по дерматология, Университет в Нант, Нант, Франция
Конфликт на интереси:
Авторът няма конфликт на интереси за разкриване.
Източници на финансиране:
Този доклад описва подробно данните, представени по време на Световната среща по дерматология, проведена на 8 и 9 ноември 2016 г. в Мексико Сити, Мексико. Тази среща беше финансирана от Фондация Биодерма, Франция, под егидата на Фондация дьо Франс.
Резюме
Въведение
Акнето е хронично възпалително заболяване на пилозната единица. 1 Това обикновено се случва в пубертета, но се наблюдава и при възрастни. 2 Нейната патофизиология включва трима участници, хиперсеборея, анормална фоликуларна кератинизация и Propionibacterium acnes разпространение в пилозната единица. В резултат на тяхното взаимодействие кожната микросреда се променя и води до възпалителни реакции на гостоприемника, които насърчават прогресирането на лезиите на акне. 2, 3 Последните изследвания дадоха нова светлина върху участието на мастната жлеза, както и върху противовъзпалителната активност на кожния микробиом в патофизиологията на акнето.
Целта на тази статия е да предостави актуална информация относно участието на мастната жлеза, вродения имунитет и кожния микробиом в акнето. Втората цел беше да се отвори нова перспектива за възможностите за лечение.
Методи
Авторът е направил преглед на литературата на най-новите данни за патофизиологията на акнето.
Мастната жлеза
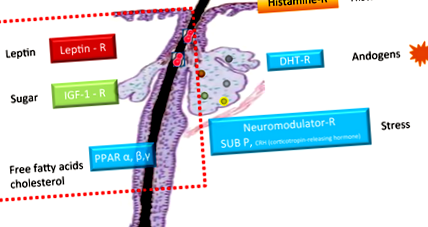
Производството на себум се индуцира от различни рецептори, експресирани от мастната жлеза. В допълнение към добре описания хистаминов рецептор, активиран от хистамини, хормоналния DHT рецептор, активиран от андрогени, и невромодулаторния рецептор, главно вещество Р и рецептор за освобождаване на кортикотропин хормон (CRH), които се активират главно от стрес, показват скорошни молекулярни изследвания идентифицира три други рецептора, които се експресират от себоцитите и които контролират производството на себум (Фиг. 1). 4-6
Всеки от тези новоидентифицирани рецептори се активира от хранително вещество. Рецепторите, активирани с пролифератор на пероксизома (PPARα, β и γ), се стимулират от свободните мастни киселини и холестерола, инсулиноподобния растежен фактор (IGF) -1 рецептор от захар и лептиновия рецептор от мазнините. 7-9 Лептинът е хормон, секретиран от адипоцити, който регулира телесното тегло и също така е известно, че свързва липидния метаболизъм с възпалението в различни клетъчни типове. В себоцитите той е отговорен за създаването на липидни капчици в клетката и наскоро беше доказано, че индуцира и противовъзпалителен ензим и секреция на цитокини (интерлевкин (IL) -6 и IL-8). 9 Този резултат предполага, че лептинът е нов играч в индуцирането на възпаление и промяна на липидния профил в себоцитите и може да бъде връзка между диетата и развитието на възпалително акне.
Връзката между акнето и диетата се подкрепя допълнително от неотдавнашно контролно проучване на предсказващи фактори за акне. 10 Освен добре познатата връзка между фамилната анамнеза и акнето, изследователите установяват, че високият индекс на телесна маса (ИТМ) също е предсказващ фактор за повишен риск от развитие на умерено до тежко акне при юноши и млади възрастни. Освен това, популационно проучване на акне и ИТМ при юноши съобщава, че наднорменото тегло, както и затлъстяването могат да бъдат потенциално свързани с акне при момичета на възраст 18 и 19 години, 11 въпреки че все още липсват доказателства.
Периферна хиперандрогения
Въпреки че спиронолактонът не е показан за акне нито от EMEA, нито от FDA, има обосновка относно употребата му при състоянието: спиронолактонът пречи на контролираната от хормона секреция на себум и потни жлези и на стимулирания от андроген растеж на косата. 15 Въз основа на това е проведено пилотно проучване при 16 пациенти, които са получавали 75 mg до 150 mg/ден орален спиронолактон и хапче от трето поколение и локално BPO 0,25% или локален ретиноид дневно с много положителни резултати на 6 и 12 месеца, потвърждаващи клиничната полза от оралния спиронолактон при възрастни жени с акне. 16 Оттогава изключителната употреба на спиронолактон в тази подгрупа пациенти е допълнително тествана. 17, 18 Съвсем наскоро е доказано, че локалното доставяне на спиронолактон превъзхожда твърдите липидни наночастици, които доставят лекарството в дермата. 19 Необходими са обаче допълнителни тестове, за да се потвърди това клинично.
Ендоканабиноидната система
Ендоканабиноидите представляват клас ендогенни липидни медиатори, които участват в различни биологични процеси, както централно, така и периферно. 20.
Последните проучвания интригуващо предполагат съществуването на функционална ендоканабиноидна система (ECS) в кожата и я включват в различни биологични процеси (напр. Пролиферация, растеж, диференциация, апоптоза и цитокини, медиатор или хормонална продукция на различни клетъчни типове кожа и придатъци), като космения фоликул и мастната жлеза). Изглежда, че основната физиологична функция на кожната ECS е да контролира по същество правилната и добре балансирана пролиферация, диференциация и оцеляване, както и имунната компетентност и/или поносимост на кожните клетки. Нарушаването на този деликатен баланс може да улесни развитието на множество патологични състояния и заболявания на кожата. 21, 22
Напоследък ECS привлече известен интерес към лечението на акне чрез контролиране на секрецията на себум. 23 An инвитро Проучване, проведено през 2014 г., установи, че канабидиолът има липостатични, антипролиферативни и противовъзпалителни ефекти, които могат да направят този не-психотрофен канабиноиден агент обещаваща терапия за акне вулгарис. 24
Кожният микробиом
Кожният микробиом е колективният геном на обитаващите микробни обитатели (вируси, бактерии, гъбички и паразити), наричан още микробиота, присъстващ върху кожата и нейните придатъци. Това е уникален микробен пръстов отпечатък. 25, 26 Той контролира баланса на микробиотата и на преходната микробна колонизация и подпомага вродения имунитет на гостоприемника. Той непрекъснато се променя, като е потенциално повлиян от външни (механични фактори, комедогенна козметика, агресивни детергенти, лекарства, диета) и вътрешни фактори (хормонални или генетични фактори). 10, 27-29
Въпреки че е комменсал, някои жители са свързани с възпалителни заболявания на кожата, като например П. акне (акне), Malassezia furfur (себореен дерматит) и демодекс (розацея). Други преходни микроби, като Стафилококус ауреус и Streptococcus pyogenes, са известни патогени. 30-33
В балансиран микробиом на кожата, Staphylococcus epidermidis ограничава свръхколонизацията и възпалителния отговор на кожата от различните П. акне щамове, идентифицирани чрез освобождаване на янтарна киселина, продукт на ферментация на мастна киселина и потиска П. акне‐индуцирано производство на IL-6 и TNF-α от кератиноцити. 34-38 Обратно, П. акне ограничава разпространението на S. aureus и S. pyogenes при поддържане на киселинно рН на фоликула на пилозабелковия фоликул чрез хидролизиране на себумните триглицериди и чрез секреция на пропионова киселина. 33, 39
Следователно, всяка модификация на естествения микробиомен състав може да доведе до нарушена кожна бариера, ефект, който също се нарича дисбиоза и който задейства активирането на вродения имунитет, водещ до възпаление. 40 При акне дисбиозата може да бъде успоредена от качествена и количествена промяна на себума, наречена дисеборея и в модифициран профил на П. акне, с всичките шест различни филотипа, различаващи се между пациенти с и без акне. 41, 42 В резултат на това възпалението се влошава. Като такова е показано, че експресията на TLR-2 се увеличава с тежестта на заболяването и че цитокините се произвеждат в резултат на взаимодействието между П. акне и TLR-2, дефензини и MMP чрез активиране на PAR-2R. 43, 44 Това влошаване чрез стимулиране на TLR-2, IL-8 и MMP-9, което се разпространява от пилозната жлеза до дермата и епидермиса, е пет пъти по-възпалително от S. aureus или Streptococcus pyogenes. 43, 45-49
Поради това балансирането на естественото равновесие на микробиома, позволяващо възстановяването на естествената бариера на кожата, е една от основните цели при лечението на акне днес.
Вроденият имунитет и П. акне
Вътре в кожата както вродените, така и адаптивните механизми допринасят за имунната функция на гостоприемника. 50-52 Кератиноцитите играят важна роля в имунния отговор на кожата. Те изразяват редица рецептори за разпознаване на образци (PRR), включително Toll-подобни рецептори (TLR) и активирани с протеаза рецептори (PAR), които разпознават микробите чрез разпознаване на различни запазени молекулярни единици. Докато експресират редица антимикробни пептиди (AMP, като дермцидин), цитокини (INF-γ, IL-8, IL-12, TNF, IL-1, MMP) и хемокини в стационарно състояние, активирането на PRR може бързо да увеличи експресия на тези молекули, което води до директни антимикробни ефекти, както и набиране и образование на допълнителни имунни клетки. 53-55
В процеса на възпаление, предизвикано от П. акне, наблюдавана е секреция на IL-1β от моноцити и от себоцити чрез активиране на ключовия инфламазомен ген NLRP3. Този механизъм се регулира от протеази и реактивни кислородни видове (ROS). 56-58 Освен това, П. акне насърчава смесени Th17/Th1 отговори чрез индуциране на съпътстваща секреция на IL-17A и IFN-γ от специфични CD4 (+) Т клетки in vitro. Следователно, наличието на IL-17A-положителни Т-клетки и активирането на свързани с Th17 цитокини в лезии на акне показват, че пътят Th17 може да играе ключова роля в болестния процес, вероятно предлагайки нови цели на терапията. 59
Съвсем наскоро, П. акне е установено, че е силно чувствителен към различни концентрации на азотен оксид в наночастиците (NO ‐ np). NO ‐ np значително потиска IL-1β, фактор на туморна некроза-α (TNF-α), IL-8 и IL-6 от човешки моноцити и IL-8 и IL-6 от човешки кератиноцити и мононуклеарни клетки от периферна кръв. Тези данни показват, че NO-np може ефективно да предотврати П. акнеИндуцирано възпаление както чрез изчистване на организма, така и чрез инхибиране на микробната стимулация на вродения имунен отговор. 60
Няколко мастни киселини, свободни от себум (FFA) като линолова и сапиенова киселина имат антибактериална активност чрез стимулиране на производството на антимикробен пептид (AMP) срещу широк спектър от Грам-положителни бактерии като П. акне. 61 Различни проучвания показват, че АМР допринасят главно за вродения кожен имунитет. 62, 63 Сред тях, човешкият β-дефензин (hBD) -2 се регулира в кератиноцитите по време на възпаление и след това се натрупва в кожата. 64, 65 Поради тяхното пряко антимикробно действие, секрецията на тези пептиди осигурява защита срещу микроби като П. акне. 61 Това е потвърдено от Choi и др. 66 чрез проучване, оценяващо регионалната разлика на възпалителните лезии на акне, според hBD-2 експресията.
Въз основа на тези елементи, интегрирането на AMP в арматуриума на настоящите лечения, насочени към възпаление, като локални ретиноиди, може да се счита за бъдеще за лечение на акне.
Propionibacterium acnes и биофилмът
Propionibacterium acnes е в състояние да създаде биофилм, направен от извънклетъчни полизахариди. Това биологично лепило увеличава прилепването към П. акне към фоликуларните стени, благоприятстващи модулацията на интегрини. Освен това, той регулира бактериалния растеж и метаболизма, стимулира развитието на П. акне колонии и придава устойчивост на антимикробни агенти и на приемни възпалителни клетки, което води до втори механизъм на бактериална резистентност. 67 П. акне биофилм се наблюдава по-често при пациенти с акне. 68 При тези пациенти секрецията на пропионова киселина чрез П. акне доведе до образуването на кератиноцити с неправилна клетъчна морфология, потвърждавайки това П. акне модулира диференциацията на кератиноцитите, предполагайки, че тя играе роля в развитието на възпалителни лезии на акне и в образуването на микрокомедони. 69, 70
Следователно, използването на локални антибактериални съединения, като бензоил пероксид или растителни продукти, които не предизвикват антибактериална резистентност, може да бъде привилегирована алтернатива за ограничаване на кожното П. акне биофилм. 71
Заключения
В заключение, появата на акне включва различни фактори, водещи до възпаление и образуване на различни видове лезии на акне. Тези фактори включват количествена и качествена промяна на себума по време на пубертета, наречена дисеборея, предизвикана от вътрешни фактори като хормонални или генетични фактори, и външни фактори като комедогенна козметика, агресивни детергенти или лекарства, които могат да стимулират механизмите, участващи в патофизиологията на акне. Влиянието на стреса и диетата при дисебореята остава да бъде изяснено. Дисбиоза, процесът, водещ до нарушена кожна бариера, и неравновесието на кожния микробиом, което води до разпространението на П. акне щамове, са други важни процеси, които предизвикват акне. П. акне активира вродения имунитет чрез експресията на PARs, TNF-α и TLRs и производството на INF-γ, IL-8, IL-12, TNF, IL-1 и MMPs от кератиноцити, което води до хиперкератинизация на пилозната единица.
(i) Ребалансиране на естествения микробиом на кожата чрез възстановяване на естествената бариера на кожата при насочване на цитокиновите рецептори, (ii) ограничаване на разпространението на П. акне върху кожата с помощта на локални антибактериални средства, които не предизвикват резистентност и (iii) регулиране на изтичането и състава на себума ще бъдат основните предизвикателства за лечение на акне в бъдеще.
Благодарности
Авторът признава писмената подкрепа на Карл Патрик Гориц, SMWS - Научни и медицински писателски услуги, Франция.
- Функция на щитовидната жлеза и затлъстяване - FullText - European Thyroid Journal 2012, Vol
- Тайната за надхитряване на вашата психология на акне днес
- Тайният живот на мазнините от д-р Силвия Тара Преглед на книгата; Диета на кралица Ана
- Лечение на хроничен запек - еврейски вестник
- Тенденции в изчезването на мазнините в Съединените щати, 1909–65 The Journal of Nutrition Oxford Academic