Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
Катедра по приложна химия, Китайски аграрен университет, Пекин 100094, Китай
И двамата автори допринесоха еднакво за тази работа. Този автор е подкрепен от Китайския съвет за стипендии. Потърсете още статии от този автор
Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
И двамата автори допринесоха еднакво за тази работа. Потърсете още статии от този автор
Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
Катедра по приложна химия, Китайски аграрен университет, Пекин 100094, Китай
Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
Автора за кореспонденция. Факс: +1 773 702 0805. Потърсете още статии от този автор
Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
Катедра по приложна химия, Китайски аграрен университет, Пекин 100094, Китай
И двамата автори допринесоха еднакво за тази работа. Този автор е подкрепен от Китайския съвет за стипендии. Потърсете още статии от този автор
Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
И двамата автори допринесоха еднакво за тази работа. Потърсете още статии от този автор
Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
Катедра по приложна химия, Китайски аграрен университет, Пекин 100094, Китай
Катедра по химия, Чикагският университет, 929 East 57th Street, Чикаго, IL 60637, САЩ
Автора за кореспонденция. Факс: +1 773 702 0805. Потърсете още статии от този автор
Резюме
Генът за податливост на човешкото затлъстяване, FTO, кодира протеин, който е хомоложен на възстановяващия ДНК протеин AlkB. Протеините от семейство AlkB използват желязо (II), α-кетоглутарат (α-KG) и диоксиген за извършване на окислително възстановяване на алкилирани нуклеобази в ДНК и РНК. Тук демонстрираме окислителното деметилиране на 3-метилтимин (3-meT) в едноверижна ДНК (ssDNA) и 3-метилурацил (3-meU) в едноверижна РНК (ssRNA) чрез рекомбинантен човешки FTO протеин in vitro. Както човешките, така и мишите FTO протеини за предпочитане възстановяват 3-meT в ssDNA пред други тествани базови лезии. Те показаха незначителна активност срещу 3-meT в двуверижна ДНК (dsDNA). В допълнение, тези два протеина могат да катализират деметилирането на 3-meU в ssRNA с малко по-висока ефективност спрямо тази на 3-meT в ssDNA, което предполага, че метилираните РНК са предпочитаните субстрати за FTO.
1. Въведение
Алкилиращите агенти от околната среда или образувани вътре в клетките могат да атакуват N- или O-атоми на нуклеобази, което може да доведе до образуване на алкилиращи основни повреди, които изискват бърз ремонт [1]. Почти всички живи организми са разработили различни механизми за разпознаване и обработка на тези модификации. Сред тях директното отстраняване на алкилни адукти от повредените основи е една от най-ефективните стратегии за ремонт [2]. Семейството на протеини AlkB извършва този тип директен ремонт, като използва механизъм за окислително деметилиране (фиг. S1).
The Ешерихия коли Протеинът AlkB принадлежи към суперсемейство на α-кетоглутарат (α-KG) - и Fe 2+ -зависими диоксигенази [2-9]. Неговите хомолози се намират във вируси, бактерии и еукариоти. Въпреки че преди 2007 г. бяха идентифицирани осем човешки хомолога (ABH1‐8) [10, 11], само ABH2 и ABH3 бяха потвърдени, че имат подобна възстановителна функция като AlkB [4, 5, 12]. По-специално, беше установено, че ABH2 е отговорен основно за възстановяването на 1-метиладенинови (1-meA) базови лезии в геномна ДНК, докато точната роля на ABH3 остава неясна [13]. ABH2 предпочита двуверижни ДНК (dsDNA) субстрати пред едноверижни ДНК (ssDNA); въпреки това, както hABH3, така и AlkB са по-активни с ssDNA и едноверижни РНК (ssRNA) субстрати [4, 14]. Едва наскоро механизмите, залегнали в основата на субстратните предпочитания на тези протеини, бяха изяснени чрез рентгенови структурни изследвания на комплексите AlkB – dsDNA и ABH2 – dsDNA [15]. Протеинът ABH2 приема често наблюдаван механизъм за обръщане на основата с остатък от пръст, който се интеркалира вътре в ДНК дуплекса, за да запълни празнината, оставена от обърнатата основа [15]. Протеинът AlkB обаче изстисква ДНК дуплекса, за да елиминира празнината, оставена при обръщане на основата. Това изкривяване, наложено от AlkB върху ДНК, обяснява предпочитанието му към гъвкава ssDNA пред относително твърда дуплексна ДНК [15] .
И трите протеина проявяват най-висока активност срещу 1-meA и 3-метилцитозин (3-meC) [4-7], но с по-ниска активност те могат да обработват и 1-метилгуанин (1-meG) и 3-метилтимин (3 ‐MeT) [16, 17]. В допълнение е доказано, че AlkB, ABH2 и ABH3 възстановяват екзоциклични ДНК основни лезии: 1,н 6-етеноаденин (εA) и (или) 3,н 4-етеноцитозин (εC) [18-20] .
2. Материали и методи
2.1 Конструиране, експресия и пречистване на mFTO и hFTO
CDNA последователностите, кодиращи mFTO с пълна дължина (Image ID: 4237261) и hFTO (GenBank Accession No. NP_001073901.1) бяха субклонирани в pET28a, за да генерират His-маркиран слят протеин. Плазмидите се трансформират в Е. coli BL21 Star (DE3) и бактерии се отглеждат на LB-агарови плаки, съдържащи 50 mg/l канамицин. Прекултури за една нощ, които се отглеждат аеробно при 37 ° С със скорост на разклащане 190 rpm, се използват за инокулиране на 1 l LB среда с 50 mg/l канамицин и се отглеждат при 37 ° C и 250 rpm, докато OD600 достигне ~ 1,0. След това бактериалните клетки се индуцират от изопропил-β-d-тиогалактопиранозид (IPTG) (0.5 mM) при 15 ° C и се отглеждат една нощ при 15 ° C и 250 rpm. Клетките се събират чрез центрофугиране, замразяват се с течен азот и се съхраняват при -80 ° C. Всички следващи стъпки бяха извършени при 4 ° С. Клетъчните пелети бяха ресуспендирани в буфер А (50 тМ имидазол, 300 тМ NaCl, 50 тМ натриев фосфат, рН 8.0), обработени с ултразвук върху лед и центрофугирани при 12 000 об/мин за 22 минути. Филтрираният супернатант се пречиства чрез Ni-NTA хроматография (GE Healthcare). Фракциите, събрани от колоната, бяха допълнително пречистени с гел-филтрационна колона (GE Healthcare). Фракциите бяха анализирани чрез денатуриране на SDS-PAGE.
2.2 Ремонт на метилирана ДНК и РНК чрез mFTO и hFTO
Типичната реакционна смес (100 μl) съдържа ДНК/РНК (1 nmol), FTO (0,05–0,5 nmol), (NH4) 2Fe (SO4) 2 · 6H2O (283 μM), α-KG (300 μM), L‐ аскорбинова киселина (2 mM), говежди сериев албумин (BSA, 50 μg ml -1) и 50 mM 2‐ (н-Морфолино) буфер на етансулфонова киселина (MES) (рН 6,0). Това се инкубира в продължение на 12 часа при 16 ° С. Реакцията се прекъсва чрез добавяне на етилендиамин тетраоцетна киселина (EDTA) до 5 тМ.
2.3 Анализ на храносмилането с ограничителен ензим
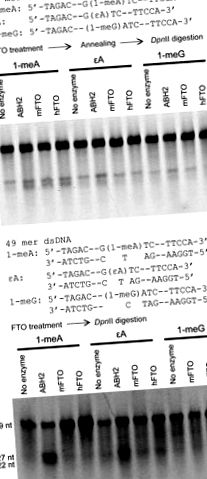
Следвана е по-рано публикувана процедура [13, 15] за оценка на възстановяването на 49-мерен олигонуклеотид, съдържащ 1-meA, 1-meG и εA в последователност на разцепване на DpnII. Последователността беше [5′ ‐ TAGACATTGCCATTCTCGATAGG (заменен от 1 ‑ meG) A (заменен с 1-meA или εA) TCCGGTCAAACCTAGACGAATTCCA ‐ 3 ′ допълващ 5 ′ ‑ TGGAATTCGTCTAGGTTTGACCGGATCCTATCGAGAATGGCAATGTCTA ‐ 3 ′]. Реакциите се провеждат при 37 ° С в продължение на 1 час и 16 ° С в продължение на 12 часа с 0.2 nmol FTO и 0.2 nmol субстрати. За ssDNA субстратите се отгряват към комплементарната верига за теста за храносмилане след инкубация с FTO протеин и кофактори.
2.4 ДНК/РНК разграждане и HPLC анализ
След реакцията на възстановяване, 15-мерна ssDNA/ssRNA се усвоява в нуклеозиди с нуклеаза P1 (Sigma, N8630) и алкална фосфатаза (Sigma, P4252), въз основа на предишна процедура [27]. Разтворът за смилане се анализира в изократна високоефективна течна хроматография (HPLC), оборудвана със сепарационна колона C18 (150 × 4.6 mm), уравновесена с буфер А (воден разтвор от HPLC, съдържащ 50 mM амониев ацетат) и буфер В (50 mM амониев ацетат, 50% ацетонитрил, 50% вода и 0,1% трифлуороцетна киселина (TFA)) при съотношение 95: 5 (v/v) със скорост на потока 1 ml min -1 при стайна температура. Дължината на вълната на засичане е зададена на 266 nm (за 3-meT) или 261 nm (за 3-meU).
2.5 Кинетика на mFTO и hFTO
За да се определи К m и К стойности на котката за възстановителните реакции, първоначалните скорости са получени чрез поддържане на ензимната концентрация постоянна и промяна на концентрацията на субстрата. Реакциите се коригират, за да се гарантира, че са изразходвани по-малко от 20% от субстрата. Всички реакции бяха проведени при 20 ° С в три екземпляра и анализирани от Origin 8.0 с уравнението на Michaelis-Menten.
3 Резултати и дискусия
MFTO с пълна дължина и hFTO бяха клонирани, експресирани и пречистени (фиг. S2). Приет е рестрикционен анализ за смилане на ендонуклеаза с използване на DpnII за оценка на възстановителните дейности както на hFTO, така и на mFTO към 1-meA, 1-meG и εA в ssDNA или dsDNA [13, 15, 28]. Модифицирана 49-мерна ДНК с 1-meA, 1-meG или εA, включена в последователността на GATC, е устойчива на разцепване на DpnII. Премахването на основната лезия чрез FTO позволява на DpnII да разцепи 49-метровата ДНК сонда на два фрагмента, осигурявайки анализ за възстановителната дейност (Фиг. 1). Както беше съобщено по-рано [21], установихме много ниска активност на двата протеина към възстановяване на 1-meA в 49-мерна ssDNA (фиг. 1А). И двата протеина не успяха да възстановят 1-meA в dsDNA (стехиометрично количество) след 12 часа инкубация при 16 ° C (фиг. 1В) или 1 h при 37 ° C (данните не са показани); като има предвид, че пречистеният ABH2 показа добри ремонтни дейности за 1-meA и εA в dsDNA при същите условия (фиг. 1В). Освен това не наблюдавахме забележима активност на mFTO или hFTO спрямо εA и 1-meG нито в ssDNA, нито в dsDNA. Основната лезия 3-meT, когато е включена в последователността на разцепване на DpnII, не може да блокира ензимното усвояване на ДНК сондата. По този начин е използван различен анализ за оценка на възстановяването на тази основна лезия.
За сондиране на 3-meT деметилиране от FTO протеини се синтезира и пречиства 15-мерна ssDNA [5′-CTTGTCA (3-meT) CAGCAGA-3 '] с 3-meT, включена в средата. Тази ДНК се усвоява в нуклеозиди чрез нуклеаза Р1 и алкална фосфатаза и впоследствие се анализира чрез HPLC. Както е показано на фиг. 2 А, нуклеозидите dC, dG, dT, dA и 3-medT могат да бъдат чисто разделени. Промяната в интензивността на 3-medT пика се наблюдава с други нуклеозидни пикове като вътрешни референции. 3-meT-съдържащата ssDNA се инкубира с mFTO или hFTO при 16 ° C в продължение на 12 часа. След гасене на реакцията, съдържанието на 3-meT беше измерено чрез анализ на храносмилането и HPLC анализ. Резултатите показват пълно деметилиране на 3-meT в ssDNA както от mFTO, така и от hFTO (фиг. 2А). Когато 15-мемерна 3-meC-съдържаща ssDNA беше подложена на същия тест за възстановяване, само ~ 15% от 3-meC беше деметилирана след 12 часа при същите условия (Фиг. 2Б), показвайки силно предпочитание на FTO протеините към 3 ‐MeT над 3 ‑ meC.
Въпреки това, почти незначителни дейности по деметилиране ([29] (фиг. S5) и 300 μM α-KG бяха избрани за по-нататъшни проучвания. След това бяха оценени профилите на pH-активност за деметилирането на 3-meT в ssDNA и 3‐ meU в ssRNA. В случая на mFTO се наблюдава намаляване на активността на деметилиране с увеличаване на pH както за ssDNA, така и за ssRNA субстрати (фиг. 3 A и B). Въпреки това hFTO проявява най-висока активност при pH 6.0 и за ssDNA и ssRNA субстрати (фиг. 3С и D). По този начин избрахме рН 6,0 за подробен кинетичен анализ.
Кинетичните проучвания са проведени при 20 ° C с различни концентрации на ssDNA или ssRNA субстрати. Резултатите са показани на фиг. 4 и обобщени в таблица 1. Протеинът mFTO показва по-висока активност към ssDNA и ssRNA субстрати, отколкото hFTO. Трябва да се отбележи, че този резултат може да не отразява in vivo дейностите на тези протеини, тъй като пречистеният рекомбинантен mFTO изглежда по-стабилен от пречистения рекомбинантен hFTO in vitro. Кинетичните проучвания разкриват, че както mFTO, така и hFTO показват двойно предпочитание към 3-meU в ssRNA като субстрат пред 3-meT в ssDNA. Експериментите бяха повторени в три екземпляра с получени подобни резултати.
| mFTO | ssDNA (3-меТ) | 1,92 ± 0,43 | 0,089 ± 0,008 | 0,046 ± 0,019 |
| ssRNA (3-meU) | 2,08 ± 0,31 | 0,199 ± 0,009 | 0,096 ± 0,029 | |
| hFTO | ssDNA (3-меТ) | 0,95 ± 0,12 | 0,007 ± 0,0002 | 0,007 ± 0,002 |
| ssRNA (3-meU) | 8,51 ± 3,13 | 0,115 ± 0,022 | 0,014 ± 0,007 |
В обобщение, това проучване установява за първи път активността на ДМК/РНК деметилиране на рекомбинантния hFTO (Фиг. 5). Както mFTO, така и hFTO не показват наблюдавана активност спрямо εA и 1-meG в ssDNA. За тези два протеина се наблюдава много ниска активност на деметилиране на 1-meA в ssDNA. Те също могат да катализират деметилиране на 3-meC в ssDNA, но с много по-ниска ефективност в сравнение с 3-meT в ssDNA. Както mFTO, така и hFTO не успяха да възстановят базовите лезии в dsDNA, което категорично предполага, че те участват в ssDNA или ssRNA обработка.
Важното е, че показахме, че както рекомбинантен hFTO, така и mFTO могат да деметилират 3-meU в ssRNA in vitro (Фиг. 5). РНК-деметилиращата активност на FTO протеина е малко по-ефективна от деметилирането на 3-meT в ssDNA, медиирана от същите протеини. Като се има предвид незначителното възстановяване на dsDNA субстрати от FTO протеините и техните леки предпочитания към 3-meU в ssRNA пред 3-meT в ssDNA, привлекателно е да се предложи FTO като РНК-деметилаза [21]. Може би катализира обратната реакция на неразпознато по-рано метилиране на РНК и упражнява функцията за генна регулация на ниво РНК. Нарушаването на тази регулаторна роля на FTO може да доведе до фенотип на затлъстяването, свързан с този протеин. Разбира се, за допълнително тестване на тази хипотеза са необходими подробни експерименти in vivo. Тази настояща работа служи като първата цялостна оценка на дейностите както на mFTO, така и на hFTO in vitro и предоставя основа за по-нататъшно проучване на ролята на тази много интересна деметилаза на нуклеинова киселина.
- Диета с единични съставки; sassyfitnesschick
- Простота на съставките - градински чай без глутен
- Изследване с единична възходяща доза на AMG 133 при пациенти със затлъстяване - изглед в пълен текст
- Изследване с единична и многократна възходяща доза на AMG 171 при пациенти със затлъстяване - изглед в пълен текст
- Оксидативен стрес, патологии, свързани със стареенето на плацентата и неблагоприятни резултати от бременността - Султана -