Yong-Jiang Li 1,2, Yang Zhang 2, Xiao-Xue Yin 3, Wen-Li Zhang 2, Chong-Qi Tu 2
Резюме: Рядко саркомите се развиват при предишни костни кисти, особено при прости костни кисти. Представяме първия доклад за случая, че остеосарком се е развил на мястото на предишна проста костна киста, която е била лекувана с кюретаж и костно присаждане без анамнеза за радиация. Основните механизми все още са неясни, с възможност за втори първичен остеосарком на същото място или злокачествена трансформация на предишния UBC. Като цяло това е много необичаен пациент с представяне на двете лезии и патогенезата все още трябва да бъде изяснена с повече случаи, които да бъдат докладвани в бъдеще.
Ключови думи: Остеосарком; еднокамерна костна киста; проста костна киста
Изпратено на 06 юли 2016 г. Прието за публикуване на 13 септември 2016 г.
Въведение
Простата костна киста (SBC), известна също като единична или еднокамерна костна киста, е леко експанзивна, доброкачествена литична костна лезия. Засяга най-вече деца и юноши с преобладаване на мъжете 2: 1. Може да бъде засегната всяка кост на крайниците, но най-често срещаните места са проксималната раменна кост и бедрената кост (1-3).
Злокачествените тумори, развити при предварително лекувана костна киста без анамнеза за радиация, са рядко клинично събитие, за което едва ли се съобщава в литературата. Общо са докладвани само пет случая (4-7) и четири от тях са имали първоначална лезия на аневризмална костна киста (ABC), трима пациенти са развили остеосарком и един пациент е развил недиференциран високостепенен плеоморфен саркома на костта (UHGPS). Съобщава се само за един пациент с първоначална лезия на SBC и след това се развива UHGPS на същото място (6). Патогенезата за образуването на злокачествено заболяване все още е противоречива. В някои виждания злокачествените тумори са възникнали поради злокачествена трансформация на предишните костни кисти. Тъй като обаче при тези случаи никога не е правена флуоресценция in situ хибридизация (FISH), все още не може да се изключи възможността костната киста да е вторична лезия от самото начало.
В доклада за случая представяме 23-годишен пациент, който е развил остеосарком на мястото на предишен SBC, който е бил лекуван с обширен кюретаж и костно присаждане без анамнеза за лъчетерапия. Пациентът беше информиран, че информацията относно неговия случай ще бъде представена за публикуване, и той даде съгласие.
Представяне на дело
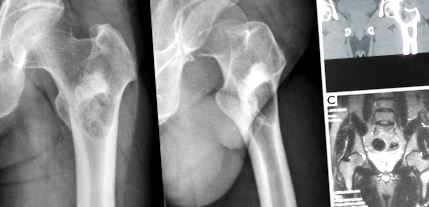
23-годишен мъж беше приет в нашата болница през септември 2011 г. поради лека болка в лявата коксофеморална област. Предни задни и странични рентгенови снимки (Фигура 1А) разкриват добре дефинирана литична лезия в интертрохантерната област на лявата бедрена кост, заобиколена от обвивка от склеротична кост. В близост до луцента беше представена сянка с висока плътност, което предполагаше засилен склеротичен процес на костите в областта. Компютърна томография (CT) (Фигура 1В) на лявата проксимална бедрена кост разкри радиолуцентна лезия в интертрохантерната област с ръб на кост, заобикалящ кистата. Не се наблюдава периостална реакция и не се представя маса на меките тъкани. Областта на сенките с висока плътност показва хомогенна ефективност на остеосклероза при CT изображения. Ядрено-магнитен резонанс (MRI) (Фигура 1C) показва хомогенен нисък до междинен T1 сигнал и висок T2 сигнал на лезията, с непрекъснат нисък сигнал на костната обвивка, която го заобикаля. Склеротичната област показва нисък сигнал T1 и T2 при ядрено-магнитен резонанс. Рутинните лабораторни тестове бяха в нормални граници.
Пациентът е опериран през октомври 2011 г. Направен е страничен прозорец, за да се разкрие лезията и в кухината на кистата е наблюдавана прозрачна жълта кистозна течност. Стената на кистата с тънка мембранна лигавица се вижда след изсмукване на кистозната течност. След това беше извършен обширен, щателен кюретаж, последван от разкъсване на полетата. За накисване на кухината на кистата се използва безводен алкохол. След това беше извършена автогенна имплантация на присадка на илиачна кост и вътрешна фиксация за възстановяване на дефекта (Фигура 2). Хистологичното изследване разкрива фиброваскуларна тъкан с фрагменти от незрели кости, мезенхимни клетки и от време на време лимфоцити и остеокласт-подобни гигантски клетки (Фигура 3). Резултатите от имунохистохимичното (IHC) оцветяване показаха: S-100 (-), CD1a (-), PCK (-), CK7 (-), AMACR (-), CD68 (PG-M1) пяна клетки (+). Поставена е патологична диагноза на SBC.
След операцията на кюретаж не се провежда друго адювантно лечение и раната зараства добре. Редовното проследяване до 22 месеца след операцията не открива никакви клинични или рентгенографски доказателства за рецидив. През август 2013 г. пациентът посети лекари поради постоянни болки в предишното хирургично място. Рентгенографиите разкриват повтаряща се остеолитична лезия на почти същото място на бедрената кост (Фигура 4). Остеолитичната област обаче беше значително по-голяма от предишната лезия и границите бяха неясни. Пациентът е хоспитализиран през септември 2013 г. и е извършена открита биопсия. Хистологичното изследване показва компонент на вретеновата клетка, произвеждащ остеоид с високостепенна хиперцелуларност, изобилни митотични фигури и подчертан ядрен плеоморфизъм (Фигура 5). Поставена е патологична диагноза остеосарком. За да се гарантира валидността на първоначалната диагноза SBC при предишната операция, патологичният отдел преразгледа патологичните тъкани при консултация с целия персонал. Окончателната патологична диагноза все още беше SBC.
Протоколът за химиотерапия на този пациент е засилен протокол за химиотерапия съгласно рандомизирано проучване фаза III на Европейската интерстероп група по остеосаркома (8), с общо 600 mg/m 2 цисплатин и 450 mg/m 2 адриамицин плюс гранулоцитна колония, стимулираща фактор (G-CSF), разделен на шест двуседмични цикъла на приложение (три дохирургични цикъла и три следхирургични цикъла). На пациента бяха дадени три цикъла на предоперативна химиотерапия, която продължи близо два месеца. През ноември 2013 г. е извършена широка резекция на тумора. Дефектът е реконструиран чрез изработена по поръчка протеза. Брутният външен вид е представен на фигура 6. След операцията пациентът е получил три допълнителни курса на химиотерапия. След приключване на следоперативната химиотерапия, пациентът има задоволителна функционална способност. При последното проследяване през май 2016 г. пациентът беше жив без данни за заболяване.
Дискусия
Развитието на злокачествена костна лезия на мястото на предварително лекувана костна киста без анамнеза за лъчетерапия е рядко клинично събитие, в литературата се съобщава само за пет пациенти (4-7). Сред тях ABC е първоначалната лезия при четирима пациенти, а само една предишна лезия на един пациент е SBC с UHGPS, разработен на същото място след това (6). Доколкото ни е известно, това е първият доклад за случая, че остеосарком се е развил на мястото на предварително лекуван SBC.
За пациента, описан в тази статия, съществуват няколко възможни механизма, които да обяснят развитието на последващия остеосарком. Първо, остеосаркомът може да бъде втори първичен тумор, който възниква de novo на същото място на предишния SBC. Тъй като остеосаркомът се е появил на предишното хирургично място, което е било лекувано с костно присаждане, може да е възможно присадената кост да допринесе за развитието на остеосарком. Въпреки че ролята не е ясно изяснена, тя може да бъде сравнима с тази злокачествена лезия, възникваща в зоната на костен инфаркт (9-11). И в двете ситуации репаративните и пролиферативни промени в границата на мъртва костна област могат да формират основата на образуването на злокачествен тумор (9). Предполага се, че дисбалансът в процеса на ремоделиране между клетките-предшественици и скелето, което осигурява триизмерна опора, е свързан със спонтанна злокачествена трансформация на клетките-предшественици (12). Както се предполага от лабораторни изследвания, триизмерно скеле, включително костно присаждане и инженерно скеле, може да формира нишата за мезенхимни стволови клетки (MSC) за развитие на тумори (12-14).
На второ място, остеосаркомът може да се развие от злокачествена трансформация на SBC. Кириакос и др. предположи, че за ABC, разнообразната клетъчна популация, включително пролифериращи фибробласти, остеобласти и клетки от остеокластен тип, поддържа възможността за злокачествена трансформация (7). По същия начин, различни клетки в мембранната лигавица и кистозната стена на SBC, като фибробласти, незрели остеокласт-подобни гигантски клетки и други мезенхимни клетки, също могат да служат като нидус за образуване на злокачествен тумор. Може да се сравни с това, че вторичните саркоми като вторичния хондросарком са възникнали поради злокачествена трансформация на остеохондрома (15). Репаративните микросреди и променящите се растежни фактори след първоначалния кюретаж и присаждане на кости също могат да повлияят на метаболизма на остатъчните SBC клетъчни компоненти и да допринесат за появата на злокачествен тумор (12).
За пациента, след обширен кюретаж на първоначалната лезия, цялата отстранена тъкан е била под хистологични изследвания. Установено е, че тъканта е типична за SBC, или при първоначалното изследване, или при повторното изследване при консултация с целия персонал на патологичния отдел и не са открити доказателства за злокачествено заболяване. Трябва да се спомене, че в сравнение с ABC, разграничаването между SBC и остеосарком е по-лесно за патолозите. Рядка форма на остеосарком, наречена нискостепенна аневризмална костна подобна на киста остеосарком, има напълно имитиращи хистологични характеристики на ABC (4,16,17), което може да затрудни диагнозата в някои случаи. Въпреки това, патологичната разлика между SBC и остеосарком е по-отчетлива, което може да е в състояние да потвърди, че първоначалната лезия, поне отчасти, е SBC.
Все още обаче не можем напълно да изключим възможността първоначалната лезия да съдържа остеосарком от самото начало и SBC да е вторична по отношение на злокачествената лезия. Появата на рентгенограмата на първоначалната лезия не беше много типична за SBC, поради склеротичен външен вид, непосредствено близо до зоната на луценсността. Освен това, склеротичната област е присъствала след кюретаж и присаждане на кости, което предполага, че кюретажът на проксималната част е вероятно непълен и че вземането на проби за биопсия на тази област е недостатъчно.
Но от друга страна, за SBC едва ли се съобщава, че е вторична по отношение на злокачествената лезия, докато понякога се установява, че ABC е вторичната лезия на саркоми (18-21) поради различните им механизми на патогенеза. Общоприето е, че SBC е причинен от фокален дефект в метафизарното ремоделиране, който блокира оттичането на интерстициална течност, като по този начин води до повишено налягане, фокална костна некроза и натрупване на течности (22-24); докато ABC е причинено от локално нарушение на кръвообращението, което води до повишено венозно налягане, локален кръвоизлив и производство на пълни с кръв кухини (25,26). Би било много необичайно, че SBC възниква като вторична лезия на остеосарком и е трудно да се обясни, че защо SBC, а не ABC, е вторична спрямо остеосарком, ако костната киста е вторична лезия. Не сме в състояние да проверим дали остеосарком е съществувал в първоначалната лезия, тъй като вземането на проби за биопсия на склеротичната област е било недостатъчно при този пациент и очаквахме това да бъде допълнително изяснено в бъдещи проучвания, когато подобна лезия бъде открита и докладвана в бъдеще.
В заключение съобщихме първия случай, че на мястото на предварително лекуван SBC се е развил остеосарком. Основните механизми все още са ядрени и трябва да бъдат допълнително изяснени с повече случаи, които да бъдат докладвани в бъдеще.
Благодарности
Авторите благодарят на персонала в катедрата по ортопедия, катедра по онкология и катедрата по патология, Западнокитайска болница, Университет Съчуан.
Бележка под линия
Конфликт на интереси: Авторите нямат конфликт на интереси, който да декларират.
Информирано съгласие: Писменото информирано съгласие е получено от пациента за публикуване на този доклад за случая и придружаващи изображения.
- Субхондрална костна киста Причини, лечение и симптоми
- Хранителни последици за качеството на живот при оцелелите от рак на пикочния мехур - Rosser - Translational
- Факти за картофеното хранене Ползите от Арен; t Just in the Peel Real Simple
- Оптимално място за измерване на централното затлъстяване за оценка на кардиометаболитния и риска от диабет тип 2 в
- Оптимизирайте диетата си с три прости съвета от Zack Harris Medium