Департамент по клинични науки, Малмьо, Клинично затлъстяване, Център за диабет в Лунд, Университет в Лунд, Швеция
Катедра по клинични науки Малмьо, Отделение за молекулярен метаболизъм, Център за диабет в университета в Лунд, Университет в Лунд, Швеция
Катедра по клинични науки Малмьо, Отдел за молекулярен метаболизъм, Университет в Лунд Диабет център, Университет Лунд, Швеция
Катедра по ендокринология, Университетска болница Сконе, Малмьо, Швеция
Катедра по клинични науки Малмьо, Отделение за молекулярен метаболизъм, Център за диабет в университета в Лунд, Университет в Лунд, Швеция
Катедра по ендокринология, Университетска болница Сконе, Малмьо, Швеция
Департамент по клинични науки, Малмьо, Клинично затлъстяване, Център за диабет в университета в Лунд, Университет в Лунд, Швеция
Steno Diabetes Center A/S, Gentofte, Дания
Департамент по клинични науки, Малмьо, Клинично затлъстяване, Център за диабет в Лунд, Университет в Лунд, Швеция
Департамент по клинични науки, Малмьо, Клинично затлъстяване, Център за диабет в Лунд, Университет в Лунд, Швеция
Катедра по клинични науки Малмьо, Отделение за молекулярен метаболизъм, Център за диабет в университета в Лунд, Университет в Лунд, Швеция
Катедра по клинични науки Малмьо, Отделение за молекулярен метаболизъм, Център за диабет в университета в Лунд, Университет в Лунд, Швеция
Катедра по ендокринология, Университетска болница Сконе, Малмьо, Швеция
Катедра по клинични науки Малмьо, Отделение за молекулярен метаболизъм, Център за диабет в университета в Лунд, Университет в Лунд, Швеция
Катедра по ендокринология, Университетска болница Сконе, Малмьо, Швеция
Департамент по клинични науки, Малмьо, Клинично затлъстяване, Център за диабет в Лунд, Университет в Лунд, Швеция
Steno Diabetes Center A/S, Gentofte, Дания
Департамент по клинични науки, Малмьо, Клинично затлъстяване, Център за диабет в Лунд, Университет в Лунд, Швеция
Агенции за финансиране: Това проучване е финансирано от Шведския изследователски съвет, Фондация Novo Nordisk, Фондация Crafoord, Фондация Университетска болница в Сконе, Фондация Albert Påhlsson, Фондация Lundberg, Асоциация за диабет в Малмьо, Регион Skåne, ALF, Фондация Magnus Bergvall, Fredrik и фондация Ингрид Тюрингс, фондация Боргстрьомс, фондация Ларс Хиерта и програмата за диабет в университета в Лунд.
Оповестяване: Авторите нямат конкуриращи се интереси.
Принос на автора: MR и AD са проектирали проучването. MR събра данните от участниците. NG и AD извършиха експериментите и анализираха данните. NG генерира таблици и фигури. PS, AD, HM и KF извършиха проучването върху слабата група, анализираха данните и написаха ръкописа. NG, MR, AD пише ръкописа. Всички автори одобриха окончателната версия.
Резюме
Обективен
Докато нарушеният глюкозен толеранс, диагностициран чрез орален глюкозен толерантен тест (OGTT), е често срещана черта при затлъстели индивиди, по-малко се знае за промени в нивата на други метаболити. Целта беше да се разкрият сложните промени в нивата на метаболитите, провокирани от OGTT и неговото смущение при затлъстели индивиди.
Методи
Използвана е газова хроматография/масспектрометрия за профилиране на нивата на метаболитите в серума от 14 участници със затлъстяване (индекс на телесна маса [BMI] от 43,6 ± 1,5 kg m −2 [средно ± SEM]) на 0, 30 и 120 минути по време на стандартен 2 ‐H 75 g OGTT. За сравнение бяха включени метаболитни профили от шест слаби индивида (ИТМ от 22,4 ± 2,4 kg m -2), събрани от предишно проучване.
Резултати
В групата със затлъстяване бяха определени 59 метаболитни профила. Сред тях 16 се отклониха от профилите в слабата група. Отклоняващите се метаболити са категоризирани в три групи. (1) Забавено намаляване на нивата на пет мастни киселини. (2) Повишени нива след 30 минути на пет аминокиселини, включително изолевцин и левцин. (3) Притъпено увеличение при 30 минути на шест метаболита.
Заключения
Метаболомичният анализ разкрива отчетливи разлики в промените в нивата на метаболитите по време на OGTT при затлъстели и слаби субекти. За тази цел нашите данни показват нарушена регулация на кетогенезата, липолизата и протеолизата при затлъстели индивиди.
Въведение
Затлъстяването е резултат от положителен енергиен баланс и често води до затруднения при поддържането на пост-абсорбционна евгликемия (1, 2). За някои затлъстели индивиди компенсаторното увеличаване на освобождаването на инсулин от β-клетките на панкреаса е достатъчно за поддържане на евгликемия (3). Недостатъчното инсулиново действие, било поради намалена инсулинова чувствителност или недостатъчно освобождаване на инсулин, води до нарушен глюкозен толеранс (IGT). Това е често срещана черта при затлъстяването (4), която често преминава към диабет тип 2 (T2D) (5). В клиничната практика способността за намаляване на пост-абсорбиращата кръвна глюкоза може да бъде оценена чрез орален тест за толерантност към глюкоза (OGTT). Докато и глюкозните, и инсулиновите профили, получени от OGTT, са добре проучени (6, 7), много по-малко се знае за профилите на метаболити, различни от глюкоза по време на теста.
Редица проучвания използват метаболомика, за да се изследва връзката между нивата на метаболитите на гладно и нарушената глюкозна хомеостаза (8-16). Тези проучвания разкриват повишени нива на аминокиселини с разклонена верига (BCAA; левцин, изолевцин и валин) при лица, които са изложени на риск от развитие на диабет (14), при тези с установен диабет (8, 15) и при наднормено тегло/затлъстяване субекти (8, 16). Метаболомиката е извършена и върху кръвни проби, получени по време на орално натоварване с глюкоза при здрави индивиди с нормално тегло (17-21) и при лица с наднормено тегло (21, 22). В тези проучвания очакваното провокирано от глюкоза и инсулин намаление на нивата на свободна мастна киселина (FFA) и аминокиселини е подробно описано при слаби пациенти с нормален глюкозен толеранс (17-19, 21). Освен това е наблюдавано притъпено намаляване на нивата на BCAA при пациенти с инсулинова резистентност (21, 22). Само едно от проучванията обаче изследва повече от две времеви точки по време на предизвикване на глюкоза (21) и само едно включва пациенти със затлъстяване със затлъстяване (22) .
Тук изследвахме метаболитните профили по време на OGTT при болни със затлъстяване и слаби индивиди. По-конкретно, ние имахме за цел да идентифицираме разликите между затлъстелите и слабите субекти. Това може да хвърли светлина върху сложната метаболитна дисрегулация, залегнала в основата на един от най-сериозните здравословни проблеми днес.
Методи
Проучвайте популация
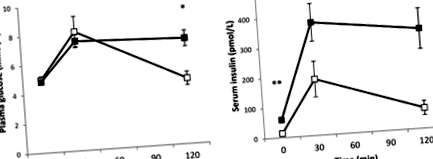
Проучването включва 14 участници със затлъстяване без диабет със среден индекс на телесна маса (ИТМ) от 43,6 ± 1,5 kg m -2 (средно ± SEM) от амбулаторното отделение за затлъстяване в отделението по ендокринология, Университетска болница в Сконе, Малмьо, Швеция. Кръвни проби след гладуване през нощта се събират от всеки индивид на изходно ниво и след това на 30 и 120 минути след перорален прием на 75 g глюкоза. Плазмената глюкоза се измерва с помощта на течен стабилен реактив Infinity Glucose Oxidase TM (Thermo Electron Corporation, Виктория, Австралия) и серумен инсулин, като се използва Coat-A Count Insulin RIA (DPC, Лос Анджелис, Калифорния). Измерванията на глюкозата и инсулина по време на OGTT от слаба и здрава група са получени от предишно проучване (17). Антропометричните и биохимични измервания за затлъстели и слаби участници са представени в таблица 1.
| Мъже жени | 3/11 | 4/2 |
| Възраст (y) | 36,6 ± 3,1 | 33,8 ± 6,9 |
| ИТМ (kg m -2) | 43,6 ± 1,5 | 22,4 ± 2,4 |
| Глюкоза на гладно (mmol l -1) | 4,8 ± 0,2 | 4,9 ± 0,3 |
| Инсулин на гладно (pmol l -1) **** | 59,3 ± 9,9 | 13,9 ± 2,0 |
| HOMA-IR **** | 2,1 ± 0,3 | 0,5 ± 0,1 |
| HOMA ‐ β *** | 222,9 ± 61,8 | 39,1 ± 9,6 |
| ISI **** | 6,6 ± 0,8 | 22,0 ± 4,5 |
| CIR * | 0,4 ± 0,1 | 0,1 ± 0,0 |
| DI | 2,2 ± 0,3 | 2,5 ± 0,4 |
Профилиране на метаболит
Статистически анализ
Резултати
Никой от участниците не е бил диабетик, но затлъстелите лица са били резистентни към инсулин в сравнение със слабите, както се преценява от HOMA-IR (Таблица 1). Затлъстялата и слаба група се различава по отношение на инсулиновата резистентност (HOMA-IR; P -1 при нормална концентрация на глюкоза на гладно от 4,8 ± 0,2 mmol L -1. И двете на гладно (P (17) .
Нива на глюкоза и инсулин по време на орален тест за толерантност към глюкоза. Глюкоза (A) и инсулин (Б.), измерено на 0, 30 и 120 минути при затлъстелите (▪) и слабите (□) субекти. Данните са средни ± SEM; *P
При метаболомичния анализ на проби от групата със затлъстяване са открити 301 предполагаеми метаболита, от които 59 са идентифицирани. Ясна класификация на пробите, събрани на 0, 30 и 120 минути, се наблюдава в графиката за разпръскване на резултатите от OPLS-DA, получена от данни от групата със затлъстяване (Фигура 2А). Следователно, нивата на метаболитите се променят систематично по време на OGTT. Впоследствие промените в нивата на метаболитите, които са в основата на класификацията на пробите в групата със затлъстяване (Фигура 2C), са нанесени в графики за начало-разпад. По този начин профилите на всички метаболити могат да бъдат описани само в две измерения. Динамичните промени в нивата на всички метаболити в групата със затлъстяване са показани в таблица 2. Нивата на седем метаболити не са засегнати от OGTT. Останалите 52 метаболита могат да бъдат разделени на 10 отделни групи въз основа на техния профил. Нива на по-голям брой метаболити (н = 34), представен предимно от FFAs и аминокиселини, намалява между 0 и 120 минути, нива от само няколко (н = 10) увеличен. Осем метаболити не показват нетно увеличение на нивата, но са били увеличени или намалени на 30 минути, преди да се върнат към изходното ниво на 120 минути (Таблица 2).
- Удебеленото лице показва значителна промяна (р (17) и 59-те метаболита, идентифицирани в групата със затлъстяване, 32 метаболита са общи за двата набора от данни. Графикът за разпръскване на резултатите от OPLS ‐ DA, получен от анализ на данни от слабата група (Фигура 2B) разкри по-хомогенно групиране в сравнение с данните от групата със затлъстяване (Фигура 2А). Освен това, графикът за начало-разпад за слабата група разкри големи промени в регулацията на множество метаболити (Фигура 2D) .Забележително, промени в FFAs, изолевцин и левцин се различават значително в регулацията.
Сред метаболитите, открити както в затлъстелата, така и в слабата група, профилите на OGTT на шест метаболита не се различават; нивата на пролин, триптофан, валин и треонин бяха преходно повишени на 30 минути, докато нивата на глицерол 3-фосфат и лизин бяха непроменени по време на OGTT. По-голямата част от метаболитите, които се различават между постно и затлъстяване (н = 16) може да се раздели на три групи (Таблица 3). В първата група нивата на пет FFAs показват забавено намаляване на затлъстяването в сравнение с постното; през първите 30 минути не е имало значително намаляване на нивата на FFA при затлъстелите (Таблица 3, горен раздел). Във втората група нивата на шест аминокиселини, включително BCAA изолевцин и левцин, показват ранно нарастване (при 30 минути) при затлъстелите; това не се наблюдава при постно (Таблица 3, средна част). В третата група нивата на смесена група метаболити се повишават на 30 минути при слаби индивиди, но това увеличение липсва при затлъстелите (Таблица 3, долна част).
-
Профилът на метаболита показва относителната промяна на концентрацията в три времеви точки (0, 30, 120 минути), илюстрирана с три точки и свързана с линия. Ъглов наклон между точките представлява значителен (P
Потискане на нивата на свободна мастна киселина и аминокиселини с разклонена верига по време на орален тест за толерантност към глюкоза. Намаляването на нивата на изолевцин и левцин спрямо намаляването на общото ниво на свободни мастни киселини в 2-часовия момент от теста за орален глюкозен толеранс в постно (н = 6) и затлъстелите (н = 14) субекти. Значителен (P
Дискусия
Повишените нива на BCAA заедно с диета с високо съдържание на мазнини преди са били свързани с развитие на свързана със затлъстяването инсулинова резистентност (35, 36). В момента се обсъжда дали повишените нива на BCAA са причина или ефект на инсулиновата резистентност при затлъстяване; малко е известно за действителната връзка между липидите и метаболитите на аминокиселините (37). Напоследък се съобщава, че повишените нива на BCAA и ароматните аминокиселини тирозин и фенилаланин са силно свързани с бъдещия риск от T2D (14); нивата на изолевцин, фенилаланин и тирозин са определени като основни предиктори за бъдещото развитие на T2D (14) .
В това проучване трябва да се признаят някои ограничения. Поради ограничения размер на извадката, проучванията за потвърждение трябва да включват по-големи групи. Няма съвпадение на групите по фактори, които биха могли да повлияят на резултатите от анализа, като възраст, пол, пушене и диета. Групите бяха твърде малки, за да оценят приноса на тези фактори. От друга страна, данните от метаболомиката на слаби индивиди се оказаха много последователни (12, 13, 16-22, 35) .
В заключение, идентифицирането на метаболити с отклоняващи се OGTT-профили е от потенциална стойност при оценката на смущението на метаболитната хомеостаза при затлъстяване. Отклоняващите се профили между затлъстели и слаби субекти осигуряват по-задълбочено разбиране на фенотипа със затлъстяване по отношение на липолиза, протеолиза, кетогенеза и деградация на нуклеотидите. По-специално, провокираното от глюкоза потискане на нивата на FFA е притъпено в групата със затлъстяване, но хомогенно и в двете групи, докато промените в нивата на BCAA са силно хетерогенни в групата със затлъстяване. Следователно, промените в нивата на BCAA могат да предоставят индивидуална информация, полезна за идентифициране на подгрупи в кохорта със затлъстяване.
Благодарности
Ние сме в дълг на учебните предмети за тяхното участие.
- Тест за орална толерантност към глюкоза за гестационен и диабет тип 2
- Сутрешният кортизол е по-нисък при лица със затлъстяване с нормален глюкозен толеранс
- Възстановяване на нормалния глюкозен толеранс при пациенти със силно затлъстяване след отклоняване на билио-панкреаса
- Плазмени инсулинови и глюкозни профили при вътрешни анали за хора със затлъстяване и диабет
- Пациент с глюкозна толерантност, нарушена преди диабет