Резюме
Заден план
Условията за производство на пилешко месо могат да варират по отношение на температурата или диетичното енергийно съдържание в сравнение с контролираната среда, където се извършва чистопороден подбор. Целта на това проучване беше да се разберат по-добре дългосрочните ефекти на 15% -енергийно изчерпана диета върху производството на яйца, енергийната хомеостаза и метаболизма чрез транскриптомен анализ на много тъкани. Изследването е предназначено да сравнява ефектите от хранителната намеса в двуслойни пилешки линии, дивергентно подбрани за остатъчен прием на фураж.
Резултати
Заключения
Наблюдавахме сложна модулация на транскриптом в хипоталамуса на пилето в отговор на нискоенергийна диета, предполагаща множество промени в синаптичната пластичност, ендоканабиноидната регулация, невротрансмисията, липидния метаболизъм, митохондриалната активност и синтеза на протеини. Това глобално транскриптомно препрограмиране може да обясни адаптивната поведенческа реакция (т.е. увеличаване на приема на фураж) на животните към нискоенергийното съдържание на диетата.
Заден план
Резултати
Диетичната промяна на енергията е оказала малък ефект върху производствените характеристики, но е повлияла на приема на фураж и телесния състав
Влиянието на линията, диетата и взаимодействието върху телесното тегло, производството на яйца и силата на черупката, приема на фураж (FI), остатъчния прием на фураж (RFI) и коремното мастно тегло след 14 седмици от нискоенергийната диета са обобщени в Таблица 1. разликата в енергийното съдържание няма ефект върху производството на яйца, т.е. върху скоростта на снасяне, теглото на яйцата и масата на яйцата. За разлика от това, наблюдавахме значително намаляване на телесното тегло на 31 седмица (средно за двете линии - 4,4%, стр Таблица 1 Средства (± SD) и значение за производството, ефективността на фуражите и характеристиките на телесния състав, за ефекта от диетата, линията и тяхното взаимодействие
Промяната на диетичната енергия води до транскриптомни модификации, главно в хипоталамуса и кръвта
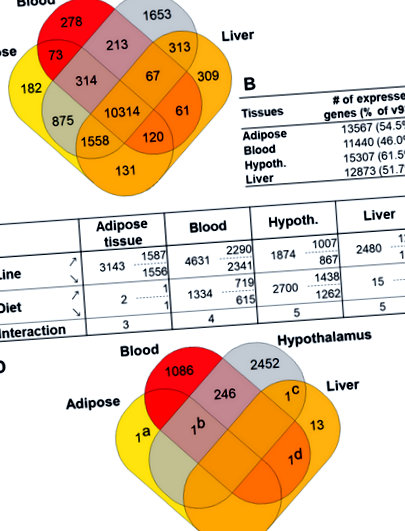
Преглед на генната експресия и диференциалната експресия между диетите в мастната тъкан, кръвта, хипоталамуса и черния дроб. а Диаграма на Вен на гените, изразени и споделени в четирите тъкани. б Общ брой гени, изразени във всяка тъкан; между скоби, процент на анотация v87 (24 881 гена). ° С Диференциално експресирани гени (DEG) във всяка тъкан (колони) и всеки фактор, линия, диета и взаимодействие (редове). Посочени са общият брой на DEG (вляво) и подробностите за броя на експресираните нагоре (↗) и надолу гени (↘) в диета LE (или R + линия) в сравнение с CT (до R-линия). Хипот .: Хипоталамус. д Диаграма на Вен на DEG между диетите в четирите тъкани. Единичните гени в диаграмата са: (a) ENSGALG00000002503 (SFTPA2) (b) ENSGALG00000031497 (без HGNC), (c) ENSGALG00000026507 (FDX1) и (d) ENSGALG00000006099 (ZFPM1)
Функционална характеристика на промените в хипоталамусния транскриптом при предизвикателство за диетична енергия
Сред 2700 DEG, открити в хипоталамуса в отговор на промяната на енергията в диетата, 1438 и 1262 гена са били свръх- и по-слабо изразени, съответно, в LE групата в сравнение с контролата. Охарактеризирахме тези два DEG списъка, използвайки обогатяване на термина на KEGG, както е описано в Методи. За свръх и недостатъчно изразените списъци с гени, 26 и 44 пътища (стрFDR Таблица 2 Топ 10 (въз основа на стрFDR) KEGG пътища, свързани с недостатъчно изразени (A) и свръхекспресиран DEG (B) в хипоталамуса
Пътищата, свързани с недостатъчно експресираните гени (Таблица 2А), включват 91 недостатъчно експресирани гени, свързани с различни видове синапси: глутаматергични, допаминергични и GABAergic синапси, както и цикъла на синаптичните везикули или аксона. Сред тези гени бяха по-специално GRIA1, GRIA3 и GRIA4 този код за субединици на глутаматния рецептор, преобладаващият възбуден невротрансмитер в нервната система; DDC, този код за ензим, участващ в синтеза на допамин, невротрансмитер, участващ в системата за възнаграждение, и DRD3 този код за субединица на допаминовия рецептор; GABRQ, GABRG2, GABRR2 този код за субединици на рецептора към гама-аминомаслената киселина (GABA), основният инхибиторен невротрансмитер.
Функционална характеристика на транскриптомичните промени в кръвта при промяна на енергията на диетата
Сред 1334 DEG, открити в кръвта в отговор на диетичната промяна, 719 и 615 гена са били свръх- и по-слабо изразени, съответно, в LE в сравнение с CT групата. KEGG характеризирането на свръх и недостатъчно изразените DEG списъци разкрива съответно 2 и 8 значително обогатени пътища (стрFDR Таблица 3 Пътища на KEGG, свързани с свръхекспресиран (A) и недостатъчно експресиран DEG (B) в кръвта
Пътищата, свързани с недостатъчно експресирани гени в кръвта, са свързани с „Метаболитни пътища“, по-специално биосинтеза на аминокиселини (ACO2, ALDH7A1, CPS1, CTH, ENO2, GOT1, PFKP, TALDO1, TKT, TPI1), метаболизъм на фруктоза и маноза (AKR1B1, AKR1B10, PFKFB4, PFKP, PMM2, TPI1) или метаболизъм на галактоза (AKR1B1, AKR1B10, GALK2, PFKP, PGM2). Гените, участващи в биосинтеза на холестерола, са били слабо изразени в кръвта (FDFT1, SQLE, CYP51A1, NSDHL и DHCR24) както при хипоталамуса. Двата пътя, свързани с свръхекспресираните гени, са „разграждане на РНК“, с EDC3, EXOSC5, PABPC1, PAN2, PAN3, PATL1, RQCD1, SKIV2L и TOB2, и „Ribosome“, който съдържа 3 RPL, 3 MRPL, 3 Ribosomal Protein Lateral Stalk Subunit P (RPLP)х) и 4 RPS гена, 11 от тези 13 гена също са свръхекспресирани в хипоталамус.
Откриване на ко-експресирани гени с WGCNA в списъците на DEG на хипоталамуса и кръвта
За да открием генни подмножества в нашите DEG списъци, използвахме пакета R WGCNA, за да идентифицираме и групираме съвместно експресирани генни модули (вж. Методи) Както е показано на фиг. 3, WGCNA се отделя за хипоталамус (фиг. 3а) и кръв (фиг. 3в) различни групи за ко-експресия (отбелязани с цвят) както за „LE> CT“ (в червено), така и за „LE CT“ DEG списък и червените и тюркоазените модули на синия „LE Фиг. 3
Анализ на WGCNA модули, получени за диференциално експресираните гени на хипоталамуса и кръвта. Йерархично групиране на собствените гени на модулите, открити с хипоталамус (а) и кръв (б) DEG. Цветовете на модулите са изчертани до имената на модулите, с броя на гените в модулите. Некластеризираните гени са в сивия модул. Полетата вдясно показват дали модулът съдържа свръхекспресирани (LE> CT) гени (червено) или недостатъчно изразени (LE CT DEG списък. ° С Топлинна карта на корелационната матрица между собствените модули. Обърнете внимание на отрицателната корелация (розови кутии) между лилавите и сините модули (Горна част) и тюркоазени и червени модули (отдолу). д Парцели от две двойки модулни собствени гени от DEG в кръвта. Горна част: модул лилаво срещу синьо от списъка LE CT DEG. Δdiet е разликата между средната стойност на LE спрямо средната стойност на CT (символизирана с празен кръг) за всеки ред
Фокус върху геномните региони, концентриращи диференцирано експресирани гени
Търсихме групи от три или повече DEG в непосредствена физическа близост (т.е. рамо до рамо) по протежение на генома, които имаха значителна двойна корелация на експресията (|r| > 0.7 & стрFDR - 4), предполагайки, че такива гени могат да бъдат съвместно регулирани от местен общ механизъм. Открихме две такива проксимални ко-експресирани генни групи в хипоталамуса (фиг. 4а и б), съставени от RPS6KA2, MPC1 и SFT2D1 за първия (фиг. 4а) и C1QA, C1QB и C1QC за втория (фиг. 4б), гени, които принадлежат към черния модул WGCNA, който е обогатен с гени, свързани с имунитета.
Геномна локализация и двойно разпръскване на експресия на четири групи ко-експресирани и ко-локализирани гени. Във всеки парцел, Горна част: геномна локализация на трите гена. Отдолу: двойно разпръснати експресионни (FPKM) гени. а клъстер, съставен от RPS6KA2, MPC1 и SFT2D1. б клъстер, съставен от C1QA, C1QB и C1QC
Дискусия
Слоевете от двете линии се адаптират към нискоенергийната диета, като увеличават приема на храна и променят динамиката на телесния резерв
Липсата на значителни разлики в производството на яйца (брой и тегло) между LE и CT групите предполага, че животните са успели да се адаптират към неоптимална диета. Адаптивните механизми, възприети от животните за компенсиране на намаляването на диетично-енергийното съдържание, включват увеличаване на приема на фураж и намаляване на коремната мастна тъкан. Увеличението на приема на фураж в отговор на 15% -енергийна диета в продължение на 14 седмици е в съответствие с резултатите от Grobas et al. [1] и Harms et al. [2]. Това повишено поглъщане обаче не позволи на слоевете от групата LE да компенсират напълно разликата в енергията (Таблица 1), както се вижда от значителната разлика в приема на енергия между групите на диетата. Намаляването на процента на теглото на мазнините до общото тегло, вероятно в резултат на тази непълна компенсация, е в съответствие с резултатите, съобщени от Murugesan и Персия [3], където слоевете са хранени с 3% -енергийно изтощена диета в сравнение с контролата над 11 седмици, въпреки че авторите не са наблюдавали модификация на приема на фураж, може би поради малката разлика в енергията между двете диети.
Липсата на значително взаимодействие с диета на ниво експресия съответства на отсъствието на взаимодействие на ниво черта, което означава, че както R +, така и R-птиците реагират на енергийно изчерпаната диета по подобен начин и със същия мащаб. На нивото на експресия, стойностите на Δ диета на фиг. 3д илюстрират това заключение: като пример, Δ диетата за гените, принадлежащи към лилавия модул, са подобни в двете линии, докато тези гени са по-изразени в R-, отколкото в R+.
Транскриптомите на черния дроб и мастната тъкан не са засегнати от нискоенергийната диета
Кръвните клетки участват в адаптацията към промените в диетата CT срещу LE
В хипоталамуса нискоенергийната диета изглежда променя общата синаптична организация, отчасти чрез модулация на холестерола и глобален протеинов синтез, свързан с мастните киселини β-окисление
Хипоталамовата арахидонова киселина може да участва в разликата в приема на фураж между LE и CT групи чрез механизми, включващи хипоталамусните ендоканабиноидни и комплементни системи
Предложен механизъм, водещ до повишен прием на фураж при LE диетата. Диетичните мастни киселини се обработват от FADS1, FADS2, ELOVL5 и FADS1, което води до производството на арахидонова киселина (АА). Арахидоновата киселина в крайна сметка води до производството на арахидоноил етаноламин (AEA), благодарение на действието на NAPE-PLD. AEA действа върху CB1R, което води до увеличаване на приема на фураж. FADS1 и 2: Дезатураза на мастни киселини 1 и 2, ELOVL5: Удължаване на много дълги вериги мастни киселини протеин 5, NAPE-PLD: N-ацил фосфатидилетаноламин фосфолипаза D, CB1R: канабиноиден рецептор 1, АА: арахидонова асфатинова киселина, арахидонови киселини, арахидонова киселина: N-арахидоноил фосфатидилетаноламин, AEA: арахидоноил етаноламин (псевдоним Анандамид)
Заключения
Методи
Животни и диета
Вземане на проби от тъкани
На 31 седмица бяха избрани осем животни от всяка линия (R- и R +) и от всяка диета (CT и LE) като представители на групата за клане, т.е. 8 × 2 × 2 = 32 животни. Слоевете бяха заклани в състояние на хранене чрез изрязване на врата и кървене, веднага след зашеметяване на главата. Веднага след клането се вземат проби от коремна мастна тъкан, крайникът на левия черен дроб и хипоталамус, които се замразяват в течен азот и се съхраняват при - 80 ° C до анализ. Кръвни проби от същите животни бяха събрани от тилния синус в EDTA епруветки и 100 μL кръв бяха отстранени и разредени в 1 mL реагент TRIzol® (Invitrogen, Калифорния, САЩ). След енергично разбъркване епруветката се поддържа при стайна температура в продължение на пет минути, след което бързо се замразява в течен азот и се съхранява при - 80 ° C до екстракция на РНК.
Събиране и анализ на чертите
Записани са седем признака, свързани с работоспособността и телесния състав за птиците 45 R + (34 CT и 11 LE) и 51 R- (36 CT и 15 LE). Броят на яйцата е регистриран от датата на първото яйце (около 21-седмична възраст) до 31-седмична възраст и степента на снасяне (т.е. броят на яйцеклетките, снесени по време на периода на запис, разделен на продължителността на периода в деня, изразен в%) беше изчислена; теглото на яйцата (g), статичната скованост (N. mm - 1) се изчисляват от 3 яйца на кокошка, събрани на 30-седмична възраст, и коремната мастна маса се претегля при клане. Седмичният прием на фураж се измерва в продължение на 4 седмици, от 27 до 31 седмична възраст и телесно тегло (g) на 31 седмична възраст. Остатъчният прием на храна е изчислен, както е описано в Bordas et al. [4]. Чертите бяха анализирани с R версия 3.4.2 [46]. Извършен е двупосочен вариационен анализ с линия, диета и взаимодействието между линия и диета като основни ефекти с помощта на функцията R lm и пакета R „кола“ [47].
Изолация на РНК
Приблизително 100 mg мастна тъкан и 30 mg черен дроб се хомогенизират в реагент TRIzol® (Invitrogen, Калифорния, САЩ) и цялата кръв, смесена с 1 ml TRIzol®, се регулира между 4 и 4,5 с 10 μL 5 N ледена оцетна киселина киселина [48]. След това общата РНК се екстрахира в съответствие с инструкциите на производителя, ресуспендира се в 50 μL вода без РНК и се съхранява при - 80 ° C. За хипоталамуса използвахме комплекта Allprep DNA/RNA (Qiagen). РНК се извлича от хипоталамуса съгласно инструкциите на производителя. Общата РНК се определя количествено със спектрофотометър NanoDrop® ND-1000 (Thermo Scientific, Illkirch, Франция). Качеството на РНК се контролира с помощта на биоанализатор Agilent 2100 (Agilent Technologies Франция, Massy, Франция). Средните числа на целостта на РНК са 7,3 ± 0,6 (средно ± SD) за мастната тъкан, 8,8 ± 0,48 за хипоталамуса, 8,2 ± 0,5 за цялата кръв и 9,2 ± 0,3 за черния дроб.
Придобиване на данни от RNA-seq
Секвенирането на сдвоени краища беше проведено на всички проби, използвайки система Illumina HiSeq3000 (Illumina, Калифорния, САЩ), с 2 × 150 bp. Библиотеките със средно вложка от 465 bp бяха подготвени в съответствие с инструкциите на Illumina чрез пречистване на поли-А РНК (TruSeq RNA Sample Prep Kit). Адаптери Illumina, съдържащи маркери за индексиране, бяха добавени за последваща идентификация на пробите. Пробите се амплифицират с PCR и след това се извършва количествена PCR за количествено определяне на библиотеката (QPCR NGS Library Quantification kit). Осем проби бяха запълнени в една лента в поточна клетка с 2 проби за всяка от четирите диетични групи ×, за да се сведе до минимум пристрастието между платна. След секвенирането индексираните адаптерни последователности бяха изрязани с помощта на софтуера CASAVA v.1.8.2 (Illumina). Получихме средно 90 милиона четения на проба (84 милиона за мастната тъкан, 98 милиона за кръвта, 86 милиона за хипоталамуса и 90 милиона за черния дроб), за общо 11 милиарда четения. За всяка извадка четенията бяха картографирани в Gallus gallus-5 референтен геном, използващ STAR v.2.3.0e [49]. PCR дубликатите бяха премахнати с помощта на rmdup инструмент от SAMtools suite [50]. За всяка проба беше извършено количествено определяне, използвайки RSEM [51] с анотацията Ensembl v93.
Анализ на RNA-seq данни
Всички анализи бяха извършени с R версия 3.4.2. За нормализиране на размера на библиотеката [52] беше използван методът на мащабиране на мащабиращата средна стойност на М-стойности (TMM) с помощта на пакета R/Bioconductor edgeR [53] версия 3.12.1. Във всяка тъкан експресираните гени бяха избрани, ако техните експресии на FPKM бяха над 0,1 в най-малко 80% от пробите на групова линия × диета (експресията на FPKM се получава след нормализиране на TMM, използвайки функцията “rpkm” от пакета edgeR). Анализът на диференциалната експресия беше извършен с помощта на пакета R/Bioconductor edgeR [53] на базата на обобщен отрицателен биномиален модел за напасване на модела. Използвахме метода “edgeR-Robust”, за да отчетем потенциални отклонения при оценка на параметрите на дисперсия на ген [54]. P-стойностите бяха коригирани за многократно тестване, използвайки подхода на Benjamini-Hochberg [55] за контрол на честотата на фалшивото откриване (FDR), и гените бяха идентифицирани като значително диференцирано изразени, ако стрFDR 0,7 и стрFDR - 4).
RT-qPCR анализ
Наличност на данни и материали
64-те проби RNA-seq са достъпни в Европейския нуклеотиден архив (ENA) чрез ENA сериен номер PRJEB28745.
- Изследване на ефектите от високо протеинова заместителна диета върху енергийния метаболизъм, метаболизма
- Изглежда, че диетата играе важна роля в отговор на MDedge имунотерапия срещу рак срещу PD-1
- Диетата и нейната превантивна роля при простатната болест - Резюме - Европейска урология 1999, кн
- Сравнение на диетите WW и диетата за бърз метаболизъм; Джоли Сю Буркхарт
- Енергийна диета - Eco Slim