От изследователския център за липиди, изследователски център CHUL (M.-CV, BL, SM, P.-JL, J.-PD), лаборатория за физическа активност (DP, CB) и отдел за изследване на диабета, изследователски център CHUL (AN), Laval University, Ste-Foy, Québec.
От изследователския център за липиди, изследователски център CHUL (M.-CV, BL, SM, P.-JL, J.-PD), лаборатория за физическа активност (DP, CB) и отдел за изследване на диабета, изследователски център CHUL (AN), Laval University, Ste-Foy, Québec.
От изследователския център за липиди, изследователски център CHUL (M.-CV, BL, SM, P.-JL, J.-PD), лаборатория за физическа активност (DP, CB) и отдел за изследване на диабета, изследователски център CHUL (AN), Laval University, Ste-Foy, Québec.
От изследователския център за липиди, изследователски център CHUL (M.-CV, BL, SM, P.-JL, J.-PD), лаборатория за физическа активност (DP, CB) и отдел за изследване на диабета, изследователски център CHUL (AN), Laval University, Ste-Foy, Québec.
От изследователския център за липиди, изследователски център CHUL (M.-CV, BL, SM, P.-JL, J.-PD), лаборатория за физическа активност (DP, CB) и отдел за изследване на диабета, изследователски център CHUL (AN), Laval University, Ste-Foy, Québec.
От изследователския център за липиди, изследователски център CHUL (M.-CV, BL, SM, P.-JL, J.-PD), лаборатория за физическа активност (DP, CB) и отдел за изследване на диабета, изследователски център CHUL (AN), Laval University, Ste-Foy, Québec.
От изследователския център за липиди, изследователски център CHUL (M.-CV, BL, SM, P.-JL, J.-PD), лаборатория за физическа активност (DP, CB) и отдел за изследване на диабета, изследователски център CHUL (AN), Laval University, Ste-Foy, Québec.
От изследователския център за липиди, изследователски център CHUL (M.-CV, BL, SM, P.-JL, J.-PD), лаборатория за физическа активност (DP, CB) и отдел за изследване на диабета, изследователски център CHUL (AN), Университет Лавал, Ste-Foy, Квебек.
Резюме
Липопротеиновата липаза (LPL) е важен ензим за хидролиза на богати на триглицериди липопротеини и нейната активност е в положителна корелация с нивото на HDL холестерол в плазмата. LPL ген ХинУстановен е dIII полиморфизъм във връзка с хипертриглицеридемия, 17 18 19 понижени нива на HDL холестерол, 20 повишени нива на апо В, 19 коронарна болест на сърцето (ИБС), 19 21 и някои характеристики на синдрома на инсулинова резистентност. Тъй като тези метаболитни усложнения също са характерни черти на висцералното затлъстяване, ние изследвахме възможността LPL-ХинdIII полиморфизмът може да участва във връзката на висцералното затлъстяване с плазмените концентрации на инсулин и липопротеин.
Методи
Субекти
Кохорта от бели мъже беше назначена за участие в проучвания, предназначени да изследват връзките между затлъстяването, разпределението на регионалната мастна тъкан (AT), измерено чрез CT, и нивата на липопротеините в плазмата. 11 Петдесет и двама субекта от тази кохорта се съгласиха да участват в това проучване, включващо ДНК анализ. Всички те са били непушачи и са без метаболитни нарушения, които изискват фармакологично лечение. Всички субекти са били заседнали и телесното им тегло е било стабилно по време на разследването. Изследването е одобрено от Етичния комитет за изследване на човека от университета Лавал.
ДНК анализ
Измервания на общата телесна мазнина
Плътността на тялото се измерва с хидростатична техника на претегляне. 23 Процентът телесни мазнини се изчислява от плътността, като се използва уравнението на Siri. 24 Мастната маса се получава чрез умножаване на процента телесни мазнини по телесно тегло. Белодробният остатъчен обем се измерва с метода на разреждане на хелий на Meneely и Kaltreider. 25 Обиколката на талията и ханша беше измерена чрез стандартизирани процедури, препоръчани от конференцията на Airlie. 26
Напречните секции на коремната подкожна и висцерална зона на AT се определят чрез CT със скенер на Siemens Somatom DRH, както е описано по-горе. 27 Накратко, субектите бяха изследвани в легнало положение с двете ръце, опънати над главата. CT сканирането се извършва на коремното ниво между четвъртия и петия лумбален прешлен, като се използва рентгенография на скелета като еталон, за да се установи позицията на сканирането с точност до милиметър. Общата и висцералната AT области бяха изчислени чрез очертаване на тези области с графична писалка и след това изчисляване на AT повърхностите чрез използване на обхват на затихване от -190 до -30 Hounsfield единици. 28 29 Абдоминалната висцерална AT зона беше измерена чрез изтегляне на линия в мускулната стена, заобикаляща коремната кухина.
Тест за орална толерантност към глюкоза
Тест за толерантност към глюкоза от 75 g (OGTT) се извършва сутрин след гладуване през нощта. Кръвни проби се събират през венозен катетър от предтекубитна вена на 15 минути преди и на 0, 15, 30, 45, 60, 90, 120, 150 и 180 минути след поглъщане на глюкоза за определяне на плазмените концентрации на глюкоза и инсулин. Плазмената глюкоза се измерва ензимно, 30 докато плазменият инсулин се измерва чрез радиоимуноанализ с разделяне на полиетилен гликол. 31 Плазмените глюкозни и инсулинови области под кривата по време на OGTT се определят по трапецовидния метод.
Измервания на плазмен липопротеин
Кръвни проби бяха получени сутрин след 12-часово гладуване от антекубитална вена във Vacutainers (Becton Dickinson), съдържащи EDTA. Нивата на холестерола и триглицеридите в плазмените и липопротеиновите фракции се измерват ензимно на анализатор RA-1000 (Technicon Instruments Corp). VLDL (д 32 и HDL фракцията се получава след утаяване на апо В-съдържащи липопротеини в инфрарананта (д> 1.006 g/ml) с хепарин и MnCl2. 33 Съдържанието на холестерол в подфракциите на HDL2 и HDL3 се определя след утаяване на HDL2 с декстран сулфат. 34 Концентрациите на Апо В и LDL – апо В са измерени в плазмата и инфрантанта, (д> 1.006 g/mL), съответно, чрез използване на ракетен имуноелектрофоретичен метод на Laurell 35, както е описано по-горе. 36
AT биопсии и AT LPL активност
Подпроба от двадесет и пет субекта даде своето информирано съгласие за АТ биопсии. Приблизително 500 mg AT бяха отстранени по хирургичен път с локална анестезия от коремните (странично до пъпа) и бедрените (предната средна част на бедрото) мастни депа. AT пробите се държат замразени при -80 ° C за по-късни измервания на освобождаващата хепарин активност 37, както е описано по-горе. 38 Друга проба от AT се усвоява с колагеназа, 39 и се измерват изолирани адипоцити, за да се определи средният размер на мастните клетки. 40 Плътността на триолеин се използва за трансформиране на обема на AT клетки в тегло на мастните клетки. AT LPL активността се изразява в микромоли свободна мастна киселина на час на 106 клетки.
Активност на плазмения постхепарин LPL
След 12-часово гладуване кръвта се събира от субекти 10 минути след инжектиране на хепарин (10 IU/kg телесно тегло IV). Анализите за ензимна активност се извършват с модификация на метода на Nilsson-Ehle и Ekman, 41, както е описано по-горе. 42 Накратко, плазмената LPL активност се измерва чрез използване на глицерол три [14 С] олеат като субстрат в изкуствена емулсия, приготвена в 0,1 mol/L Tris-HCl буфер (pH 8,0), съдържащ Triton X-100, и делипидираните проби от човешки серум се инкубират при 30 ° С в продължение на 20 минути в присъствието или отсъствието на 1.0 mol/L NaCl. Свободните мастни киселини, освободени по време на инкубацията, бяха селективно извлечени и аликвотна част беше преброена за 14 С радиоактивност. LPL активността се изчислява като липазната активност, чувствителна на 1.0 mol/L NaCl от общата липазна активност (без NaCl). Активността на LPL се изразява като наномоли олеинова киселина, освободени на милилитър плазма в минута.
Статистически анализ
Резултати
Петдесет и двама субекта бяха анализирани за LPL-ХинdIII полиморфизъм. Относителните честоти на алелите бяха съответно .24 и .76 за алела - (неносещ на мястото на рестрикцията) и + алела. Субектите бяха класифицирани в две групи: (1) тези, които бяха хетерозиготни за ХинdIII полиморфизъм (+/− група, n = 23) и (2) тези, които са били хомозиготни за алела + (+/+ група, n = 28). Един субект, който беше хомозиготен за алела - беше изключен от анализ. Характеристиките на субектите съгласно генотипа LPL са представени в таблица 1. Двете генотипни групи бяха сравними по възраст, ИТМ, мастна маса, съотношение между талията и ханша, висцерални зони на AT, инсулин на гладно и глюкоза и области на инсулин по време на OGTT. Резултатите от таблица 2 не показват разлика в плазмените нива на липопротеините между двете групи.
Подобни анализи бяха извършени и за съотношението холестерол към HDL холестерол (не е показано). Не се наблюдават значителни разлики между четирите подгрупи въз основа на нисък или висок ИТМ. Висцералното затлъстяване има тенденция да бъде свързано с по-високо съотношение на холестерол към HDL холестерол в присъствието на +/+ генотипа, докато при +/− субектите с високи или ниски висцерални AT области не могат да различават между висок и нисък холестерол -към – HDL съотношение на холестерола. И накрая, при двете групи с високи нива на инсулин се наблюдава по-високо съотношение на холестерол към HDL холестерол, което предполага, че тази връзка може да е независима от ХинdIII генотип.
Въпреки че LPL полиморфизмът се идентифицира с ХинdIII се открива в некодираща ДНК последователност (интрон 8) на гена, тествахме дали ще повлияе на AT и постхепариновите LPL активности (Таблица 3). Не са открити значителни разлики между двата генотипа, което предполага, че наличието или отсъствието на ХинdIII рестрикционното място не променя активността на плазмата и AT LPL. Когато се образуват подгрупи въз основа на нисък и висок ИТМ, висцерални зони на AT и инсулин на гладно, не се наблюдават значителни разлики между подгрупите за активност на AT и постхепарин LPL (данните не са показани).
Дискусия
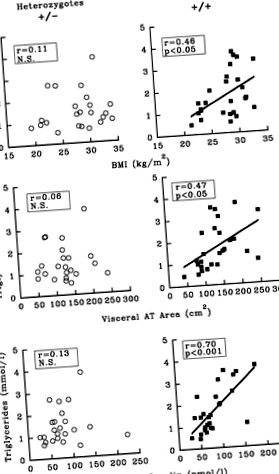
+ /+ ХинdIII генотипът променя връзката между ИТМ, инсулинемия и висцерално затлъстяване с нивата на триглицеридите на гладно, тъй като са открити значителни корелации само в групата +/+. По същество подобни резултати са наблюдавани, когато плазменият HDL2 холестерол се използва като зависима променлива. Тези ефекти върху нивата на триглицеридите и HDL2 холестерола са в съответствие с хипотезата за физиологичната роля на LPL, която не само хидролизира богатите на триглицериди липопротеини, но и модулира плазмените нива на HDL. Няколко метаболитни и експериментални проучвания показват, че високата LPL активност обикновено се свързва с високите плазмени нива на HDL, особено субфракцията на HDL2. 49 Поради тези причини не е изненадващо, че триглицеридите и HDL2 холестеролът са били променени по взаимен начин, но нашите резултати подчертават, че степента на този ефект е много по-голяма при хомозиготния +/+ генотип.
LPL-ХинdIII полиморфизмът се намира в интрон 8 на гена LPL и следователно не трябва да бъде свързан с разлики в ензимната активност и теоретично, не трябва да е причина за наблюдаваните ефекти. Съответно, бедрената и коремната активност на AT LPL не се различават между двата генотипа; LPL активността на постхепарин в плазмата също е сходна в двете групи. По този начин е вероятно LPL-ХинdIII полиморфизмът е в неравновесие на връзката с функционална мутация в гена LPL или в друг ген, който може да предразположи индивидите към дислипидемия. В допълнение, наблюдаваният ефект може да се дължи и на различия в регулацията на гена LPL между двата генотипа. Инсулинът е важен регулатор на LPL ензима и този хормон може да регулира LPL на ниво mRNA 50 и/или посттранскрипционно ниво 51. Например, алелът + може да бъде свързан с функционален LPL ензим, който е по-малко чувствителен към инсулин и може да доведе до намален отговор на LPL към инсулин при висцерално затлъстяване. Други посредници също могат да участват в посредничеството на описаните тук ефекти.
В заключение, тези резултати показват, че дислипидемията, свързана с абдоминално висцерално затлъстяване, особено плазмени триглицериди и HDL2 холестерол, може да бъде модулирана в значителна степен чрез вариация в гена LPL, въпреки липсата на ефект върху измеримата активност на LPL. По този начин, този LPL полиморфизъм може да се разглежда като друг генетичен маркер, който влияе върху плазмените нива на липопротеините и вероятно риска от ИБС по отношение на нивото на висцералната мастна тъкан. Очевидно ще е необходимо да се изследват взаимодействията между няколко кандидат-гена за правилна оценка на риска от ИБС. Необходими са обаче проучвания, базирани на големи кохорти, за да се изследват дори прости взаимодействия между гени апо Е, апо В и LPL.
Фигура 1. Скатерни графики, показващи корелации между индекса на телесна маса (ИТМ), площта на висцералната мастна тъкан (AT), измерена чрез компютърна томография, нивото на инсулин в плазмата на гладно и концентрацията на триглицериди в плазмата на гладно при групи мъже, определени въз основа на липопротеиновата липаза (LPL) -ХинdIII генотип. Хора, хомозиготни за алела + (алел, отрязан от рестрикционния ензим ХинdIII) бяха включени в групата +/+ (n = 26), докато субектите, хетерозиготни за алела - (не ХинdIII ограничителен сайт) са включени в групата +/− (n = 23).
Фигура 2. Скатерни графики, показващи корелации между индекса на телесна маса (ИТМ), площта на висцералната мастна тъкан (AT), измерена чрез компютърна томография, нивото на инсулин в плазмата на гладно и концентрацията на HDL2 холестерол в плазмата при двете групи мъже, подразделени на базата на тяхната липопротеинова липаза (LPL) -ХинdIII генотип (n = 20 и 25 съответно за +/− и +/+ генотипите).
Фигура 3. Стълбовидни графики, показващи сравнение на плазмените нива на триглицеридите във всяка липопротеинова липаза (LPL) -ХинdIII генотип между мъже с нисък срещу висок индекс на телесна маса (ИТМ), нисък срещу висок инсулин на гладно и нисък спрямо висок висцерален мастна тъкан (AT). Средната стойност на разпределението на инсулина в общата група е използвана за определяне на субекти с ниски или високи нива на инсулин. Числото във всяка лента идентифицира всяка подгрупа, докато числото над SE показва значителна разлика със съответната група (P≤.05). Броят на участниците във всяка подгрупа (отляво надясно) е n = 7, 16, 8 и 18 за ИТМ; n = 7, 16, 9 и 17 за висцерална AT зона; и n = 11, 12, 11 и 15 за нивото на инсулин на гладно.
маса 1. Антропометрични и метаболитни характеристики на двете групи мъже, дефинирани въз основа на липопротеинова липаза (LPL) -ХинdIII Полиморфизъм
Резултатите са средни ± SD.
Таблица 2. Плазмени нива на липидите и липопротеините в двете липопротеинови липази (LPL) -ХинdIII генотипни групи
Резултатите са средни ± SD; брой предмети са в скоби.
Таблица 3. Липопротеинова липаза (LPL) Дейности в подгрупи на мъже, определени въз основа на LPL-ХинdIII Генотип
Данните са средни ± SD; брой предмети са в скоби.
Това проучване беше подкрепено от Медицинския съвет на Канада (MRC), Фондацията за сърдечни и инсулти в Канада и Канадската асоциация за диабет. M.-C. Vohl и B. Lamarche получиха MRC стипендии по време на това проучване. Авторите искат да изкажат своята благодарност на изследователския персонал, участващ в събирането на данните. Приносът на персонала на Центъра за изследване на липиди, Отдел за изследване на диабета и Лаборатория за физическа активност е признат.
- Витамин С инхибира хипертрофия на висцералните адипоцити и намалява нивата на кръвната глюкоза в
- Ултразвукова оценка на подкожната и висцералната коремна мастна тъкан като предиктор за гестация
- Какво ядете, за да увеличите енергийните си нива
- Ефикасността на плазмената коагулация на аргон спрямо карведилол за лечение на портален хипертоник
- Нива на затлъстяване в САЩ по държави - затлъстяване