1 Лаборатория по биологична химия и хранене, Медицински факултет, Université libre de Bruxelles, 1070 Брюксел, Белгия
Резюме
Грелинът е естественият лиганд на рецептора на секретагога на растежния хормон (GHS-R1a). Грелинът е 28 аминокиселинен пептид, притежаващ уникално ацилиране върху серина в позиция 3, катализиран от грелин О-ацилтрансфераза (GOAT). Грелинът стимулира секрецията на растежен хормон, но също така и апетита, приема на храна, наддаването на тегло и изпразването на стомаха. Грелин участва в регулирането на теглото, затлъстяването, диабет тип 2 и метаболитния синдром. Освен това, по-доброто разбиране на биологията на грелин доведе до идентифициране на молекулярни цели, модулиращи нивата на грелин и/или неговите биологични ефекти: GOAT, грелин и GHS-R1a. Освен това, скорошно откритие, показващо участието на рецептора на горчив вкус T2R в секрецията на грелин и/или синтеза и приема на храна, предполага, че T2R може да представлява допълнителна интересна молекулна цел. Няколко класа фармакологични инструменти, свързани с грелин, за лечение на затлъстяване са разработени или биха могли да бъдат разработени за модулиране на идентифицираните молекулни цели.
1. Въведение
Грелин, естественият лиганд на рецептора на секретагога на растежния хормон (GHS-R1a) [1], е мощен стимулатор на секрецията на растежен хормон [2, 3]. Освен това грелинът също е хормон, стимулиращ апетита, предизвикващ прием на храна и увеличаване на теглото при хора [4–6] и насърчава изпразването на стомаха [7]. Грелинът е 28 аминокиселинен пептид, произведен предимно и секретиран в кръвния поток от ендокринните стомашни лигавични клетки, наречени „X/A подобно“ при плъхове [8, 9] и P/D1 клетки при хора [10]. Грелин има особеността да бъде ацилиран върху серина в позиция 3 [1]. По време на обработката на прегрегрелин могат да се получат както грелин 1-28, така и грелин 1-27 и след това се подлагат на ацилиране на хидроксилната група на Ser3 [11]. Ацилирането, уникална пептидна модификация, се катализира от грелин О-ацилтрансфераза, член на свързаната с мембраната О-ацилтрансферазна фамилия, по време на обработката на пептида [2, 3]. Най-често ацилирането е с октаноилова група (C8: 0) и по-рядко с деканоилна (C10: 0) или деценоилна (C10: 1) група [11]. Ацилирането на грелин може да се увеличи чрез поглъщане или на средно-верижни мастни киселини, или на средно-верижни триацилглицериди [12].
Прилагането на грелин при плъхове води до стимулиране на приема на храна и намаляване на енергийните разходи, което води до увеличаване на телесното тегло [6, 22–25]. Интравенозното приложение на грелин при хора също повишава апетита и стимулира приема на храна [6]. Плазмените нива на грелин са в отрицателна корелация с ИТМ и варират по компенсаторен начин спрямо вариациите в телесното тегло [26]. Всъщност нивото на грелин в плазмата се повишава при нервна анорексия и кахексия и намалява при затлъстяване [27]. Нивата на грелин намаляват с увеличаване на теглото в резултат на прехранване [28], бременност [29], лечение с оланзапин [30] или диета с високо съдържание на мазнини [31]. Централното приложение на грелин при плъхове, подложени на диета с високо съдържание на мазнини, не води до по-голям прием на храна, докато се наблюдава повишено затлъстяване в бялата мастна тъкан [32]. В бялата мастна тъкан грелинът стимулира генната експресия на липогенни ензими като стеароил КоА десатураза, ацетил КоА карбоксилаза и синтаза на мастни киселини. Тези данни показват, че централният грелин едновременно регулира приема на храна и метаболизма на мастната тъкан чрез различни механизми [32].
Острият отговор на храненето изглежда е медииран от GHS-R1a [33]. Ефектът на хроничното наддаване на тегло от грелин може да бъде модулиран както от GHS-R1a [34], така и от все още неидентифициран рецептор за грелин, тъй като както грелинът, така и антагонистът на грелин, увеличават телесното тегло [35]. Въпреки това ще бъдат необходими допълнителни проучвания за изясняване на този въпрос.
Дезацил грелинът наскоро беше взет под внимание като модулатор на приема на храна, който може да действа чрез все още неидентифициран рецептор [36, 37]. Изглежда обаче, че дезацил грелинът има противоречиви ефекти върху приема на храна [36, 37]. В действителност, нокаутиращите мишки GOAT показват намалена мастна маса, въпреки повишените нива на дезацил грелин [38]. Идентифицирането на спекулираните дезацилни грелинови рецептори може дълбоко да увеличи знанията ни относно механизмите и действията на този пептид.
Съобщава се за високи плазмени нива на грелин при пациенти със синдром на Prader-Willi (PWS), генетично заболяване, характеризиращо се с умствена изостаналост и хиперфагия, водещо до тежко затлъстяване [39, 40]. При това разстройство грелинът може да бъде отговорен поне частично за ненаситния апетит и затлъстяването на пациентите.
От молекулно-биологична гледна точка е интересно да се отбележи, че както грелинът, така и неговите рецепторни (GHSR) гени са разположени в хромозома 3 в региони, които са свързани със затлъстяването [41, 42]. Полиморфизмите както на грелин, така и на неговия рецептор GHSR1a са изследвани при затлъстяване [43-52]. Необходими са обаче допълнителни проучвания, за да се оцени недвусмислено функционалното значение на тези мутации в патогенезата на затлъстяването.
Поради наблюдаваната връзка между плазмените нива на грелин и нивата на инсулин, както и инсулиновата резистентност [53–56], се предполага, че инхибирането на секрецията на грелин и/или на GHS-R1a може да бъде полезно лечение и/или превенция за тип 2 диабет. В това отношение наскоро бяха прегледани данни от множество проучвания, оценяващи терапевтичните последици от грелин върху глюкозо-инсулиновата хомеостаза [57, 58].
Участието на грелин в затлъстяването доведе до разработването на няколко свързани с грелин фармакологични инструменти за лечение на затлъстяване. Настоящият преглед се фокусира върху скорошния напредък, постигнат в потенциалните клинични приложения на грелин при затлъстяване.
2. Грелин О-Ацилтрансфераза: Фармакологична цел за намаляване на нивата на ацилиран грелин
GOAT е силно хидрофобен протеин с осем постулирани спирали, обхващащи мембраната, представящи висока степен на запазване на последователността при гръбначните животни. GOAT се експресира съвместно с ацил грелин в тъкани, експресиращи грелин [59]. GOAT показва предпочитание към хексаноил-КоА пред октаноил-КоА като ацил донор [60]. Точният механизъм, водещ до навлизането на ацили-CoA в лумена на ендоплазмения ретикулум, остава неизвестен. Една от хипотезите е, че GOAT може да свърже ацил-CoA и поради хидрофобните си свойства да позволи ацилирането на грелин в лумена на ендоплазмения ретикулум.
Биохимичен анализ in vitro за GOAT активност [3] разкрива важността на правилното разпознаване на няколко аминокиселини в прогрелин (глицин-1, серин-3 и фенилаланин-4) за GOAT активност [61].
Гладуването и засищането могат да модулират активността на GOAT, тъй като нивата на грелин се повишават преди хранене [4, 62] и намаляват с приема на храна [5]. Освен това, продължителното гладуване инхибира ацилирането на грелин, но не и общата секреция на грелин, докато храненето потиска както ацилния, така и дезацилния грелин [63]. Въпреки това, ефектът от гладуването и храненето върху нивата на иРНК на GOAT остава неясен [38, 64]. Експериментални доказателства показват, че GOAT е ген, регулиран с лептин [38]. Повишените нива на иРНК на GOAT в отговор на дългосрочно хронично недохранване [64] могат да представляват основния механизъм, отговорен за повишените нива на ацилиран грелин в анорексия нервна [26].
Диетичните липиди са от решаващо значение за активирането на GOAT и следователно ацилирането на грелин. Всъщност нокаутираните мишки на GOAT, подложени на диета, съдържаща 10% триглицерид със средна верига, показват по-ниско телесно тегло, което може да се обясни с по-ниска мастна маса в сравнение с мишки от див тип [38]. В допълнение, трансгенните мишки на GOAT, хранени само със средноверижни добавки с триглицериди, произвеждат големи количества ацил грелин [38].
Съществена функция на грелина може да бъде поддържането на жизнеспособност по време на глад. Тази хипотеза се подкрепя от данните, показващи, че нокаутираните мишки от див тип и GOAT, подложени на 60% диета с ограничено съдържание на калории, показват съответно 30% и 75% загуба на телесно тегло [65].
Остава да се свърши много работа, за да се разбере напълно как GOAT се вписва в контрола на енергийната хомеостаза. Въпреки това, измерването на нивата на GOAT протеин и активността на GOAT ще бъде от решаващо значение за определяне на неговата генна експресия и функционална регулация. В действителност, нокаутираните мишки GOAT представляват ценен инструмент за определяне на физиологичните последици от специфичен дефицит на ацилиран грелин.
Наскоро беше предположено, че генетичните вариации на GOAT са включени в етиологията на анорексия нервоза [66]. Би било интересно да се определи дали генетичните вариации на GOAT също могат да бъдат свързани със затлъстяването. Ако това се окаже така, персонализираната медицина, насочена към GOAT, може да се разглежда като нов терапевтичен подход за лечение на затлъстяването.
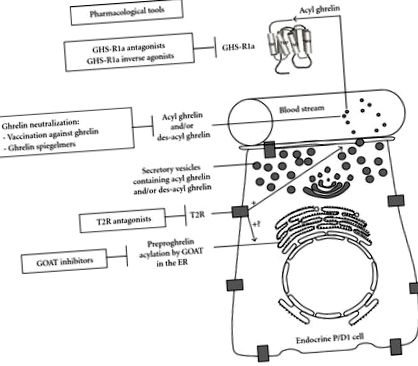
Разработени са фармакологични инструменти, насочени към инхибиране на GOAT (Фигура 1). В действителност, пентапептид, съответстващ на първите пет N-крайни аминокиселини на грелин с неговия С-краен край, амидиран конкурентно инхибира GOAT активността чрез механизъм за инхибиране на крайния продукт. Инхибирането на GOAT се постига по-добре, когато пентапептидите съдържат октаноилова група, свързана със серин-3 чрез амидна връзка [3]. Освен това GOAT също се инхибира от аналог на бисубстрат на основата на пептид, GO-CoA-Tat, в култивирани клетки, както и при мишки [67]. Дизайнът на този аналог на бисубстрат се основава на теорията, че GOAT може да използва трикомпонентен сложен механизъм, за да премине към свързването на октаноил-CoA с грелин. Интраперитонеалното приложение доведе до намалено наддаване на тегло и подобрен глюкозен толеранс при мишки от див тип, но не и при нокаутирали мишки от грелин [67]. Въпреки че GO-CoA-Tat представя някои ограничения като лекарство на основата на пептид, вероятно е бъдещите синтетични дериватизации да максимизират фармакологичните му свойства.
В заключение, GOAT представлява изключително обещаващ кандидат за развитието на лекарства против затлъстяване и/или антидиабет. Всъщност това е уникалният ензим, отговорен за ацилирането на грелин и неговата модулация би повлияла само на физиологичния процес на ацилиране на грелин.
3. Неутрализиране на Грелин
Ваксинирането срещу грелин представлява стратегия за блокиране на ефектите от грелин (Фигура 1). Плъховете, имунизирани с грелин хаптен имуноконюгати, водят до производството на антитела, специално насочени срещу ацилиран грелин, и намаляват наддаването на телесно тегло с преференциално намаляване на мастната маса, съпътстващо намаляването на ефективността на хранене [68]. Човешкото значение на използването на ваксинация срещу грелин остава несигурно. Всъщност изпитване фаза I/II, използващо ваксина CYT 009-Ghr Qb, от Cytos Biotechnology AG, не показва ефект на загуба на тегло при затлъстели хора, въпреки ефективния отговор на антителата.
Високоафинитетните антиацилгрелин специфични моноклонални антитела специфично свързват ацил грелин, дозозависимо инхибира активирането на GHS-R1a in vitro и блокират приема на храна, индуциран от грелин, при мишки in vivo [69].
Неутрализирането на грелин също се постига с помощта на шпигелмери, антисенс полиетилен гликол-модифицирани L-олигонуклеотиди, способни да свързват специфично целевата молекула (Фигура 1). Шпигелмерът NOX-B11-2 намалява приема на храна и телесното тегло при индуцирани от диета затлъстели мишки [70–72]. Друг шпигелмер, NOX-B11-3 упражнява дълготрайно действие върху инхибирането на индуцираното от грелин освобождаване на GH при плъхове [73], но не блокира индуцираното на гладно невронално активиране в дъгообразното ядро на хипоталамуса [74]. Неутрализацията на циркулиращия грелин от шпигелмери може да бъде полезна за лечение на заболявания, свързани с високи нива на грелин като PWS, характеризиращи се с тежко затлъстяване. Pfizer Inc. пое по-нататъшното развитие на шпигелмерите NOX-B11, първоначално разработени от NOXXON Pharma AG.
В заключение, терапевтичната полезност на ваксинацията срещу грелин и използването на грелин шпигелмери при лечение на затлъстяване остава да бъде доказана.
4. GHS-R1a: Фармакологична цел за антагонизиране на индуцираните от грелин отговори
4.1. GHS-R1a антагонисти
Инхибирането на сигнализирането на грелин представлява привлекателна цел за фармакологично лечение на диабет тип 2, затлъстяване, особено PWS и метаболитен синдром. Следователно са разработени няколко класа антагонисти на GHS-R1a (Фигура 1).
[D-Lys- 3] GHRP-6, пептиден GHS-R1a антагонист, намален прием на храна при слаби и затлъстели мишки и намалено наддаване на тегло [70, 75].
Заместените с пиперидин производни на хиназолинон са идентифицирани като нов клас от малки молекули GHS-R1a антагонисти [76]. Фениловите или фенокси групите са оптимални заместители в позиция 6 на ядрото на хиназолинона и замяната на фенилни групи в позиция 2 с малки алкилни заместители е доказано, че е от полза [76]. YIL-781, заместено с пиперидин хиназолиноново производно, действащо като мощен антагонист на GHS-R1a, подобрява глюкозо-стимулираната секреция на инсулин и намалява приема на храна и загуба на тегло при индуцирани от диета затлъстели мишки [77].
Някои GHS аналози, носещи тризаместена 1,2,4-триазолна структура, като JMV2866 и JMV2844, се държат като GHS-R1a антагонисти [78, 79]. Наскоро бяха идентифицирани допълнителни нови GHS-R1a антагонисти с глобална подобна структура, използвайки хомогенен скрининг за анализ, базиран на флуоресценция във времето [80].
Оптимизирането на синтеза на аналози на пиперазин-бисамид доведе до мощни GHS-R1a антагонисти. Един от тези аналози се отличава с особено висока ефективност, както и с други интересни фармакологични свойства и инхибира освобождаването на GH ex vivo [81].
Няколко производни на карбохидразид бяха идентифицирани като мощни и селективни GHS-R1a антагонисти [82]. Сред тези съединения беше показано, че GSK1614343 е мощен конкурентен антагонист на плъх GHS-R1a [83]. Неочаквано GSK1614343 доведе до увеличаване на приема на храна и телесно тегло както при плъхове, така и при кучета [84].
BIM-28163 е идентифициран като грелинов антагонист, блокиращ индуцираната от грелин секреция на GH [85]. Въпреки това, хроничното приложение на GHS-R1a антагонист неочаквано индуцира наддаване на телесно тегло [85].
Други аналози на GHS-R1a, разработени за лечение на нарушения на теглото, включително затлъстяване, също все още се считат за предклинични съединения (TZP-301, от Tranzyme Pharma и EX-1350, от Elixir Pharmaceuticals) [86].
В заключение са идентифицирани няколко класа антагонисти на GHS-R1a и биха могли да представляват интересен фармакологичен инструмент за лечение на затлъстяване, както и диабет тип 2 и метаболитен синдром. Въпреки това продължават да са необходими дългосрочни проучвания върху животни и хора, за да се оценят по подходящ начин полезните свойства на антагонистите на грелин в контекста на затлъстяването.
4.2. GHS-R1a Обратни агонисти
Високата конститутивна активност на GHS-R1a предполага, че обратните GHS-R1a агонисти, намаляващи неговата конститутивна активност, могат да бъдат полезни за лечение на затлъстяване [87, 88]. Дългото гладуване, индуцирано в хипоталамуса, повишена експресия на GHS-R1a и съпътстваща сигнализация, причиняващи по-висок апетит и намален разход на енергия. Следователно, намаляването на конститутивната активност на GHS-R1a от обратен агонист може да увеличи чувствителността към анорексигенни хормони като лептин или PYY и да предотврати приема на храна между храненията [89].
[D-Arg 1, D-Phe 5, D-Trp7,9, Leu11] вещество P е идентифицирано като обратен агонист на GHS-R1a [90].
В заключение, GHR-R1a обратните агонисти представляват интересен фармакологичен инструмент за инхибиране на GHS-R1a активността (Фигура 1). Необходими са обаче допълнителни проучвания, оценяващи дългосрочната употреба на съединенията при животински модели, за да се изясни тяхната полезност при лечението на затлъстяването и свързаните с него заболявания при хората.
5. Нова потенциална фармакологична цел за намаляване на секрецията на Грелин
Съвсем наскоро беше показано, че агонистите на рецепторите на горчив вкус (T2R) увеличават плазмения ацил грелин при мишки чрез стимулиране на α-gustducin, α-субединица на тримерен G-протеинов комплекс, участващ в трансдукцията на вкусов сигнал [91]. Имунофлуоресцентни проучвания разкриват, че стомашните ендокринни клетки, експресиращи грелин, показват до 90–95% колокализация с α-густдуцин. Освен това, измерването на T2R-агонисти увеличава приема на храна при мишки от див тип, но не и при α-gustducin или GHS-R1a нокаутират мишки [91]. Понастоящем не е ясно дали трансдукционните пътища, индуцирани след активиране на T2R, могат да повлияят на ацилирането на грелин чрез GOAT и/или освобождаване на грелин.
В заключение, T2R може да представлява нова интересна фармакологична цел за модулиране на секрецията на грелин (Фигура 1). Освен това, потенциалната употреба на T2R антагонисти за лечение на затлъстяване остава да бъде оценена.
6. Общи заключения
Участието на грелин в затлъстяването и по-доброто разбиране на биологията на грелин са довели до идентифициране на фармакологични цели и разработване на фармакологични съединения за лечение на затлъстяване и свързани заболявания. Досега фармакологичните съединения са проектирани да насочват GOAT, грелин и GHS-R1a. Съвсем наскоро се предполага, че T2R може също да представлява интересна цел в контекста на грелин и лечение на затлъстяване.
Благодарности
Тази статия е подкрепена от грант 3.4510.03 и 3.4561.07 от Фонда за медицински научни изследвания (FRSM, Белгия). Авторът би искал да благодари на д-р Джейсън Перет за полезните дискусии, подкрепа и критично четене по време на подготовката на доклада.
Препратки
- Асоциацията на дислипидемия и затлъстяване с гликиран хемоглобин Клиничен диабет и
- Затлъстяване, интрапанкреатична мастна инфилтрация и рак на панкреаса Клинични изследвания на рака
- Затлъстяване и психично здраве
- Затлъстяването и преяждането как да се преодолее лош навик - ABC News
- Затлъстяване и наднормено тегло Тексаски институт за сърце