Алън Й. Чен
1 Катедра по фармацевтични науки, Университет на Западна Вирджиния, Моргантаун, WV, САЩ
Yi Charlie Chen
2 Отдел за естествени науки, колеж Alderson-Broaddus, Филипи, WV, САЩ
Резюме
Кемпферол е полифенолен антиоксидант, намиращ се в плодовете и зеленчуците. Много проучвания описват полезните ефекти на диетата кемпферол за намаляване на риска от хронични заболявания, особено рак. Епидемиологичните проучвания показват обратна връзка между приема на кемпферол и рака. Кемпферол може да помогне, като увеличи антиоксидантната защита на организма срещу свободните радикали, които насърчават развитието на рак. На молекулярно ниво се съобщава, че кемпферол модулира редица ключови елементи в пътищата на клетъчна сигнална трансдукция, свързани с апоптоза, ангиогенеза, възпаление и метастази. Показателно е, че кемпферолът инхибира растежа на раковите клетки и ангиогенезата и индуцира апоптоза на раковите клетки, но от друга страна, изглежда, че кемпферолът запазва нормалната жизнеспособност на клетките, като в някои случаи упражнява защитен ефект. Целта на този преглед е да синтезира информация относно извличането на кемпферол, както и да даде представа за молекулярната основа на потенциалните му химиопрофилактични дейности, с акцент върху способността му да контролира вътреклетъчните сигнални каскади, които регулират гореспоменатите процеси. Обсъжда се и химиопрофилактика с използване на нанотехнологии за подобряване на бионаличността на кемпферол.
1. Въведение
Ракът се проявява в редица форми, всички белязани от една и съща неограничена пролиферация на клетки. Понастоящем съществуват много техники за управление на тази водеща причина за смъртността. Хирургията, лъчетерапията и химиотерапията показват забележителна ефективност при лечение на рак, но не са лишени от сериозни недостатъци. Нито едно от тях не е панацея за толкова устойчива болест. Раковите клетки се адаптират към лечението; те имат упорит наклон към мутация или метастазиране. След като туморът бъде елиминиран, остатъците му са склонни да се задържат. Химиотерапията е известна и с причиняването на множество неблагоприятни ефекти при пациентите. От повръщане до загуба на коса, качеството на живот може да бъде сериозно нарушено по време на кръгове химиотерапия.
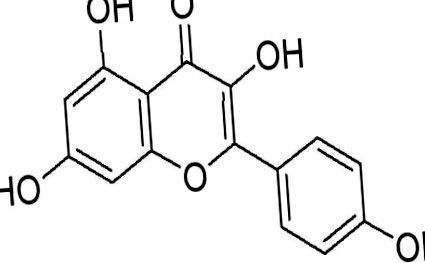
Флавоноидите са полифенолни съединения, които обикновено се срещат в растенията и представляват значителна част от човешката диета (Wojdylo, Oszmianski, & Czemerys, 2007). Антиоксидантната и противовъзпалителна способност на тези съединения са добре документирани (Seifried et al., 2007) и много от тях показват потенциал за борба с рака. Съобщава се, че флавоноидите инхибират експресията на VEGF, пролиферацията на ракови клетки и ангиогенезата (Luo, Jiang, King и Chen, 2008). От особен интерес е флавоноидът кемпферол (фиг. 1). Член на флавонолите, кемпферол се среща в изобилие в чай, броколи, ябълки, ягоди и боб (Somerset and Johannot, 2008). Доказано е, че се позовава на няколко различни механизма в регулацията на раковите клетки. Кемпферолът не само е мощен промотор на апоптозата (Ramos, 2007), но също така модифицира множество клетъчни сигнални пътища. В допълнение, кемпферолът е много по-малко токсичен за нормалните клетки в сравнение със стандартните химиотерапевтични лекарства (Zhang, Chen, Li, Chen, & Yao, 2008). Този преглед има за цел да каталогизира многобройните противоракови свойства на кемпферол и засегнатите клетъчни процеси. Провежда се и разследване за бионаличността на кемпферол.
Химична структура на кемпферол.
2. Екстракция
Предложен е икономичен и евтин метод за приготвяне на кемпферол чрез ензимна хидролиза с използване на два глюкозида на кемпферол в семена от чай (Park, Rho, Kim, & Chang, 2006). Конвенционалният метод за екстракция с органичен разтворител е използван за извличане на двата кемпферолови гликозида (Sekine et al., 1991; 1993; Park et al., 2006). Тази процедура обаче е трудоемка и трудоемка. Работата с големи количества опасни разтворители и продължителните стъпки на концентрация могат да доведат до загуба или разграждане на целевите съединения.
Свръхкритичната течна екстракция (SFE) е бърз метод за извличане на естествени биоактивни съединения от растителни материали (Marr and Gamse, 2000; Brunner, 2005; Huang, Li, Niu, Li, & Zhang, 2008; Lee, Charles, Kung, Ho, & Huang, 2010c). Той е разработен като алтернативна технология за екстракция, консумираща по-малко органични разтворители, за да компенсира нарастващите разходи за придобиване и обезвреждане на разтворители (Scalia, Giuffreda и Pallado, 1999).
3. Ефект върху апоптозата и инхибирането на растежа
(а) Предаване на сигнала
Kaempferol’s Effects on the MAPK Pathway.
Освен канала MAPK, пътят PI3K/AKT представлява друг сигнален път, замесен в развитието на рака. Прекомерното активиране на PI3K води до натрупване на AKT, който е чувствителен към нивата на епидермален растежен фактор (EGF) (Nomura, He, Koyama, Ma, Miyamoto и Dong, 2003). AKT регулира редица транскрипционни фактори. Повишеното активиране на AKT води до увеличаване на активността на AP-1 и NF-κB, благоприятно за генезиса на тумори (Li, Westergaard, Ghosh и Colburn, 1997). Активирането на PI3K е контрапродуктивно на апоптозата, поради което някои лекарства против рак се фокусират върху инхибирането на този път.
По същия начин, по който блокира функцията на Src, е показано, че кемпферол се конкурира с АТР в свързването с PI3K в миши епидермални JB6 P + клетки (Lee et al., 2010a). Чрез неутрализиране на PI3K, кемпферол инхибира последващата активност надолу по веригата на AKT и неговите цели за транскрипционен фактор. В присъствието на кемпферол, AKT вече не може да фосфорилира апоптотичния протеин BAD, като по този начин понижава нивата на Bcl-2 в съгласие (Nguyen et al., 2003, Luo et al., 2011). С тези супресори, покорени, апоптозата може да бъде инициирана с много по-силни темпове. Трябва да се отбележи, че тези цитотоксични ефекти изглежда са насочени конкретно към раковите клетки. Всъщност изглежда, че кемпферолът изпълнява защитна роля по отношение на нормалните телесни клетки. Доказано е, че кемпферол неутрализира токсичните свойства на 7бета-хидроксихолестерол в гладкомускулните клетки на плъхове, като всъщност предотвратява апоптозата в тези здрави клетки (Ruiz, Padilla, Redondo, Gordillo-Moscoso и Tejerina, 2006). Способността да се прави разлика между нормалните и злокачествените клетки е изключително желано свойство, огромен скок напред в контекста на днешните химиотерапевтични лекарства. В заключение, чрез своите ефекти върху MAPK и PI3K, кемпферол показва забележително обещание при манипулиране на клетъчната сигнализация при индуциране на апоптоза, като същевременно оставя здравите клетки сами.
(б) Клетъчен цикъл
За да се размножават, раковите клетки трябва, разбира се, да преминат през клетъчния цикъл, който е строго регулиран от множество протеини. Факторът, стимулиращ митозата (MPF), е главният агент, отговорен за прехода от фаза G2 към фаза M. Съставен от субединица циклин и субединица киназа, активираният MPF играе критична роля при преминаването на контролния пункт G2. Киназната субединица се нарича циклинозависима киназа (CDK). За да започне митоза, CDK трябва да се свърже с регулаторния протеин на циклина. Концентрацията на MPF циклина стабилно се изкачва през цялата фаза и достига върхове по време на митоза, където спада внезапно. По този начин активният MPF присъства само за индуциране на митоза, след което бързо се разлага. Следователно, ефективна ракова терапия може да се насочи към MPF в опит да спре клетъчния цикъл и клетъчния растеж.
Kaempferol’s Effects on the Cell Cycle.
В друго проучване, в комбинация с флавоноид кверцетин, лечението с кемпферол води до намаляване на общите нива на протеин, най-вече при Ki67 (Ackland, Van De Waarsenburg, & Jones, 2005). Ki67 е протеин, който обикновено се свързва с клетъчния растеж и обикновено липсва в клетките в покой (Scholzen and Gerdes, 2000). Излагането на кемпферол доведе до спиране на клетъчния цикъл и значително намаляване на пролиферацията. Това е лесно само върхът на айсберга в броя на протеините, които засяга кемпферолът. Кемпферол е универсална молекула със сериозен потенциал да наруши растежа на рака и изисква допълнително проучване на неговите ефекти върху клетъчния цикъл. Многофункционален химиопрофилактичен агент, kempferol изглежда играе роля във всеки аспект на растежа на рака. Несъмнено остават множество чувствителни на кемпферол гени, които чакат да бъдат изследвани.
(в) Енергично увреждане
Метаболитни ефекти на кемпферол.
За съжаление ракът има репутацията на едно от най-устойчивите заболявания. Туморните клетки се адаптират добре към бедни на хранителни вещества и хипоксични условия. Може би най-поразителното е, че клетките HeLa започват автофагия, когато са подложени на енергичен стрес (Filomeni et al., 2010). Медиирана от AMP-активирана протеинкиназа (AMPK), автофагията представлява механизъм за оцеляване, при който ненужните клетъчни процеси се спират и клетките започват да разграждат своите еднократни органели за енергия. Активирането на автофагия значително намалява степента на апоптоза и позволява продължаване на разпространението на рака. Ранните in vitro изследвания обещават обещаване при комбиниране на лечение с кемпферол с автофагия и инхибитори на AMPK, но трябва да се проведе по-задълбочено изследване, преди да се получат значителни резултати.
4. Ефект върху ангиогенезата
Ефекти на кемпферол върху ангиогенезата. Прекъснатите линии представляват предишни процеси, които са били редуцирани от кемпферол.
5. Ефект върху метастазите
Един от най-смъртоносните аспекти на рака е способността му да се разпространява в други части на тялото. За разлика от локализираните тумори, метастазиралият рак представлява далеч по-труден за лечение проблем. Хирургията може да премахне първичен тумор, но тези вторични израстъци са склонни да изплуват отново, след като бъдат елиминирани. За да се разпространят, злокачествените клетки първо трябва да разграждат заобикалящия ги извънклетъчен матрикс (ECM), като си проправят път до съдовата система на тялото за безплатно пътуване. За да разрушат съседния ECM, раковите клетки обикновено използват множество ензими, които включват матричните металопротеинази (MMP). Високите нива на MMP-3 са особено свързани с повишени нива на туморна инвазия и лоши прогнози (Coussens and Werb, 1996). Известно е, че MMP-3 унищожава жизненоважни ECM протеини като фибронектин и колаген (Wu, Lark, Chun и Eyre, 1991). В допълнение, сигналната трансдукция на екстрацелуларен хепатоцитен растежен фактор (HGF) е замесена в разпространението на медулобластом, силно метастатичен рак на мозъка (Li et al., 2008). Доказателствата сочат, че сигнализирането на HGF води до създаването на богати на актин мембранни волани, които са неразделна част от миграцията на клетките (Labbé, Provencxal, Lamy, Boivin, Gingras и Béliveau, 2009).
6. Ефект върху възпалението
IL-4 представлява друг цитокин, сигнализиращ за възпалението, известен със своите ефекти върху диференциацията на Т-клетките. Въпреки това, подобно на всички споменати по-горе интерлевкини, IL-4 е замесен в автоимунно заболяване и дерегулация на възпалението (Finnegan et al., 2002). IL-4 проявява своите ефекти чрез фосфорилиране на JAK3, тирозин киназа, намираща се в цитоплазмата. JAK3 последователно фосфорилира STAT6, транскрипционен фактор, отговорен за синтеза на протеини, натоварен да актуализира възпалителния отговор (Nelms, Keegan, Zamorano, Ryan и Paul, 1999). Не е изненадващо, че беше установено, че кемпферолът инхибира този сигнален път, по-специално чрез насочване на активността на JAK3 (Cortes, Perez-G, Rivas и Zamorano, 2007). След въвеждането на кемпферол, JAK3 не успя да фосфорилира STAT6, ефективно нарушавайки секрецията на свързаните със STAT6 възпалителни протеини. Тъй като JAK3 е нагоре от редица транскрипционни фактори, kempferol обещава да наруши много контролирани от JAK3 процеси. Тъй като възпалителният цитокин IL-2 също използва JAK3 за активиране на STAT5, друг транскрипционен фактор, кемпферолът също е мощен инхибитор на медиирани от IL-2 резултати (Фиг. 6).
Противовъзпалителни ефекти на кемпферол.
И накрая, kempferol изглежда притежава терапевтични ефекти чрез ендоканабиноидната система. В нервната система се помещава множество канабиноидни рецептори, чувствителни към специфични невротрансмитери. Активирането на ендогенната канабиноидна система регулира няколко физиологични процеса, включително апетит, болка и възпаление. Като цяло, индуцирането на канабиноидни рецептори изглежда уврежда възпалението и ноцицепцията. Въпреки това, невротрансмитерите, отговорни за тяхното активиране, обикновено са краткотрайни и бързо се улавят от освобождаващия ги неврон. Амидната хидролаза на мастни киселини (FAAH) функционира при разграждането на анандамид, ендоканабиноид, способен да наруши възпалителния отговор (Deutsch и Chin, 1993). Документирано е, че кемпферол инхибира активността на FAAH, позволявайки на анандамид да продължи да упражнява терапевтичните си ефекти (Thors, Belghiti, & Fowler, 2008). Концентрациите на кемпферол, необходими за блокиране на FAAH, не са постижими чрез консумация на храна, поради лошата бионаличност на кемпферол. Съмнително е дали инхибирането на FAAH е важно при предаването на ефектите на кемпферол in vivo, които могат да бъдат установени чрез други механизми. Необходими са по-задълбочени изследвания, преди да може да се направи преценка относно ролята на кемпферол в ендоканабиноидната система.
7. Бионаличност и епидемиология на антиканцерогенните ефекти
8. Нанотехнологии
Крайната причина за слабата бионаличност на кемпферол е лошото му разтваряне в редица разтворители. За да се абсорбират, веществата първо трябва да бъдат разбити на частици в разтвор. Покриването на наночастици позволява по-малки, по-разтворими частици с по-голям афинитет към околните помощни молекули (Tzeng et al., 2011). Изглежда, че тази формула увеличава клиничните свойства на кемпферол, по-специално неговата антиоксидантна способност. Нанохимопревенцията представлява вълнуващо поле с много нови пътища за изследване, което означава много въпроси без отговор. Работата, извършена in vivo, е оскъдна и все още предстои да се види дали наночастиците наистина могат да помогнат за увеличаване на противораковите ефекти на кемпферол при пациенти с жив рак. По-нататъшното разследване е задължително, преди да можем да разберем истинската стойност на кемпферол.
9. Заключения
След проучване на забележителния му каталог на свойствата за борба с рака, очевидно е да се види, че кемпферолът е пълен с потенциал. В условията in vitro, този флавоноид може да се похвали с широк спектър от ефекти, насочени към рак при апоптоза, ангиогенеза, метастази и възпаление. Най-важното е, че кемпферолът не е съединение, което концентрира усилията си в една област. Ако раковите клетки се адаптират към инхибирането на VEGF, те остават уязвими към другите разрушителни ефекти на кемпферол. Също така, стойността на кемпферол в способността му да прави разлика между здрави и злокачествени клетки не може да бъде надценена. Съвременните химиотерапевтични лечения представляват сериозни рискове за здравето, проблемът с кемпферол изглежда е разрешен. Въпреки че значението му като лечение на рак остава съмнително, изглежда, че е вариант с нисък риск. И накрая, въпреки че лошата бионаличност олицетворява основна пречка, нанотехнологията се очертава като обещаващо средство за преодоляване на този проблем, съживявайки надеждата за използване на кемпферол като химиопрофилактично средство.
Ракът се нарежда сред най-наложителните медицински проблеми, засягащи човешката популация, а стратегиите за химиопрофилактика представляват обещаващ подход за намаляване на честотата и смъртността. Кемпферол, като естествено съединение, може да предизвика голяма променливост в терапевтичните си резултати. Въпреки че са проведени голям брой проучвания in vitro, са проведени няколко клинични изпитвания с използване на точни концентрации на тези съединения. Трябва да се извършат повече експерименти и клинични проучвания, фокусирани върху флавоноидите, за да се изясни стойността на тези молекули при лечението на рак. Въпреки че е събрана богата информация, бъдещите разследвания трябва да изследват употребата на кемпферол като възможност за лечение на живи пациенти с рак.
Акценти от рецензията
Кемпферол намалява риска от хронични заболявания, особено рак.
Кемпферол увеличава антиоксидантната защита на човешкото тяло срещу свободните радикали.
- Геохимия на арсена и човешкото здраве в Югоизточна Азия
- Рак на пикочния мехур Вашият личен риск и как да го намалите; Здравни основи от клиника в Кливланд
- Систематичен преглед на въздействието на многостратегичните образователни програми за хранене върху здравето и
- Здравни теми за рак на кръвта
- Асоциация между приема на протеини в храната и доказателства за риск от рак на простатата от мета-анализ