Джована Мускогиури
1 Отдел по ендокринология и метаболитни болести, Università Cattolica del Sacro Cuore, Рим, Италия
Тереза Меца
1 Отдел по ендокринология и метаболитни болести, Università Cattolica del Sacro Cuore, Рим, Италия
Аннамария Приолета
1 Отдел по ендокринология и метаболитни болести, Università Cattolica del Sacro Cuore, Рим, Италия
Gian Pio Sorice
1 Отдел по ендокринология и метаболитни болести, Università Cattolica del Sacro Cuore, Рим, Италия
Дженаро Клементе
2 Катедра по хирургия, Università Cattolica del Sacro Cuore, Рим, Италия
Херардо Сарно
2 Катедра по хирургия, Università Cattolica del Sacro Cuore, Рим, Италия
Дженаро Нуцо
2 Катедра по хирургия, Università Cattolica del Sacro Cuore, Рим, Италия
Алфредо Понтекорви
1 Отдел по ендокринология и метаболитни болести, Università Cattolica del Sacro Cuore, Рим, Италия
Jens J. Holst
3 Център за основни метаболитни изследвания на Фондация Novo Nordisk, Департамент по биомедицински науки, Институт Panum, Университет в Копенхаген, Копенхаген, Дания
Андреа Джакари
1 Отдел по ендокринология и метаболитни болести, Università Cattolica del Sacro Cuore, Рим, Италия
Резюме
ОБЕКТИВЕН
Да се оцени ефектът от премахването на дванадесетопръстника върху сложното взаимодействие между инкретините, инсулина и глюкагона при недиабетни пациенти.
ПРОЕКТИРАНЕ И МЕТОДИ НА ИЗСЛЕДВАНИЯТА
За оценка на хормоналната секреция и инсулиновата чувствителност, 10 пациенти с наднормено тегло без диабет тип 2 (възраст 61 ± 19,3 години и ИТМ 27,9 ± 5,3 kg/m 2) са подложени на тест със смесено хранене и хиперинсулинемично-евгликемична скоба преди и след запазване на пилора панкреатодуоденектомия за ампулом.
РЕЗУЛТАТИ
Всички пациенти са имали намаляване на инсулина (P = 0,002), C-пептида (P = 0,0002) и секрецията на стомашен инхибиторен пептид (GIP) (P = 0,0004), докато нивата на глюкоза на гладно и след хранене са се увеличили (P = 0,0001); Отговорите на GLP-1 и глюкагон към смесеното хранене се увеличават значително след операция (P = 0,02 и 0,031). Докато промените в нивата на GIP не корелират с нивата на инсулин, глюкагон и глюкоза, увеличаването на секрецията на GLP-1 е обратно свързано с намаляването на секрецията на инсулин след операцията (R 2 = 0,56; P = 0,012), но не и с повишения глюкагон секреция, която корелира обратно с намаляването на инсулина (R 2 = 0,46; Р = 0,03) и С-пептида (R 2 = 0,37; Р = 0,04). Като се има предвид, че останалият панкреас вероятно е запазил интраислетна анатомия, секреторен капацитет на инсулина и взаимодействие на α- и β-клетки, нашите данни показват, че повишената секреция на глюкагон е свързана с намален системен инсулин.
ЗАКЛЮЧЕНИЯ
Запазващата пилорус панкреатодуоденектомия се свързва с намаляване на GIP и забележително повишаване на нивата на GLP-1, което не се превръща в повишена секреция на инсулин. По-скоро хипоинсулинемията може да е причинила увеличаване на секрецията на глюкагон.
ПРОЕКТИРАНЕ И МЕТОДИ НА ИЗСЛЕДВАНИЯТА
Общо 10 пациенти (6 мъже и 4 жени), подложени на запазваща пилора панкреатодуоденектомия с лечебно намерение в отделението по хепато-билиарна хирургия, отделение по хирургия, Университетска болница Agostino Gemelli, Рим, Италия, са били записани последователно. Индикация за операция беше тумор на ампула на Vater. Панкреатодуоденектомията е извършена съгласно техниката за запазване на пилора (8). Накратко, главата на панкреаса, дванадесетопръстника, общия жлъчен канал и жлъчния мехур бяха отстранени цялостно, оставяйки функциониращ пилор на стомашния изход непокътнат. Всички съседни лимфни възли бяха внимателно отстранени. Непрекъснатостта на стомашно-чревния тракт беше възстановена чрез инвагинирана панкреатикоеюностомия встрани. По-нататък по веригата е направена хепатикоеюностомия от страна до страна и гастроентеростомия отстрани или от страна на пилора йеюностомия. Обемът на панкреаса, отстранен по време на операцията, е
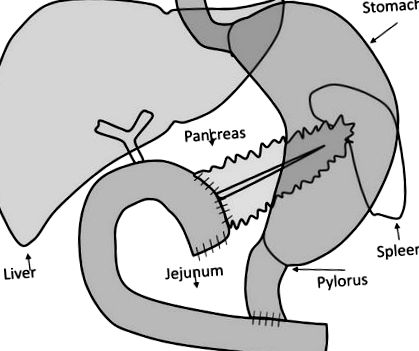
50%, както беше съобщено по-рано от Schrader et al. (9). Фигура 1 дава схематично представяне на хирургичната процедура. Само пациенти с нормални сърдечно-белодробни и бъбречни функции, както се определя от медицинската история, физически преглед, електрокардиография и анализ на урината; без известен диабет; и без никакви антидиабетни лекарства бяха включени в проучванията. Пациентите са изследвани 1 седмица преди и след променлив период на възстановяване от хирургичната процедура (оценява се достатъчен период на възстановяване за нормализиране на възпалителните параметри като С-реактивен протеин и скорост на еритрозидиментация, стабилност на теглото и нормална диета без ясни симптоми на анормална чревна моторика или екзокринен дефицит на панкреаса). Протоколът за изследване е одобрен от местната комисия по етика.
Хирургическа и реконструкционна процедура: главата на панкреаса, дванадесетопръстника, общия жлъчен канал и жлъчния мехур са отстранени цялостно, оставяйки функциониращия пилор на стомашния изход непокътнат. Непрекъснатостта на стомашно-чревния апарат беше възстановена чрез инвагинирана панкреатикоеюностомия от страна до страна. По-нататък по веригата е направена хепатикоеюностомия от страна до страна и гастроентеростомия отстрани или от страна на пилора йеюностомия. Тази фигура е предназначена да опрости разбирането на анатомичните промени, на които се основава нашият модел.
Статистически анализ
Статистическият анализ беше извършен, използвайки двупосочен ANOVA или Student t тест, както е подходящо, и регресионен анализ, използвайки SPSS версия 9 (SPSS, Чикаго, IL). Промените в променливите по време на теста със смесено хранене бяха оценени чрез двупосочна ANOVA за повтарящи се мерки. Използва се post hoc анализ с двустранен сдвоен t тест за оценка на разликите в отделни периоди от време в проучването, с корекция на Bonferroni, използвана за множество сравнения. Стойност на P 2 преди и 26,8 ± 5,0 kg/m 2 след операция. Таблица 1 отчита метаболитни характеристики и средни стойности на всички измерени параметри по време на теста със смесено хранене. Екскурзията на глюкоза на гладно и след предизвикателството се увеличава след операция (P = 0,0001) (фиг. 2А) и се наблюдава значително намаляване на нивата на инсулин след хранене (P = 0,002) (фиг. 2Б), придружено от паралелно намаляване на C-пептида (P Фигура 2В). В сравнение с предоперативното проучване, поглъщането на хранене предизвика значително по-голямо увеличение на концентрациите на GLP-1 (P = 0,02) (фиг. 2D), заедно с намаляване на GIP отговорите (P фиг. 2E). Също така изследвахме дали промените в GLP-1, инсулина и секрецията на глюкагон са свързани след операция. Интересното е, че колкото по-голямо е увеличението на секрецията на GLP-1 след операцията, толкова по-малко е намаляването на секрецията на инсулин (R 2 = 0,56; P = 0,012) и C-пептида (R 2 = 0,30; P = 0,04), изчислено като процент на намаляване на площта под кривата (AUC). Въпреки че не е открита разлика в нивата на глюкагон на гладно, след операцията концентрациите на глюкагон са по-високи, особено 90 минути след поглъщане на храна (P = 0,031) (фиг. 2). Увеличението корелира с намаляването на инсулина, както и отговорите на С-пептида към храненето (индивидуални разлики между предоперативните и следоперативните AUC) (R 2 = 0,46, P = 0,03 и R 2 = 0,37, P = 0,04, съответно); AUC на GLP-1 и глюкоза не корелират с AUC на инсулин или C-пептид. GIP AUC не са свързани с нивата на глюкоза, инсулин, С-пептид или глюкоза. След операция не е установена промяна в чувствителността към инсулин (поглъщането на глюкоза се променя от 4,27 ± 1,32 на 3,97 ± 1,04 mg · kg −1 · min −1; P = 0,44).
маса 1
Антропометрични и метаболитни характеристики на пациентите
Плазмени концентрации на глюкоза (A), инсулин (B), C-пептид (C), GLP-1 (D), глюкагон (E) и GIP (F) при пациенти, изследвани преди и след операцията. При t = 0 минути се приема орално смесено хранене. Данните са представени като средни стойности ± SEM. Стойностите на Р бяха изчислени, използвайки повторни измервания от ANOVA. Значителна разлика (P 2 = 0,56; P = 0,012). При нашите пациенти е имало следоперативна непоносимост към глюкоза и абнормни ниски инсулинови отговори, но въпреки това отговорите на инсулина и GLP-1 са били корелирани, което предполага, че без секреция на GLP-1 секрецията на инсулин и следователно диабетът може да е още по-нарушен.
Нашето проучване има няколко ограничения, които трябва да се отбележат. Първо, това проучване е проведено при пациенти, подложени както на хемипанкреатектомия, така и на отстраняване на дванадесетопръстника; това попречи на „чистата“ оценка на ролята на дванадесетопръстника. Второ, пациентите са били засегнати от рак. Избрахме обаче пациенти, засегнати от ампулом, който е нискостепенен туморен тумор, с добра прогноза (37,38) и обикновено не влияе върху метаболизма на глюкозата. Трето, оценката след операцията беше извършена на различни интервали след операцията (30-50 дни, за да се даде възможност за различни проценти на пълно възстановяване след операция). Тази променливост може да окаже известно влияние върху резултатите. Въпреки че се характеризира добре със смесено хранене и скоба, ограниченият брой пациенти може да представлява ограничение.
В заключение, настоящото проучване показа, че запазващата пилора панкреатодуоденектомия е свързана с нарушен глюкозен толеранс, вероятно свързан с намаляване на секреторния капацитет на инсулина. Намалените нива на GIP също могат да бъдат включени, докато силно засилените отговори на GLP-1 не се превърнаха в повишена секреция на инсулин. Въпреки резекцията, нивата на глюкагон бяха повишени въпреки повишените нива на GLP-1. Увеличенията на глюкагона са свързани с намаление на секрецията на инсулин, което може би предполага, че може да се включи системна хипоинсулинемия. Ендокринен супресивен фактор, който обикновено се освобождава от дванадесетопръстника, също може да бъде замесен.
Благодарности
Това проучване беше подкрепено с безвъзмездни средства за A.G. от Università Cattolica del Sacro Cuore (Fondi Ateneo Linea D.3.2 Sindrome Metabolica) и от Fondazione Don Gnocchi. Г.М. е носител на наградата Умберто Ди Марио от Società Italiana di Diabetologia 2011.
Не са докладвани потенциални конфликти на интереси, свързани с тази статия.
- Премахването на дванадесетопръстника предизвиква грип за диабет за секреция на GLP-1
- Специална диета за хирургия за отстраняване на камъни след бъбреци здравословно
- Премахване на далак OSF HealthCare
- Премахване на далак - дете - изписване Медицинска енциклопедия MedlinePlus
- Реалният живот след отстраняване на жлъчния мехур