Субекти
Резюме
Обективен:
Целта на настоящото проучване беше да се идентифицират разликите в генната експресия между депата SAT, VAT и EAT в клас III с тежко затлъстяване.
Дизайн:
Човешката подкожна (SAT) и висцералната (VAT) мастна тъкан показват диференциални профили на генна експресия. Има малко информация обаче за другата проксимална бяла мастна тъкан, епигастриална (EAT), по отношение на нейната функция и принос към метаболизма.
Предмети и методи:
Използвайки РНК от мастни биопроби, получени от пациенти с тежко затлъстяване от клас III, подложени на отворена операция на стомашен байпас на Roux-en-Y, сравнихме профилите на генна експресия между SAT, VAT и EAT, като използвахме микрочипове, потвърдени от количествена PCR в реално време.
Резултати:
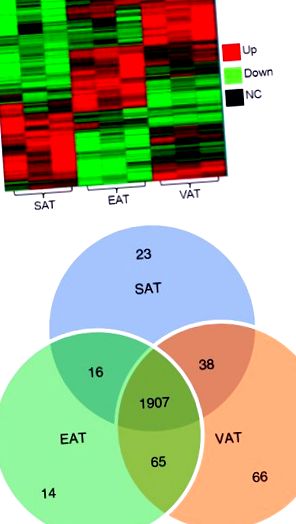
Установено е, че трите депа споделят 1907 гена. ДДС има най-голям брой гени (66), експресирани изключително в това депо, последвано от SAT (23) и след това EAT (14). Освен това ДДС споделя повече гени с EAT (65), отколкото със SAT (38). По-нататъшни анализи, използващи съотношения на SAT/EAT, ДДС/EAT и SAT/ДДС, идентифицирани специфични, както и припокриващи се мрежи и пътища на гени, представляващи дерматологични заболявания, възпаление, клетъчен цикъл и растеж, рак и развитие. Насоченият анализ на гени, имащи роля в развитието и функцията на мастната тъкан, разкрива, че активираният от пероксизома пролифератор рецептор Гама коактиватор 1-алфа (PGC1-α), който регулира предшественика на хормона Irisin (FNCD5) са били експресирани обилно във всичките три мазнини, заедно с факторите за растеж на фибробластите (FGF) FGF1, FGF7 и FGF10, като има предвид, че, FGF19 и FGF21 бяха неоткриваеми.
Заключения:
Тези данни показват, че EAT има повече общо с ДДС, което предполага подобен метаболитен потенциал. Човешкото епигастрално мастно депо може да има значителна функционална роля при метаболитни заболявания и трябва да бъде допълнително изследвано.
Въведение
Човешката мастна тъкан е разнообразен тъкан-орган с различни депа, секретиращи различни хормони. 1 Подкожната (SAT) и висцералната (VAT) мастна тъкан са два основни типа мастна тъкан при възрастни хора, докато малко количество кафява мастна тъкан има роля в контрола на температурата при новородени. 2 Разлики в генната експресия между пре-адипоцити и адипоцити 3 и между човешки SAT и ДДС са докладвани по-рано. 4, 5 ДДС е свързано с инсулинова резистентност, диабет, хипертония, атеросклероза и чернодробна стеатоза, докато SAT реагира по-добре на инсулина и отделя повече адипонектин и по-малко възпалителни цитокини. 6 Тези разлики могат да се очакват, като се има предвид, че подкожните и висцералните адипоцити са възникнали от различни клетки-предшественици, които показват различни модели на генна експресия. 6, 7
Епигастралната мастна тъкан (EAT), от друга страна, не е добре проучена в човешката физиология. Само няколко проучвания са установили функционални разлики между SAT, ДДС и EAT мазнини. Смята се, че EAT е по-тясно свързано с SAT на корема, отколкото ДДС, но има разлики в размера на мастните клетки между половете. 8 Размерът на епигастралните мастни клетки е тясно свързан с депата от бедрената и глутеалната област, докато SAT мастната е по-чувствителна от епигастралната мастна към хормонални и хранителни фактори. Освен това има значителна връзка между хиперинсулинемията и липолитичната активност на ЕАТ при пациенти със затлъстяване, независимо от разпределението на мазнините, докато при висцералната мастна такава връзка е установена само при пациенти с преобладаващо висцерално затлъстяване. 10 Като цяло обаче има малко информация относно функционалното значение на EAT и връзката му с други депа в областта на талията, която е тясно свързана с метаболитни заболявания. 11, 12, 13, 14 Предишни проучвания с използване на микрочипове са използвали профилиране на експресията в SAT, за да се предскаже загуба на тегло при неотговарящи, консумиращи диета с ниско съдържание на мазнини. 15 В допълнение, профилирането на генна експресия с използване на ДДС разкрива повишаване на регулирането на митоген-активирани протеинкинази при затлъстели в сравнение с слаби индивиди. 16.
Тук тествахме хипотезата, че SAT, ДДС и EAT споделят генни експресионни профили, мрежи и пътища, но също така се характеризират с уникални генетични сигнатури. Използвахме РНК, приготвена от мастни биопроби, получени от клас със затлъстяване клас III (т.е. индекс на телесна маса (ИТМ)> 40 kg m -2), подложени на отворена операция на Roux-en-Y стомашен байпас (RYGB). Профилирането на глобална генна експресия беше извършено с помощта на масивите Affymetrix GeneChip Exon 1.0ST, последвано от валидиране на генната експресия, използвайки чувствителните количествени PCR методи в реално време. Освен това определихме профила на експресия на избран брой фибробластни растежни фактори, FNDC5 (Фибронектин тип III домейн, съдържащ 5), който кодира новооткрития хормон Irisin 17 и активирания от пероксизома пролифератор рецептор Gamma Coactivator 1-алфа (PGC1-α), който регулира FNDC5. 18.
Материали и методи
Характеристики на учебния предмет
Три вида бяла мастна тъкан (SAT, VAT и EAT) са получени от пациенти с екстремно (или клас III) затлъстяване (среден ИТМ: 56,8 kg m -2), подложени на открит RYGB в Медицински център Geisinger, както вече описахме. 19, 20, 21 SAT беше получен на cm 2 см дълбочина до коремната кожа. ДДС се получава от престилката на салника на няколко сантиметра от напречното дебело черво. ЕАТ се получава чрез частично изрязване на стомашната мастна подложка под ъгъла на His. Всички биопсии на мастната тъкан са получени след приключване на байпасната процедура и непосредствено преди фазата на затваряне.
В тези експерименти бяха използвани две различни групи пациенти с налични електронни здравни досиета: (а) група от шест пациенти, чиято мастна киселина беше използвана за експериментите с микрочипове и (б) група за потвърждение от 10 пациенти, които бяха използвани за валидиране на гени от микрочипа чрез qPCR в реално време, който включва петима произволно избрани пациенти от шестте, чиято РНК е използвана за компонента на микрочипа и пет нови пациенти с RYGB със сходни характеристики (Таблица 1). Тези проучвания са одобрени от Институционалния съвет за преглед на Медицинския център на Гейзингер (IRB) за изследване. Всички участници предоставиха информирано писмено съгласие.
Подготовка на РНК
Човешки SAT, VAT и EAT биопсии бяха събрани от шест пациенти, подложени на отворена стомашна байпас операция. Пробите веднага се поставят в RNAlater и се съхраняват при -80 ° C до анализ. РНК от биопсична тъкан се приготвя с помощта на RNeasy Lipid Tissue Mini Kit (Qiagen, Валенсия, Калифорния, САЩ). Количественото определяне на РНК се извършва с помощта на спектрофотометър Nanodrop ND-1000 (Thermo Scientific, Wilmington, DE, USA).
Микрочипове
За генериране на РНК профили е използван човешкият масив GeneChip Exon 1.0ST от Affymetrix (Санта Клара, Калифорния, САЩ). Пробите от РНК от двама индивиди, от един и същ адипозен тип, бяха обединени за анализ на един Genechip, позволявайки три чипа за всеки тип адипоз. Комбинирането на РНК от два индивида на чип служи за намаляване на индивидуалните вариации в генната експресия. Използвани са общо девет чипа (три за SAT, три за ДДС и три за EAT). РНК е белязана и хибридизирана в GeneChip Hybridization Oven 640 съгласно протокола на производителя (Affymetrix). Хибридизираните масиви бяха измити и оцветени с помощта на Affymetrix GeneChip Fluids Station 480. Всеки масив беше сканиран с помощта на Affymetrix GeneChip Scanner 3000 7G и Affymetrix GeneChip Operating Software (GCOS) беше използван за изчисляване на нивата на експресия от данните за нивото на сондата. Анализът за контрол на качеството беше завършен с RMA Sketch (Affymetrix).
Анализ на данни от микрочипове
Първичният анализ на микрочиповете е завършен с Spotfire Decision Site версия 9.1.2, като се използва сайтът за решения за функционална геномика (TIBCO, Пало Алто, Калифорния, САЩ). Нивото на флуоресцентен сигнал от „⩽ 50“ се счита за най-ниския праг за определяне на наличие или отсъствие на експресия. Това ниво на „50“ беше потвърдено от qPCR (обсъдено по-долу). Съотношенията на SAT/EAT, ДДС/EAT и SAT/ДДС бяха използвани за сравняване на промените в гънките между двойките мастни типове. Дисперсионният анализ (ANOVA) е използван за определяне на значимостта на разликите между съотношенията при P-стойности 22, 23 Прагът на генно откриване, използвайки това уравнение (40 − Δ (Ct − Ct на GAPDH)) е зададен на „30“, което съответства приблизително на Ct стойност за всеки даден ген при ∼ 35.
Специфични за тъканите и ко-експресирани гени
Само гени, които вече са изпълнили критерия за P 50 произволни единици се смятаха за изразени и бяха анализирани за експресия в трите мастни депа.
статистически анализи
Сравненията на промените в гънките след Spotfire анализ бяха извършени от ANOVA със значимостта, зададена на P-стойност
Резултати
Профилиране на генна експресия в SAT, ДДС и EAT
Общата РНК е получена от три вида мастни тъкани (SAT, VAT и EAT) от шест пациенти с екстремно затлъстяване, подложени на открита операция на RYGB (Таблица 1). Профилирането на генна експресия се извършва с помощта на човешките GeneChip Exon 1.0ST масиви от Affymetrix. От 22 011 транскрипта, представени в масива Exon 1.0ST, общо 2354 транскрипта с обозначени генни идентичности отговарят на нивото на значимост на P Фигура 1
Уникални и ко-експресирани гени
Почти 90% (1907/2129) от гените се експресират съвместно във всичките три мастни депа (допълнителна информация, допълнителна таблица S1). Йерархичният клъстер анализ на тези гени разкрива различни модели на генна експресия в трите депа за мазнини (Фигура 1а). Трите групи от двама пациенти са групирани по депа за мазнини, като SAT има най-много разлики в генната експресия спрямо ДДС и EAT. ДДС има най-голям брой уникални гени (66), последван от SAT (24) и EAT (14) (Фигура 1b, Таблица 2). ДДС има най-голям брой ко-експресирани гени с EAT (65) и след това със SAT (38). SAT и EAT споделят експресията на 16 гена, които не са изразени в ДДС (Фигура 1b, Таблица 3).
Относителните нива на генна експресия се анализират, като се използват съотношения на генна експресия (SAT/EAT, VAT/EAT и SAT/VAT). Стойностите на съотношенията бяха логаритмично (основа на 2) конвертирани и анализирани с помощта на софтуера IPA Ingenuity. Таблица 4 предоставя резюме на гените, показващи повишено или понижено регулиране по отношение на депото в знаменателя. Selectin (ПРОДАЖБА) показва най-високите нива на изразяване в SAT спрямо EAT (30,6 пъти, преди log2 преобразуване) и третите най-високи нива на изразяване по отношение на ДДС мастно (3,6 пъти преди log2 преобразуване). Intelectin 1 (ITLN1), известен също като Omentin 1, е имал най-високите нива на изразяване в ДДС мастно спрямо EAT (30,7 пъти, преди преобразуване на log2), както и спрямо SAT мастно (44,4 пъти, преди log2 преобразуване) (Таблица 4).
Анализ на мрежата и пътищата
Анализът от второ ниво беше извършен с помощта на приложението IPA Ingenuity Systems за идентифициране на мрежите и пътищата, представени от гени, които бяха диференцирано изразени между трите мастни депа (Таблица 5 и Допълнителна информация Допълнителна таблица S2). Анализ, използващ гени, диференцирано изразени в SAT спрямо идентифицирани с EAT мрежи, които са характерни за развитието на ендокринната система, съединителната тъкан и възпалително заболяване, развитието на скелетната мускулатура, ендокринните и стомашно-чревните разстройства и клетъчната морфология и ембрионалното развитие. Анализът използва гени, диференцирано изразени в ДДС по отношение на EAT идентифицирани мрежи от гени, отразяващи развитието на сърдечно-съдовата система, раково-репродуктивното заболяване, ембрионалното развитие, туморната морфология и клетъчния цикъл и нарушения на съединителната тъкан. Анализът използва гени, диференцирано изразени в SAT спрямо идентифицирани с ДДС мрежи от гени, които имат роля в съединителната тъкан и дерматологични разстройства, заболявания на рака/скелетните мускули, клетъчно-ембрионално развитие, репликация на ДНК-репарация и клетъчна морфология/ембрионално развитие.
IPA анализът също така идентифицира най-добрите канонични пътища, които са особено запазени сред съотношенията на депата (Таблица 5). Пътищата, представени от гени, диференцирано експресирани в SAT и ДДС спрямо EAT, включват IL-10, IL6, IL8, макрофаги и фибробласти при ревматоиден артрит, остеобласти и остеокласти при ревматоиден артрит и пътища IL-7A, които отразяват колективно наличието на възпаление и имунен отговор на възпаление (Таблица 5). SAT по отношение на ДДС идентифицира различни пътища, включително сигнализиране за инвазивност на глиома, остеобласти-остеокласти при ревматоиден артрит, панкреатичен адренокарцином и HER-2 сигнализиране при рак на гърдата (Таблица 5 и Допълнителна информация Допълнителна таблица S3).
Валидиране на експресията на гена на микрочипове чрез qPCR
Други гени с функционално значение в човешката мастна тъкан
Ние се интересувахме особено от експресирани с мастна тъкан гени, които играят роля в развитието на адипоцитите, както и от патофизиологията на затлъстяването и диабета. Изследвахме нивата на експресия на растежните фактори на фибробластите (FGF1, FGF7, FGF9, FGF10, FGF19 и FGF21), предшественикът на Irisin (Fibronectin тип III домейн, съдържащ 5—FNDC5) и транскрипционния фактор Пероксизомен пролифератор активиран рецептор Гама коактиватор 1-алфа (PGC1-α). Експериментите с qPCR отново потвърдиха данните за микрочиповете по отношение на величината и модела на изразяване. Например микрочиповете показват стойности на изразяване, които са били на фонови нива за FGF19 и FGF21 (0,70 или
Дискусия
Мастната тъкан е анатомично, функционално и метаболитно хетерогенна и се смята, че допринася за патофизиологията на различни медицински важни състояния, особено тези, свързани със затлъстяването. Тук проведохме профилиране на генна експресия, използвайки РНК, получена от три вида човешки депа с бяла мастна тъкан: SAT, ДДС и EAT. Наскоро се съобщава за разлики между коремен SAT и адипозен ДДС, 24 и между абдоминален SAT и глутеален адипозен 25 при хора, макар и не при пациенти със затлъстяване със силно затлъстяване или клас III.
Извършен е анализ на второ ниво за определяне на биологични мрежи и пътища с функционално значение. Мрежата, идентифицирана като най-значително обогатена със SAT, по отношение на ДДС и втората най-много по отношение на EAT, е мрежата за разстройства на съединителната тъкан, дерматологични заболявания. Като се има предвид анатомичната близост на SAT до кожата, този път подчертава потенциално важна роля за SAT при дерматологични заболявания. Много кожни заболявания са имунологично медиирани и способността на SAT да произвежда такива фактори може да го включи в патогенезата на тази група нарушения. Въпреки това на пръв поглед очевидно наблюдение, ще бъдат необходими повече експериментални данни в подкрепа на тази възможност.
В допълнение, направихме корелационни анализи на данните за qPCR от всички 10 пациенти с метаболитни параметри като нива на глюкоза на гладно, липопротеини с висока плътност, липопротеини с ниска плътност, общ холестерол, триглицериди, систоличен BP, диастоличен BP и BMI. Открихме силна корелация между някои от тези клинични характеристики с генната експресия в ДДС или EAT. Интересното е, че установените корелации са само за ДДС и EAT, но не и за SAT, което увеличава възможността за значителни роли на тези две мастни тъкани в метаболитните функции. След корекциите на Bonferroni за многократно тестване и поради малкия размер на пробата за този тип анализ, нито една от корелациите не остава статистически значима. За възпроизвеждане на тези първоначални резултати ще са необходими бъдещи проучвания, използващи по-големи размери на пробите.
В заключение, профилирането на генна експресия на SAT, ДДС и EAT разкри значително споделяне на РНК, което предполага, че техните функционални разлики могат да се крият в различията в нивата на експресия. Няколко уникално експресирани гени и съответните мрежи също предполагат, че SAT може да има уникални роли при дерматологични състояния и че ДДС и EAT могат да имат роля при сърдечно-съдови заболявания и рак. Този подход с микрочипове може да помогне за изясняване на по-нататъшните функции на човешката бяла мастна тъкан, която се намира в областта на човешката талия.
- Бедро-глутеалната подкожна и междумускулната мастна тъкан имат независими и противоположни
- Експресията на микроРНК се различава в мастната мастна тъкан на плъхове със затлъстяване
- Хромозомната архитектура и плацентарната експресия на семейството на човешкия растежен хормон са
- Млечни телешки диети какво е влиянието на храненето върху генната експресия, какъв тип мастни киселини
- Контрастни ефекти на различните майчини диети върху сексуално диморфната генна експресия в мишата