Черил Ан Ма
1 Медицинско училище Duke-NUS, Сингапур, Сингапур
Ying Ying Leung
1 Медицинско училище Duke-NUS, Сингапур, Сингапур
2 Отделение по ревматология и имунология, Сингапурска обща болница, Сингапур, Сингапур
Резюме
Подаграта и остеоартритът (ОА) са често срещани форми на артрит, които нанасят огромна тежест на застаряващото население с нарастващото разпространение на затлъстяването. Клиницистите отдавна наблюдават връзката между тези две състояния. В този преглед обобщаваме доказателствата от епидемиологични и имунологични проучвания, които описват възможната връзка между двете състояния. Неотдавнашното ново разбиране за мононатриевата пикочна киселина, индуцирано от кристали, възпаление даде представа за вероятните споделени пътища на патогенеза и за двете състояния. Ние описваме потенциалните терапевтични последици, особено по отношение на възможността за пренасочване на традиционни лекарства за подагра за използване при ОА.
Въведение
Методи
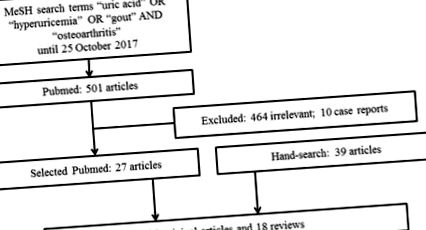
Проведохме търсене на литература от базата данни PubMed за съответни изследвания, публикувани с помощта на термините за търсене на MeSH „пикочна киселина“ ИЛИ „хиперурикемия“ ИЛИ „подагра“ И „остеоартрит“ до 25 октомври 2017 г. Търсенето беше ограничено до статии, написани на английски език. Включени са статии, които предоставят информация за връзка между хиперурикемия или подагра с ОА. Изключихме доклади за случаи или малки поредици от случаи. Освен това ръчно търсихме и преглеждахме референции от съответните статии. Общо 501 статии, публикувани на английски език, бяха идентифицирани от търсенето PubMed и 464 от тези статии бяха счетени за извън обхвата на този преглед и 10 доклада за случая бяха изключени. Общо 27 релевантни статии от търсенето, 39 статии от релевантни препратки от ръчното търсене и други ресурси бяха извлечени за пълен преглед на текста. Окончателният преглед включва 66 статии, с 48 оригинални статии и 18 рецензии (Фигура (Фигура 1). 1). Въпреки предварителното търсене, този преглед има повествователен характер, а не систематичен и следователно представя настоящото разбиране на авторите по темата.
Блок-схема за избор на статия.
Резултати
Доказателства за асоциации от епидемиологични проучвания
маса 1
Обобщение на епидемиологичните доказателства за хиперурикемия или подагра с ОА.
1-во MTP съединение: коригирано ИЛИ 2,06; 95% CI 1,28–3,30
Средно стъпало: коригирано ИЛИ 2,85; 95% CI 1,34–6,03
Коляно: коригирано ИЛИ 3.07; 95% CI 1,05–8,96
DIP фуги: коригирано ИЛИ 12,67; 95% CI 1,46–109,9
Нодална ръка OA (коригирана OR 1,46; 95% CI 0,61–3,50)
Крак OA (коригирано ИЛИ 2,16; 95% CI 0,66–7,06)
Коляно ОА (коригирано ИЛИ 0,57; 95% ДИ 0,20–1,65)
САЩ, Съединените американски щати; Великобритания, Обединеното кралство; UA, нива на пикочна киселина; ИЛИ, коефициент на коефициент; HR, коефициент на риск; 95% CI, 95% доверителен интервал; ACR, Американски колеж по ревматология; ОА, остеоартрит; TKR, обща смяна на коляното; ИТМ, индекс на телесна маса; OST, остеофити; JSN, стесняване на ставното пространство; AUC, площ под кривата на работната характеристика на приемника; IP, междуфалангова; PIP, проксимален интерфалангеален; DIP, дистално междуфалангеално; МТР, метатарзофалангеална.
Молекулярни доказателства за възможна патологична връзка между подагра и ОА
Подаграта може да насърчи деградацията на хрущяла поради преките ефекти на кристалите MSU. Доказано е, че MSU кристалите инхибират жизнеспособността и функционирането на човешкия хондроцити in vitro, в зависимост от дозата (27). Подобни явления са наблюдавани в ex vivo хрущялен експлант, култивиран с MSU кристали, което е довело до бързо увеличаване на експресията на разграждащите ензими агреканаза (ADAMTS4 и ADAMTS5) и намаляване на образуването на матрични протеини агрекан, версикан и колаген тип 2α1 ( 27). От проучване на 7855 трупни таларни повърхности на глезените от 4007 донори, отлаганията на кристали MSU и калциев пирофосфат дихидрат (CPPD) са разположени в региони, които са били подложени на биомеханичен стрес или нестабилност на ставите. Кристалните отлагания са силно свързани с разграждането на хрущяла и имунохистологичните промени в разграждането и възстановяването на хрущяла (28). Въпреки това, малцинство (8%) от талус с кристални отлагания не показват данни за дегенерация на хрущяла; и следователно увреждането на хрущяла може да не е предпоставка за отлагане на кристали.
От всички in vitro проучвания, които идентифицират кристалите на MSU като активатор на възпаление, се изисква или липополизахарид (LPS), или форбол миристат ацетат, преди активирането на инфламазомата от кристали MSU (33–35). Без грундиране, пречистените кристали MSU не могат да индуцират сами IL-1β (33, 34) и индукция рядко, ако изобщо се случи (35). Интересното е, че в проучване in vitro Joosten et al. демонстрира способността на дълговерижната свободна мастна киселина (FFA) C18: 0 да грундира вродената имунна система чрез тол-подобен рецептор (TLR) -2, което доведе до активиране на каспаза-1 и освобождаване на IL-1β от левкоцитите на периферната кръв при излагане на MSU кристали (34). Това предполага, че системните фактори, като FFA, могат да бъдат важни при взаимодействието с кристали MSU за задействане на вродената имунна система, като по този начин допринасят за OA патогенезата.
Липополизахарид, ключов провъзпалителен продукт на микробиома, може да бъде такъв фактор. Заедно с грундирането на вродената имунна система чрез LPS, свързани с увреждане молекулни модели като деградирали хрущялни фрагменти или кристали MSU могат да предизвикат TLR-4, водещ до фагоцитоза, активиране на инфламазома и последващо възпаление и увреждане на ставите (36). В модел, предизвикан от диета със затлъстяване (DIO), който има по-голяма телесна мазнина и по-голямо разграждане на хрущяла в сравнение с животни, хранени с чау, Collins et al. показа, че тези DIO плъхове имат различен състав и активност на чревната микробиота, по-висок LPS в плазмата и отчетлив възпалителен профил в синовиалната течност и серума (37). Това предполага, че системното влияние поради диета, затлъстяване и микробиома може да повлияе на патогенезата на ОА. При хора, използвайки същата кохорта от проучването за прогнозиране на прогресията на остеоартрита, Huang et al. показа, че както LPS на серума, така и синовиалната течност и LPS свързващият протеин са свързани с изобилие от активирани макрофаги в капсулата на колянната става и синовиума и тежест на ОА при рентгенография. LPS на синовиалната течност също е положително свързан със симптомите на ОА на коляното (38).
Пикочната киселина също може да бъде предразполагащ фактор, който задейства вродената имунна система. Crisan et al. предварително обработени левкоцити в периферна кръв със и без разтворима пикочна киселина в продължение на 24 часа и след това стимулирани тези клетки в продължение на 24 часа с TLR-2 или -4 лиганди в присъствието и отсъствието на кристали MSU (39). Показано е, че предварителната обработка с пикочна киселина подобрява IL-1β, IL-6 и намалява производството на антагонист на IL-1 рецепторите от периферни кръвни левкоцити след излагане на кристали MSU (39). Това проучване подчерта, че хроничната хиперурикемия може да повлияе на възпалителните реакции, като улесни производството на IL-1β в периферните кръвни левкоцити.
Необходимостта от втори фактор за активиране на MSU кристално-индуцирано възпаление беше подсилена от скорошно in vitro проучване, което оценява ефекта от производството на IL-1β и експресията на mRNA на IL-1β от макрофаги/моноцити върху експозицията на MSU кристали (40). Излагането на човешки макрофаги/моноцити само на кристали MSU не индуцира освобождаването на IL-1β, но изисква наличието на синовиална течност (супернатант и без клетки) от пациенти с възпалителен артрит (40). При анализ на фракционирането беше демонстрирано, че MS-кристалният съ-стимул се съдържа във протеиновата фракция, но не и в липидната фракция на синовиалната течност (40). Въпреки това, протеинът от синовиалната течност в това проучване действа като костимулиращ фактор, а не като „грунд“, тъй като предварителната обработка на макрофаги/моноцити със синовиална течност не е довела до производството на IL-1β (40). Беше отбелязано, че синовиалната течност от пациенти с ОА, за разлика от синовиалната течност от пациенти с възпалителен артрит, не повлиява производството на IL-1β, но леко засилва секрецията на IL-8 (40).
Някои проучвания обаче предполагат, че разграждането на хрущяла при ОА може да е независимо от активирането на NLRP3. При експлантите на ставите на човешкия ОА активният IL-1β се произвежда предимно от синовиум, а не от хрущял (41). При стимулация от възпалителен стрес с използване на LPS, IL-1α и фактор на туморна некроза (TNF) α мишките с дефицит на NLRP3 показаха подобна деградация на хрущяла в експлантатите на хондроцитите в сравнение с мишки от див тип (41). Авторите също така демонстрират, че увреждането на хрущяла в тези хрущялни експланти може да бъде предизвикано от преки механични сили, а не от възпалителен стрес. Нокаутиращите мишки IL-1β и NLRP3 не са защитени срещу увреждане на хрущяла, предизвикано от менискектомия (42). Освен това, в индуциран от колагеназа миши модел на ОА, мишките с дефицит на IL-1α/β не са защитени от загуба на хрущял и синовиално възпаление (43). Противоречивите данни за ролята на IL-1 в ОА могат да се дължат на видови различия и метода на индукция на ОА. Това също подчертава факта, че ОА е хетерогенен с множество етиологии в различни фенотипове, а механистичните пътища, лежащи в основата на възпалението при ОА, остават неуловими.
Терапевтични последици
Таблица 2
Обобщение на клиничните изпитвания на колхицин при ОА на коляното.
ОА, остеоартрит; RCT, рандомизирано контролирано проучване; DB, двойно заслепени; SC, единичен център; НСПВС, нестероидни противовъзпалителни лекарства; IA, вътреставно; срещу, срещу; наддаване, два пъти дневно; VAS, визуална аналогова скала; KGMC, обща скала на Медицинския колеж на King George (KGMC); WOMAC, общ индекс на остеоартрит в Университета на Западна Онтарио и Макмастър; hs-CRP, високочувствителен С-реактивен протеин; CTXI, омрежен С-телопептид от тип I колаген.
Заключение
Засега няма категорична причинно-следствена връзка между пикочната киселина, подаграта и ОА. Новите доказателства от епидемиологични проучвания обаче подкрепят връзката между подагра и ОА, след контролиране на ИТМ, най-важният объркващ фактор. Ново разбиране за ролята на възпалението както при кристално-индуцирания артрит, така и при ОА даде прозрение за възможния споделен път на патогенезата. Това са добри обосновки за по-нататъшни проучвания, за да се разбере връзката между двете често срещани състояния и да се оцени възможността за пренасочване на традиционните лекарства за подагра за използване при ОА.
Принос на автора
YYL концептуализира и проектира изследването; и двамата автори прегледаха литературата и получиха данните; и двамата автори изготвиха ръкописа и одобриха окончателната версия на ръкописа. YYL пое отговорност за целостта на произведението като цяло.
Изявление за конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
Благодарности
Авторите биха искали да благодарят на Serene AK Ong, медицински писател, Медицинско училище Duke-NUS, за помощта при подготовката на ръкописи.
Бележки под линия
Финансиране. CM се подкрепя от Академичната медицина - Подобряване на обучението, здравеопазването, резултатите и стандартите (AM-ETHOS) Duke-NUS Medical Student Fellowship ”YYL е получил финансиране от Центъра за безвъзмездна помощ на Сингапурската болница по клинична програма по медицина.
Съкращения
ADAMTS, дезинтегрин и металопротеиназа с мотиви на тромбоспондин; ИТМ, индекс на телесна маса; CTXI, омрежен С-телопептид от тип I колаген; hs-CRP, високочувствителен С-реактивен протеин; CRP-M, разграден с матрица металопротеиназа С-реактивен протеин; FFA, свободна мастна киселина; HR, коефициент на риск; IL, интерлевкин; LPS, липополизахарид; NALP3, nacht домейн, богат на левцин повтор и съдържащ пирин домен протеин 3; MSU, мононатриев кристал на пикочна киселина; ОА, остеоартрит; Отговор на OARSI-OMERACT, критерии за реагиране от Международното дружество за изследване на остеоартрита и мерки за резултат в ревматологията; ИЛИ, коефициент на коефициент; TNFα, фактор на туморна некроза α; Великобритания, Обединеното кралство.
- Ефект от диетичния контрол на отделянето на пикочна киселина с пикочния канал в образуватели на калциев оксалат и
- Диета за камъни от пикочна киселина
- Страдате ли от болки в ставите Може да сигнализира за високо съдържание на пикочна киселина в кръвта - The Economic Times
- Диета с повишена есенция на пикочна киселина и рецепти Компетентно за здравето на iLive
- Диетичните въглехидрати могат да доведат до остеоартрит, ново проучване установява, болят ли коленете в диетата