Резюме
Заден план
Терапията с имуноглобулин играе критична роля при лечението на имунодефицитни разстройства, както и автоимунни и възпалителни състояния. При имунодефицитни пациенти има противоречия дали първоначалните натоварващи дози интравенозно (IVIG) трябва да се основават на действителното телесно тегло или изчислен параметър като коригирано телесно тегло при пациенти със затлъстяване.
Представяне на дело
Описвам пациент с често променливо имунодефицитно разстройство (CVID), който е претърпял бариатрична операция за болестно затлъстяване. Нейното тегло намалява с 50% до под изчисленото идеално телесно тегло (IBW), докато нуждите от имуноглобулин намаляват с приблизително 20%. Нейният серумен IgG в стационарно състояние се увеличава от приблизително 7 g/l на 11,7 g/l, едновременно със загуба на тегло.
Заключения
Представям това наблюдение като подкрепа на препоръката първоначалните натоварващи дози SCIG/IVIG при имунодефицит да се основават на коригирано телесно тегло (AjBW), а не на действителното телесно тегло при пациенти със затлъстяване. Това има важни фискални последици за лечение на пациенти със затлъстяване с имунодефицитни нарушения.
Заден план
Заместването на имуноглобулин е стандартът на грижа за повечето пациенти със симптоматични първични имунодефицитни нарушения (PIDs). Заместването на имуноглобулин може да се извърши или подкожно (SCIG), или интравенозно (IVIG). Съвременните данни показват прогресивно подобряване на здравето с постепенно увеличаване на серумните нива на IgG [1]. Обикновено повечето пациенти стават по-малко симптоматични, когато техните стабилни състояния/най-ниските нива на IgG се поддържат над 7–8 g/l [2]. Много фактори на пациента влияят върху стационарното състояние/най-ниските серумни нива на IgG след SCIG/IVIG. Те включват генотипа на FcRn рецептора, наличието на инфекциозни или възпалителни състояния като бронхиектазии. В повечето случаи поддържащата доза имуноглобулин впоследствие се коригира въз основа на клиничния отговор [3, 4]. Това се нарича биологично ниско ниво [5, 6].
При пациенти с първични имунодефицитни нарушения (PIDs) с дълбоки ниски нива на IgG, често се прилага начална натоварваща доза IVIG (1 g/kg), последвана от месечни поддържащи дози от 400–800 mg/kg. Натоварващата доза позволява на пациента бързо да достигне терапевтични нива на IgG в стационарно състояние, което иначе би отнело няколко месеца, ако се прилагат типични поддържащи дози. Има спорове дали първоначалната натоварваща доза IVIG при пациенти със затлъстяване с ПИД трябва да се основава на действителното телесно тегло или коригираното телесно тегло [7]. Повечето клинични изпитвания на IVIG терапия изключват тези пациенти.
В случай, че се дава натоварваща доза, повечето експерти препоръчват тази първоначална доза SCIG/IVIG да се основава на коригирано телесно тегло (AjBW), а не на действителното телесно тегло. Основата на тази препоръка е, че прилаганият имуноглобулин не се разпределя в телесните мазнини и присъства само във вътресъдовото пространство и извънклетъчните течности. Използването на коригирано телесно тегло, а не идеално телесно тегло (IBW) или постно телесно тегло (LBW) се основава на презумпцията, че извънклетъчната течност се увеличава при пациенти с повишена мастна тъкан [8]. Описанията и изчисленията на тези производни параметри на телесното тегло са показани в легендата на Таблица 1.
Тук съобщавам за пациент с често срещано променливо имунодефицитно разстройство (CVID), който е претърпял бариатрична операция за болестно затлъстяване. Прогресивната загуба на тегло е свързана с постепенно повишаване на нейните серумни нива на имуноглобулин, което позволява намаляване на дозата. Както ще бъде показано тук, това наблюдение подкрепя препоръката, че първоначалната натоварваща доза на IVIG, най-подходящо се основава на коригирано телесно тегло, а не на действителното телесно тегло при пациенти с ПИД.
Представяне на дело
50-годишният пациент се е представил през 2011 г. с бронхиектазии и намалени нива на имуноглобулин през 2011 г. Нейният IgG е 3,5 g/l (7–14), IgA ®, дифтерия, H. influenzae и тетанус токсоиди (Таблица 2) [9]. Тя беше намалила В-клетките на паметта и се срещна с Ameratunga et al. критерии за CVID [10, 11] и квалифицирани за интравенозен имуноглобулин (IVIG). [12] Една от дъщерите й има CVID, но цялостното секвениране на екзома (WES) не успява да идентифицира причинната мутация в семейството [13, 14]. Преди IVIG, тя първоначално е била лекувана с профилактични антибиотици, но продължава да има пробивни инфекции. [12].
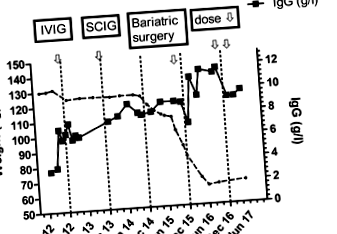
Тя имаше пиково тегло от 132 kg и първоначалната доза имуноглобулин беше изчислена според коригираното телесно тегло. След това дозата се титрира според нейните симптоми, което съответства на най-ниския IgG от приблизително 7 g/l. След заместване на имуноглобулин, се наблюдава значително намаляване на производството на храчки и по-малко обостряния на нейните бронхиектазии. Поради съображения за начин на живот впоследствие тя бе сменена на SCIG лечение и остана добре (Фиг. 1).
Пиковото тегло на пациента е 132 кг. Тя успя да намали теглото си до 110 кг по време на операцията през декември 2015 г. Първоначално беше лекувана с IVIG ПРЕЗ октомври 2012 г. и след това беше променена на SCIG през октомври 2013 г. Нейната доза SCIG беше 14,4 g всяка седмица. Той е намален до 13,6 g седмично през ноември 2016 г. и 12,8 g седмично през януари 2017 г. Преди загуба на тегло, нейното най-ниско ниво на имуноглобулин е приблизително 7 g/l. Последният й IgG през май 2017 г. е 9,2 g/l, въпреки 20% намаление на дозата SCIG. Стрелките изобразяват промените в лечението
Въпреки болестното затлъстяване, тя не отговаря на строгите критерии за публично финансирана бариатрична хирургия в Нова Зеландия, тъй като не е развила диабет тип 2. След дискусия с бариатричния хирургичен екип тя бе приета за операция за намаляване на теглото въз основа на вероятни икономии на разходи от намалените нужди на имуноглобулин. Тя успя да отслабне с 10 кг преди бариатричната хирургия (фиг. 1). Тя претърпява процедура roux-en-Y и има неусложнен следоперативен курс.
След бариатрична хирургия тя преживява прогресивна загуба на тегло (фиг. 1), която се стабилизира на 63 кг, което е малко по-ниско от прогнозираното й идеално телесно тегло (Таблица 1). Едновременно със загуба на тегло, нейните нива на IgG започват да се увеличават, което позволява намаляване на дозата (фиг. 1). Вероятно ще бъде възможно по-нататъшно намаляване на дозата на SCIG в бъдеще. Тя остава в добро здравословно състояние, със значително подобрение в отделянето на храчки и е успяла да прекрати профилактичните си антибиотици.
Дискусия и заключения
Моето наблюдение предлага пряко доказателство, че изискванията за SCIG ще намалеят след значителна загуба на тегло (фиг. 1). Реалното тегло на пациента е намаляло с 50%, но нейните нужди от имуноглобулин са намалели с приблизително 20%. Нейните най-ниски нива на IgG бяха приблизително 7 g/l преди операцията, но се увеличиха до 11,7 g/l, което позволява намаляване на дозата SCIG. Както може да се види от Таблица 1, нейната привидна доза SCIG/kg почти се удвои от 0,44 g/kg/месец на 0,81 g/kg/месец със загубата на тегло. Намалената извънклетъчна течност след загуба на мастна тъкан вероятно е обяснението за намалените нужди от имуноглобулин и увеличаващия серумен IgG. Може да има други фактори, допринасящи за намалените изисквания на SCIG, включително подобряване на възпалителното състояние, свързано със затлъстяването, и по-добър контрол на нейните бронхиектазии [7].
Използвал съм изчислен индекс на IgG (серумен IgG/SCIG доза/на kg), за да определя кой изведен параметър на телесно тегло преди операцията корелира най-добре с последващите SCIG изисквания след загуба на тегло. Този индекс отчита промените в серумния IgG в стационарно състояние, както и промените в дозата SCIG/IVIG/kg [7]. Версия на този индекс IgG е използвана за изчисляване на промените в най-ниските нива на IgG при коригиране на дозите SCIG/IVIG при пациенти със затлъстяване [15]. В случая на моята пациентка дозата SCIG първоначално се поддържа стабилна, докато теглото й намалява.
След загуба на тегло действителният й индекс на IgG на телесно тегло (серумен IgG/SCIG доза/на kg) е 11,35, което корелира тясно с прогнозирания IgG индекс от коригираното телесно тегло (11,2), преди загуба на тегло (Таблица 1) Индексът на IgG след намаляване на теглото (11,35) отчита повишения серумен IgG и намалената доза SCIG след загуба на тегло. Както беше отбелязано по-горе, намаленото отделение на извънклетъчната течност след загуба на мастна тъкан вероятно обяснява нарастващите серумни нива на IgG (фиг. 1). Други получени параметри на телесното тегло, като чиста телесна маса и идеално телесно тегло, не ефективно моделират това увеличено отделение за извънклетъчна течност при затлъстяване. Те не корелират тясно с индекса на IgG след загуба на тегло (Таблица 1).
Изчисляването на IgG индекса при този пациент подкрепя базирането на първоначалните натоварващи дози IVIG на коригирано телесно тегло, а не на действителното телесно тегло или идеалното телесно тегло (Таблица 1) при пациенти със затлъстяване с PID. Както беше отбелязано по-горе, последващите поддържащи дози SCIG/IVIG се основават на клиничния отговор на пациента. По-ниската натоварваща доза IVIG при пациенти със затлъстяване с ПИД има много предимства. Очевидна е фискалната полза. Престоят в болницата ще бъде съкратен за първото посещение и има други предимства, включително по-нисък риск от тромбоза и сърдечно-съдови нежелани събития от голямата първоначална инфузия [7].
Дали това наблюдение показва по-ниска доза IVIG може да се използва при пациенти със затлъстяване с автоимунни или възпалителни нарушения е по-малко сигурно. Както и в други части на света, автоимунните и възпалителни разстройства сега са причина за по-голямата част от употребата на IVIG в Нова Зеландия [16]. Имуномодулиращите IVIG дози обикновено са 2 g/kg, прилагани в продължение на 2-5 дни. Високите пикови нива на IgG могат да бъдат важни за ефикасността при автоимунни и възпалителни разстройства в сравнение с PID, където стабилното състояние по време на поддържането може да бъде по-подходящо. Последни проучвания от Канада предоставят данни, че използването на коригирано телесно тегло може да доведе до големи икономии на разходи [8, 17]. Данни за ефикасност обаче не бяха предоставени, което е важно съображение при коригиране на дозите на IVIG. Въпреки че може да е имало незабавни икономии на разходи от по-ниска доза IVIG, съществува риск от намалена ефикасност, което може да доведе до последващи разходи за здравната система [7]. По-ниските дози IVIG въз основа на коригирано телесно тегло при автоимунни и възпалителни разстройства ще трябва да бъдат валидирани в бъдещи проучвания.
Понастоящем затлъстяването е глобален проблем на общественото здраве. Бариатричната хирургия все повече се предлага на пациенти с морбидно затлъстяване, когато други интервенции са неуспешни. При тези пациенти има много ползи за здравето от намаляването на теглото, включително намален риск от диабет, хипертония, коронарна артериална болест и остеоартрит [18]. Обикновено пациентите с ИТМ> 30, които имат съпътстващи заболявания, се считат за подходящи кандидати за бариатрична хирургия. Съпътстващите заболявания, отговарящи на условията за бариатрична хирургия, включват диабет, хипертония и ставни симптоми. В много страни също има възрастови ограничения. Критериите за консенсус изключват пациенти със затлъстяване вследствие на ендокринни разстройства, както и тези, които имат сериозни психологически разстройства.
Бариатричните хирургични процедури са в процес на развитие [18]. Има няколко хирургични възможности, включително Roux-en-Y стомашен байпас, гастректомия на ръкава, дуоденален превключвател и регулируема стомашна лента. Всяка от тези процедури има своите предимства и недостатъци. Повечето процедури се извършват лапароскопски, което има много предимства, включително намалена хирургична заболеваемост. Както се вижда тук, пациентите с PID с бронхиектазии изглежда понасят добре тази процедура.
Въпреки че има много предимства при намаляване на теглото, съществуват значителни хирургични рискове и метаболитни усложнения, които трябва да бъдат взети предвид при разглеждането на тази опция. В момента оперативната смъртност е приблизително три случая на 1000 [18]. Пациентите, приети за такива хирургични процедури, се подлагат на интензивно консултиране и се насърчават да се подложат на хирургично отслабване под наблюдението на диетолога от бариатричния хирургичен екип. Моят пациент успя да загуби почти 10 кг преди операцията (фиг. 1). След операцията тя е била виждана редовно за хранителни съвети и наблюдение от бариатричния хирургичен екип. Теглото й се е стабилизирало на приблизително 63 кг и вече не страда от хипертония или преддиабет.
Моите наблюдения показват, че абсолютните изисквания за SCIG/IVIG ще намалеят значително след бариатрична хирургия при отделен пациент. Изчислих пряко спестяване на разходи от $ 10 400 годишно въз основа на нейните намалени изисквания за SCIG. Над 30 години само това спестяване ще покрие повече от разходите за процедурата. Тя не отговаря на строгите критерии за NZ за публично финансирана бариатрична хирургия, но икономическият аргумент, представен тук, е важен фактор за квалификацията й за процедурата. Очакваните икономии на разходи се материализират. Намаляването на нуждите от имуноглобулин при бъдещи пациенти с ПИД трябва да се вземе предвид при извършване на анализ на разходите и ползите.
Макар че това е единично наблюдение, пациентът служи като свой собствен исторически контрол. Това контролира фактори, свързани с пациента, включително бронхиектазии, генотип на FcRn рецептора и т.н. Предвид нарастващото разпространение на затлъстяването, ще има и други пациенти с PID, получаващи SCIG/IVIG, които в бъдеще ще се подложат на операция за намаляване на теглото. Ще бъде важно внимателно да документирате загубата на тегло и да ги сравните с техните изисквания за SCIG/IVIG. Наблюденията от такива пациенти могат да бъдат най-убедителното доказателство, че коригираното телесно тегло е най-добрият параметър за определяне на първоначалните натоварващи дози IVIG при пациенти с PID.
Препратки
Orange JS, Belohradsky BH, Berger M, Borte M, Hagan J, Jolles S, et al. Оценка на корелацията между дозата и клиничните резултати при подкожна имуноглобулинова заместителна терапия. Clin Exp Immunol. 2012; 169 (2): 172–81.
Orange JS, Grossman WJ, Navickis RJ, Wilkes MM. Въздействие на най-ниския IgG върху честотата на пневмония при първичен имунодефицит: мета-анализ на клинични проучвания. Clin Immunol. 2010; 137 (1): 21–30.
Hodkinson JP, Lucas M, Lee M, Harrison M, Lunn MP, Chapel H. Терапевтичният имуноглобулин трябва да се дозира по клиничен изход, а не от телесно тегло при пациенти със затлъстяване. Clin Exp Immunol. 2015; 181 (1): 179–87.
Berger M. Избор в IgG заместителна терапия за първични заболявания на имунната недостатъчност: подкожен IgG срещу интравенозен IgG и избор на оптимална доза. Curr Opin Allergy Clin Immunol. 2011; 11 (6): 532–8.
Bonagura VR. Доза и резултати при първични имунодефицитни нарушения. Clin Exp Immunol. 2014; 178 (Suppl 1): 7–9.
Bonagura VR. Използване на интравенозен имуноглобулин (IVIG) за лечение на пациенти с първично заболяване на имунна недостатъчност. J Clin Immunol. 2013; 33 (Suppl 2): S90–4.
Hodkinson JP. Съображения за дозиране на имуноглобулин при пациенти със затлъстяване. Clin Exp Immunol. 2017; 188 (3): 353–62.
Rocchio MA, Hussey AP, Southard RA, Szumita PM. Влияние на идеалното дозиране на телесно тегло за всички стационарни i.v. индикации на имуноглобулин. Am J Health Syst Pharm. 2013; 70 (9): 751–2.
Empson M, Sinclair J, O’Donnell J, Ameratunga R, Fitzharris P, Steele R. Оценката и управлението на първичния дефицит на антитела. NZ Med J. 2004; 117 (1195): U914.
Ameratunga R, Woon ST, Gillis D, Koopmans W, Steele R. Нови диагностични критерии за обща променлива имунна недостатъчност (CVID), които могат да помогнат при решения за лечение с интравенозен или подкожен имуноглобулин. Clin Exp Immunol. 2013; 174 (2): 203–11.
Ameratunga R, Brewerton M, Slade C, Jordan A, Gillis D, Steele R, et al. Сравнение на диагностичните критерии за често срещано разстройство с имунна недостатъчност. Преден имунол. 2014; 5: 415.
Ameratunga R, Storey P, Barker R, Jordan A, Koopmans W, Woon ST. Прилагане на диагностични и лечебни критерии за често срещано променливо имунодефицитно разстройство. Експерт Rev Clin Immunol. 2015; 12 (3): 257–66.
Ameratunga R, Lehnert K, Woon ST, Gillis D, Bryant VL, Slade CA, et al. Преглед: диагностициране на често срещано променливо имунодефицитно разстройство в ерата на геномното секвениране. Clin Rev Allergy Immunol. 2017; (в пресата).
Ameratunga R, Koopmans W, Woon ST, Leung E, Lehnert K, Slade C, et al. Епистатичните взаимодействия между мутации на TACI (TNFRS13B) и TCF3 водят до тежко първично имунодефицитно разстройство и системен лупус еритематозус. Clin Trans Immunol. 2017; (в пресата).
Khan S, Grimbacher B, Boecking C, Chee R, Allgar V, Holding S, et al. Серумното ниво на IgG и годишната интравенозна доза имуноглобулин не са свързани с размера на тялото при пациенти на редовна заместителна терапия. Drug Metab Lett. 2011; 5 (2): 132–6.
Ameratunga R, Steele R, Jordan A, Preece K, Barker R, Brewerton M, et al. Делото за национална служба за първични нарушения на имунната недостатъчност в Нова Зеландия. NZ Med J. 2016; 129 (1436): 75–90.
Chow S, Salmasi G, Callum JL, Lin Y. Подрязване на мазнината с IVIG процес на одобрение. Transfus Apheresis Sci. 2012; 46 (3): 349–52.
Nguyen NT, Varela JE. Бариатрична хирургия при затлъстяване и метаболитни нарушения: състояние на техниката. Nat Rev Gastroenterol Hepatol. 2017; 14 (3): 160–69. doi: 10.1038/nrgastro.2016.170.
Благодарности
Благодаря на пациента за разрешението да публикува този случай в полза на другите. Благодаря на д-р Майкъл Бут за неговите коментари относно бариатричната хирургия.
Конкуриращи се интереси
Авторът не декларира конкуриращи се интереси.
Съгласие за публикуване
Пациентът се съгласи да публикува този доклад. Няма пречки за публикуване.
Няма допълнителни данни.
Етично одобрение и съгласие за участие
Това е стандартно лечение. Няма етични въпроси, свързани със стандартната клинична практика. Това не е интервенционно проучване.
Финансиране
Това проучване е финансирано от вътрешната страна.
Бележка на издателя
Springer Nature остава неутрален по отношение на юрисдикционните претенции в публикувани карти и институционални принадлежности.
Информация за автора
Принадлежности
Отделение по клинична имунология, болница в Окланд, Park Rd, Grafton 1010, Auckland, Нова Зеландия
Можете също да търсите този автор в PubMed Google Scholar
- Хормоналната инжекция помага за отслабване при пациенти със затлъстяване
- Лапароскопска хистеректомия и хирургия за отслабване при пациенти със затлъстяване с ендометриум
- Хипноза, самохипноза и отслабване при затлъстели пациенти - изглед в пълен текст
- Инжектирането на хормони помага за отслабване при пациенти със затлъстяване и диабет, установява проучване ITV News
- Въображаемо хранене; подвежда тялото да отслабне - Институт за биологични изследвания Salk