АНДРЕЙ Л. КОНЕВЕГА
1 Петербургски институт по ядрена физика, Руска академия на науките, 188300 Гатчина, Русия
НАТАЛИЯ Г. СОБОЛЕВА
1 Петербургски институт по ядрена физика, Руска академия на науките, 188300 Гатчина, Русия
ВАЛЕНТИН И. МАХНО
1 Петербургски институт по ядрена физика, Руска академия на науките, 188300 Гатчина, Русия
ЮРИ П. СЕМЕНКОВ
1 Петербургски институт по ядрена физика, Руска академия на науките, 188300 Гатчина, Русия
WOLFGANG WINTERMEYER
2 Институт по молекулярна биология и
МАРИНА В. РОДНИНА
3 Институт по физическа биохимия, Университет на Витен/Хердеке, 58448 Витен, Германия
ВЛАДИМИР И. КАТУНИН
1 Петербургски институт по ядрена физика, Руска академия на науките, 188300 Гатчина, Русия
Резюме
ВЪВЕДЕНИЕ
Взаимодействието между кодон и антикодон играе централна роля в декодирането на иРНК върху рибозомата. Каноничната структура на антикодоновата верига е от съществено значение за взаимодействията както с A, така и с P сайтове (Yusupov et al. 2001) и е еволюционно запазена. Антикодонната верига се дефинира от наличието на редица запазени и полуконсервирани нуклеотиди, които образуват разширен структурен подпис (Auffinger and Westhof 2001). В 5 'края на цикъла, пиримидинова основа се намира в позиция 32, последвана от инвариант U в позиция 33. Различни модифицирани нуклеотиди се намират в позиция 34, които основават двойки към позиция 3 на кодона, докато nt 35 и 36, които взаимодействат съответно с позиции 2 и 1 на кодона, показват само ограничен брой модификации. Основите в позиции 37 и 38 са предимно пурини, които в позиция 37 често са хипермодифицирани. Анализът на последователността на> 3000 тРНК гени от различни организми показва, че А се намира на позиция 37 в
80% и G в 20% от всички тРНК (Sprinzl et al. 1998). В
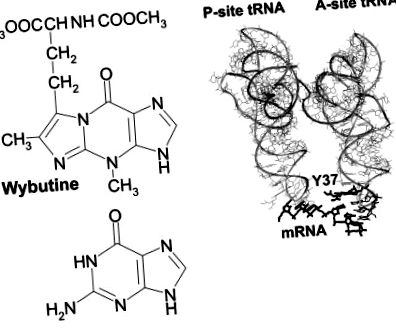
26% от тРНК се открива немодифициран А; най-честите модификации в позиция 37 са t 6 A и m 1 G. Типът на модификацията варира в зависимост от спецификата на кодиране. По принцип tRNAs, които имат само G и C основи в своите антикодони, никога нямат модифициран пурин, съседен на 3 ′ страната на антикодона, докато всички tRNAs с поне две A или U бази имат хипермодифициран пурин в тази позиция. Например, почти всички специфични за фенилаланин тРНК (антикодон GAA) имат такива модификации, най-често към вибутин (фиг. 1 ▶), пероксивибутин или 2-метилтио-N 6-изопентениладенин.
(A) Структура на основата Y (често използван символ за wybutine, систематичен символ yW; базата данни за модифициране на РНК, http://medlib.med.utah.edu/RNAmods) в сравнение с G. (B) Разположение на основата Y (Y37) в комплекса от дрожди tRNA Phe с U6-mRNA в A място на Thermus thermophilus рибозоми (Yusupov et al. 2001); Показана е също тРНК на P-сайта. Y37 и U6-mRNA са подчертани.
Проучванията в моделни системи показват, че модификациите на базата в позиция 37 стабилизират взаимодействията между тРНК и тРНК чрез подобряване на подреждането на вътрешно нишки в антикодоновия контур и натрупването на междупластови между кодон и антикодон основи (Grosjean et al. 1998). Използвайки моделна система от две тРНК с допълнителни антикодони, беше показано, че комплексът тРНК • тРНК е с шест порядъка по-стабилен от очакваното за сравнима двойна спирала от три двойки основи между тринуклеотиди (Grosjean et al. 1976, 1978). Три структурни характеристики са идентифицирани като източници за подобряване на стабилността: ограничението на контура, общото влияние на висящите краища и специфичният ефект на модифицираните нуклеотиди, като последните допринасят до порядък за стабилността на комплекса. Образуването на комплекси, съдържащи tRNAs с модифициран нуклеотид в позиция 37, е придружено от по-голяма енталпийна промяна, в сравнение с тези без модификацията или без Y база, което предполага ефект на модификацията върху подреждането (Grosjean et al. 1976).
РЕЗУЛТАТИ
Основните замествания в позиция 37 влияят на стабилността на свързване на пепт-тРНК в А място
Когато рибозомните комплекси с wt pept-tRNA Phe бяха инкубирани при 37 ° С и 10 mM Mg 2+, ▶). За разлика от това, дисоциацията на всички немодифицирани транскрипти на pept-tRNA беше много по-бърза и имаше значителни разлики в стабилността на A-сайта, в зависимост от естеството на основата в позиция 37, с полуживоти на комплекси, вариращи от 1 h ( Y37A) до няколко минути (Y37U, Y37C). Това показва, че свързването на A-сайта е силно повлияно от естеството на nt 37 в антикодоновия цикъл. По-нататък се изследва термодинамичната основа за тези ефекти.
- Отслабване на статичния ви сайт Hugo Allison Letson
- Скарлет Йохансон Фен - Вашият най-дълъг и работещ сайт на Скарлет в мрежата
- Видов профил Жълт костур, Perca flavescens Рибната зона
- Официален сайт на Phytodren ™ - Формула за отслабване с максимална сила
- Социално-икономическо положение и затлъстяване сред децата и техните родители в Република Беларус