Шенгда Лин
1 Катедра по медицина, Медицински факултет на Станфордския университет, Станфорд, Калифорния 94305
Elisabete M. Nascimento
1 Катедра по медицина, Медицински факултет на Станфордския университет, Станфорд, Калифорния 94305
Чандреш Гаджера
1 Катедра по медицина, Медицински факултет на Станфордския университет, Станфорд, Калифорния 94305
Лу Чен
1 Катедра по медицина, Медицински факултет на Станфордския университет, Станфорд, Калифорния 94305
Патрик Нойхофер
1 Катедра по медицина, Медицински факултет на Станфордския университет, Станфорд, Калифорния 94305
Алина Гарбузов
1 Катедра по медицина, Медицински факултет на Станфордския университет, Станфорд, Калифорния 94305
Суй Уанг
2 Катедра по офталмология, Медицински факултет на Станфордския университет, Станфорд, Калифорния 94305
Стивън Е. Артанди
1 Катедра по медицина, Медицински факултет на Станфордския университет, Станфорд, Калифорния 94305
3 Програма за биология на рака, Медицински факултет на Станфордския университет, Станфорд, Калифорния 94305
4 Катедра по биохимия, Медицински факултет на Станфордския университет, Станфорд, Калифорния 94305
Свързани данни
Изходните данни за проучването RNA-seq са достъпни в хранилището на GEO под номера за присъединяване> GSE104415.
Резюме
Той патоцитите изпълняват метаболитни дейности на черния дроб и показват функционална хетерогенност по оста в рамките на лобулата, определена от порталната вена до централната вена 12. В крайните краища на тази ос перицентралните хепатоцити Axin2 + репопулират черния дроб по време на нормална хомеостаза 13, докато перипорталните хепатоцити, маркирани с експресия на Sox9, са неактивни по време на хомеостазата, но се разширяват с хронични химически увреждания 14. Наблюдения, показващи, че пролифериращите хепатоцити са разположени в цялата лобула 15,16, предполагат допълнителни източници на репопулация на хепатоцити. Теломеразата синтезира повторения на теломери и е свързана с дългосрочно обновяване в стволовите клетки и при раковите заболявания 17. Инактивиращите мутации на зародишни мутации в гените на теломераза предразполагат към цироза при хора 9,10 и при мишки 11, докато активиращите мутации в промотора TERT представляват най-често повтарящите се мутации в хепатоцелуларен карцином 18. Предвид важните роли на теломеразата при чернодробни заболявания и наблюденията, че теломеразата се намира в отделенията на стволови клетки в множество тъкани за възрастни 19-22, предположихме, че теломеразата може да се експресира в чернодробни клетки с уникални свойства.
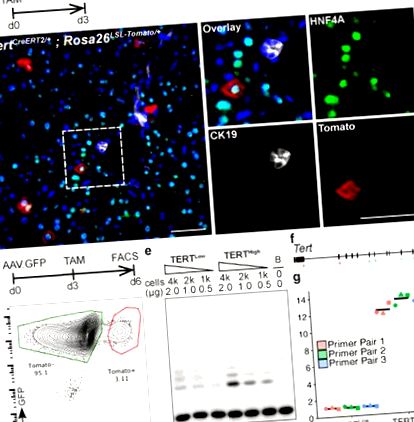
a-b, Анализ на имунофлуоресценция (IF) върху Tert CreERT2/+; Rosa26 LSL-Tomato/+ черен дроб, третиран с еднократна доза тамоксифен и анализиран 3 дни след инжектирането. Показани са домат (червен), HNF4A (зелен), CK19 (бял) и DAPI (син). c-g, Анализ на експресията на теломераза в сортирани по FACS хепатоцити. Представителен FACS парцел (д), Анализ на TRAP (д, B: Само буфер) и количествена PCR с обратна транскрипция (е, позиция на двойките грундове) (ж, fold-changes.n = 3 мишки, всяка обозначена с уникални точкови форми; кръстосана лента: средно). Експерименти, повторени три пъти за б, повече от пет пъти за д, и два пъти за д и ж. Скала, 50 μm.
a-i, Проследяване на родословието в Tert CreERT2/+; Rosa26 LSL-Tomato/+, третиран с еднодозова тамоксифен (b-g) или маслено превозно средство (i) и анализирани в посочените периоди за проследяване от IF за домат. Количествено определяне на областта домат + хепатоцити (з, n = 4, 5, 4, 4, 7, 5 мишки за всяка времева точка; напречна лента: средно). j-m, Co-IF за домати и GS inTert CreERT2/+; Rosa26 LSL-Tomato/+ микрометрично за 3 дни, 6 месеца или една година. Количествено определяне на Tomato + GS + фракция от GS + хепатоцити (м, п = 4, 5, 5 мишки за всяка точка от времето; напречни стълбове, средно). не, Резултатите от RNA-seq са пречистени от FACS TERT High (Tomato +) или TERT Low (Tomato -) хепатоцити (n = 3 мишки за всяка група). Сюжет за вулкан за обогатени гени и GO термини (н,граници: q 0,8). GSEA анализ за обогатени генни набори (o, брой гени, показани за всеки набор от гени). Експерименти, повторени два пъти за времеви точки в б,е,ж,j-l. Мащабни ленти, 100 μm.
За да разберем как TERT High клетките се различават от насипните хепатоцити, извършихме RNA-seq на TERT High и TERT Low хепатоцити, изолирани от FACS от три Tert CreERT2/+; Rosa26 LSL-Tomato/+ мишки три дни след лечение с тамоксифен. RNA-sq показва 3172 гена, диференцирано експресирани между двете популации (q Фиг. 2n) (Разширени данни Фиг. 3j). Анализът на генната онтология (GO) (фиг. 2n) и базата данни за анотации, визуализация и интегрирано откриване (DAVID, разширени данни, фиг. 3j) показват, че гените на клетъчния цикъл са увеличени в популацията TERT High, докато рибозомните гени и гените на митохондриите са регулирани нагоре в TERT Ниска популация. Анализът за обогатяване на генни набори (GSEA) разкрива засилено представяне на генни набори, свързани с клетъчното делене и активността на рецепторната тирозин киназа в популацията TERT High (фиг. 2o, червено), и намалено представяне на генни набори, свързани с рибозомни компоненти, митохондриални протеини, електрон гени на транспортната верига и метаболитни дейности на хепатоцитите (фиг. 2о, сиво). Пролиферацията в INTERT Високи хепатоцити е повишена в сравнение с TERT Ниски хепатоцити (6,4 ± 1,0% срещу 0,9 ± 0,1%) чрез включване на 5-етинил-2′-деоксиуридин (EdU) (7-дневна питейна вода, разширени данни Фиг. 6). Заедно тези данни показват, че TERT High хепатоцитите са по-малко инвестирани в метаболитните и синтетичните функции на насипните хепатоцити и са по-отдадени на пролиферацията и хомеостатичното обновяване.
а-ч, 3D анализ на рядко маркирани хепатоцитни клонинги в Tert CreERT2/+; Rosa26 LSL-Tomato/+ мишки, лекувани с ниски дози тамоксифен, проследявани в продължение на 3 дни, 3 месеца или 6 месеца. Размери на клонинги (b, c) и номер на клонинг на обем (д) (n = 5, 3 и 4 мишки, съответно; всяка мишка, представена с уникален точков цвят в ° С; напречна лента: средно). Co-IF за Tomato и GS за оценка на местоположението на клонинг в 6-месечни проби за проследяване (e-h). Количествено определяне на размера и позицията на клонинга спрямо GS + клетките (з).i-r, Едномолекулна РНК РИБА на пречистен FACS TERT Високо производен (л-н) и TERT Ниско получени (o-q) хепатоцити. Количествено определяне по броя на фокусите (r, n = 3 мишки на времева точка, всяка мишка е обозначена с уникални точки. Баровете и грешките са средни стойности + SEM. За клетки с> 5 фокуса, p1month-3days = 0.56, p1year-3days = 2.7e-5, p1year-1month = 4.3e-5). Експериментите се повтарят два пъти. Скала, 50 μm.
TERT High хепатоцитите могат да генерират клонинги или чрез механизъм за самообновяване, при който първоначалната клетка остава TERT High, а потомството е TERT Low (Фиг. 3j), или прост механизъм за дублиране, при който всички дъщерни клетки остават TERT High (Фиг. . 3k). За да разграничим тези механизми, изследвахме mRNA Tert с едномолекулна РНК FISH върху сортирани Tomato + и Tomato - хепатоцити от различни периоди на проследяване (фиг. 3i, l-r), както и хепатоцити от див тип (разширени данни фиг. 7). Установихме, че процентът на Tomato + клетки с висока Tert иРНК (> 5 mRNA огнища) е сравним на три дни и един месец (80.3 ± 2.0% срещу 75.3 ± 4.8%), но намалява до 18.0 ± 2.2% след една година . Доматните клетки останаха TERT Low, независимо от периодите на проследяване. Наличието на редки клетки в тази фракция с висока Tert иРНК вероятно показва непълна рекомбинация с CreER T2. Тези проучвания показват, че субпопулацията TERT High както се самовъзобновява, за да попълни клетките TERT High, така и се диференцира, за да даде дъщерни клетки TERT Low.
За да разберем способността на хепатоцитите TERT High да попълват клетките, повредени в перицентралната зона, елиминирахме перицентралните хепатоцити чрез инжектиране 25 с еднодозова въглероден тетрахлорид (CCl4) (разширени данни, фиг. 8в-f). Въпреки че TERT High хепатоцитите са рядкост в перицентралната зона GS +, се забелязва значително увеличение на броя на клетките GS + Tomato + в седем дни след нараняване (фиг. 4а-е). Тези данни показват, че нараняването на перицентралните хепатоцити активира близките хепатоцити TERT High и че тяхното потомство приема нова зонална идентичност при зарастване на перицентрални рани. За да разберем дали TERT High хепатоцитите допринасят за регенерацията на хепатоцитите след глобално увреждане, предизвикахме черния дроб с диета с 0,1% 3,5-диетоксикарбонил-1,4-дихидроколидин (DDC) (фиг. 4g и разширени данни фиг. 8g, h). Установихме значително разширяване на домати + хепатоцити след едномесечна DDC-диета (38,0 ± 3,2% срещу 5,6 ± 0,3% в контролния дроб) (Фиг. 4g-j) Някои потомци на TERT High клетки приеха проточна съдба (разширени данни, фиг. 9), в съответствие с известната пластичност на хепатоцитите при DDC нараняване 26. Тези открития разкриват, че TERT High хепатоцитите репопулират хепатоцитите с ускорена скорост в условията на химическо увреждане.
a-f, Чернодробно увреждане с единична доза CCl4. Tert CreERT2/+; Rosa26 LSL-Tomato/+ мишки, третирани с масло носител (б,° С) или CCl4 (д,д) анализирано от IF за домати и GS в ден 7 след третирането. IF Количествено определяне (е); бели линии, GS + перицентрална зона (n = 5 мишки). g-j, DDC увреждане, предизвикано от диета при Tert CreERT2/+; Rosa26 LSL-Tomato/+ мишки. АКО на черния дроб за Домат след 30-дневно лечение с нормална диета (з) или DDC диета (i). IF количествено определяне (j) (n = 4 мишки). k-m, Аблация на хепатоцити TERT High чрез инжектиране на AAV.lsl.dtA на Tert CreERT2/+; Rosa26 LSL-Tomato/+ мишки (n = 4 мишки), количествено определяне на Tomato + клетки (м). n-v, Генетична аблация, последвана от DDC увреждане в Tert CreERT2/+; Rosa26 LSL-Tomato/+ мишки. Черен дроб, анализиран от Sirius Red за колаген (o-q), SMA за активирани звездни клетки (r-t) и клетки CK19 + (u-w) (п = 4 мишки). AAV.GFP инжектирани контролни животни (o, r, т) и AAV.lsl. DTA инжектирани животни (стр, с, uКръстосани стълбове: средно. Експерименти, повторени поне два пъти. Мащабни ленти, 100 μm.
а, Хепатоцитите TERT High генерират разширяващи се клонове, състоящи се както от TERT High, така и от TERT Low хепатоцити. б, Редки TERT Високи хепатоцити, разпределени в лобулите, образуват уголемяващи се клонове по време на хомеостазата в отговор на локалната загуба на хепатоцити. ° С, Повторното заселване на наранен черен дроб чрез клоново разширяване на TERT Високи хепатоцити се ускорява по време на нараняване. Сини съдове, портални и централни вени; розов съд, чернодробна артерия; малки зелени клетки, холангиоцити; големи зелени клетки, перицентрални хепатоцити; червени клетки, TERT Високи хепатоцити; черни клетки, увредени хепатоцити.
Методи
Генериране на нокаут линия Tert CreERT2
Целевият вектор е генериран чрез сериен рекомбинант и клониране на порта. Хомологичните рамена (mm10 chr13: 73,621,344 - 73,631,102) бяха клонирани от BAC (RP24-342O18) чрез рекомбинация. Оптимизирана за кодон интрон-CreERT2-NeoR касета 27 беше вмъкната в ендогенното транслационно начално място на Tert (mm10 chr13: 73,627,032 - 73,627,033) чрез рекомбинация. Окончателният насочващ вектор е създаден чрез портално клониране към pWS-TK2 вектора с тимидин киназни касети в двата края на хомологичните рамена, както е описано по-горе 28. Целевият вектор беше линеаризиран и електропориран в JM8/F6 миши ES клетки. Правилно насочени ES клонинги бяха избрани от южни петна и кариотипи и след това инжектирани в BALB/c бластоцисти, за да се генерира ударната линия. Мишките Tert CreERT2/+ са родени с нормална менделова честота. За да се провери ефикасността на CreERT2 в ES, клонингът Tert CreERT2/+ беше насочен с модифициран вектор за насочване „Rosa26-mTmG“ 29, използващ HygroR като селекционен ген. Клетките с двойно разбиване бяха третирани с 500 nM 4-хидрокси тамоксифен (4-OHT), за да се оцени ефективността на рекомбинацията.
AAV производство
Всички AAV, използвани в това проучване, са произведени с цис-плазмиди, съдържащи пълния TBG промотор [две копия на елементите на усилвателя на α-1-микроглобулин/бикунин (AMBP), последвани от промотора на гена SERPINA7 и мини-интрон], плазмид за опаковане на серотип AAV8 и помощен плазмид на аденовирус. Закупени са AAV.GFP (AAV8.TBG.PI.eGFP.WPRE.bGH, каталог №: AV-8-PV0146) и AAV.Cre (AAV8.TBG.PI.Cre.rBG, каталог № AV-8-PV1091) от University of Pennsylvania Vector Core. AAV.lsl.dtA съдържа силен SV40 стоп елемент, клониран от Lox-Stop-Lox TOPO плазмид 30 (addgene Plasmid # 11584). AAV.flex.dtA беше модифициран от pAAV-mCherry-flex-dtA 31 (addgene Plasmid # 58536) със следните промени: EF-1α промоторът беше заменен с TBG промотор и mCherry беше заменен с EGFP. Клетките HEK293T бяха трансфектирани и отгледани в многослойни колби на Corning за производство на вируси. Вирусите бяха пречистени чрез градиентно ултрацентрифугиране 32 с йодиксанол (Sigma-Aldrich) и титрувани с qPCR 33 и SYPRO Ruby (ThermoFisher) оцветяване с протеинов гел със стандарти.
Животни
Tert CreERT2/+ мишки бяха отгледани с Rosa26 reporter (Gt (ROSA) 26Sortm14 (CAG-tdTomato) Hze/J) 34, за да генерират Tert CreERT2/+; Rosa26 LSL-Tomato/+ мишки за анализ. Двумесечни мишки се инжектират интраперитонеално с тамоксифен (Caymon, 1 mg/10 g тегло), разтворени в 100 μL сусамово масло (Sigma-Aldrich). Разредено маркиране е постигнато чрез инжектиране на тамоксифен при тегло 0,08 mg/10 g. EdU (Carbosynth) се прилага чрез питейна вода (1 mg/ml) дневно в продължение на седем дни. AAV се разрежда до 4e11 геномни частици в 100 μL нормален физиологичен разтвор (на мишка) и се инжектира интравенозно. За DDC нараняване мишките са получили диета TD.07571 (Harlan), съдържаща 0,1% DDC (Sigma-Aldrich) ad libitum. За увреждане на CCl4, мишките се инжектират с течен CCl4 (Sigma-Aldrich, 10 μL/10 g тегло), разтворен в сусамово масло (Sigma-Aldrich).
Статистика
При сравняване на две групи р стойностите бяха определени чрез двустранния несдвоен t-тест. Когато се сравняват повече от две групи, р стойностите бяха определени чрез еднопосочен ANOVA с HSD тест на Tukey, извършен като post hoc анализ. Значимостта на данните също беше тествана чрез непараметрична статистика, използвайки двустранен несдвоен тест на Wilcoxon – Mann – Whitney за двугрупово сравнение и еднопосочен ANOVA на Kruskal – Wallis за рангове с тест Conover – Iman, извършен като post hoc анализ за повече отколкото две групи. Проведен е тест на Колмогоров-Смирнов, за да се сравнят моделите на разпределение на непрекъснатите променливи. Животните бяха разпределени на случаен принцип към всяка експериментална/контролна група. Изследователите не бяха заслепени за разпределение по време на експерименти и оценка на резултатите. Данните са представени като „средно ± SEM“ в текста. Графиките са генерирани от ggplot2 пакета 35 в R.
Експерименти на FACS
Клетките бяха изолирани чрез стандартна двустепенна перфузия на колагеназа. Чернодробната перфузионна среда (Life Technologies) и филтрираната (0,22 μm) чернодробна хранителна среда (Life Technologies) бяха перфузирани последователно през порталната вена, съгласно инструкциите на производителя. Дисоциираният черен дроб се прекарва през 100μm клетъчно цедка и хепатоцитите се обогатяват чрез нискоскоростно центрофугиране (50xg за 3 минути) за три пъти в хепатоцитна промивна среда (Life Technologies). Клетките се анализират и/или сортират с BD Aria II поточен цитометър, като се използва дюза 100 μm. Мъртвите клетки бяха изключени въз основа на включването на Topro3 (1 μM) или DAPI (1 μM) (Life Technologies). За анализ на плоидността, хепатоцитите бяха инкубирани в Hoechst33342 (15 μg/ml) и Reserpine (5 μM) при 37 градуса за 30 минути преди анализ.
Имунофлуоресценция (IF), имунохистохимия (IHC), откриване на EdU, едномолекулна РНК FISH и Sirius Червено оцветяване
qPCR и RNAseq
Анализ на изображенията
Флуоресцентните изображения бяха анализирани от Leica LAS AF, ImageJ, Adobe Photoshop и Fluorender. Индексът на площта се дефинира от чернодробната област, покрита от Tomato + клетки като процент от общата площ и се определя количествено от ImageJ. 3D реконструкцията беше извършена с помощта на Fluorender. Многоклетъчните клонинги са изобразени в 258 × 258 × 100 μm 3 обема чрез конфокален микроскоп Leica SP8 или двуфотонен микроскоп Prairie Ultima IV. Клонингите, съставени от повече от осем клетки, често удължават обема на изображението и поради това се броят като осем клетки. Планарният изглед на повърхността е създаден чрез максимална проекция на първите 12 μm обем близо до повърхността до приблизителни резултати от оцветяване от тънки участъци. За ко-имунооцветяване с GS са изобразени 580 × 580 × 100 μm 3 обема. Зашити изображения с една равнина са обработени от отделни плочки от Adobe Photoshop. Броят на хепатоцитите EdU +, Ki67 +, GS +, CK19 + бяха преброени ръчно.
TRAP анализи
Протоколът за повторно усилване на Telomere (TRAP) се извършва по предварително установен протокол 40. FACS-сортирани клетки или хомогенизирана тъкан бяха лизирани в NP40 буфер (25 mM HEPES-KOH, 400 mM NaCl, 1.5 mM MgCl2, 10% глицерол, 0.5% NP40 и 1 mM DTT [рН 7.5], допълнени с протеазни инхибитори).
Етично съответствие
Всички протоколи за животни са одобрени от институционалния комитет за грижа и употреба на животните в Станфордския университет. Всички експерименти са спазили съответните етични разпоредби на Станфордския университет.
Наличност на код
Кодовете се предоставят от съответния автор при поискване.
Наличност на данни
Изходните данни за проучването RNA-seq са достъпни в хранилището на GEO под номера за присъединяване> GSE104415.
- Централна роля на мастния черен дроб в патогенезата на инсулиновата резистентност при затлъстяващи юноши
- Диетични промени за лечение на мастна чернодробна болест и неалкохолен стеатохепатит dLife
- Център за мастни чернодробни заболявания - NYC ColumbiaDoctors Детско здраве
- Жаби; нараняване или болест на жабите
- Безалкохолната чернодробна болест, предизвикана от диета за бързо хранене, оказва ранен защитен ефект срещу