Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Кореспонденция
Jiangang Yang, Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай.
Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Кореспонденция
Jiangang Yang, Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай.
Национална инженерна лаборатория за индустриални ензими, Институт по индустриални биотехнологии в Тиендзин, Китайска академия на науките, Тиендзин, Китай
Резюме
1. ВЪВЕДЕНИЕ
Хинап (Ziziphus jujuba Мелница), бодливо рамно растение, е известно като китайска хинап или червена фурма. Плодовете хинап съдържат много хранителни съставки като полизахарид, тритерпеноид, флавоноиди, витамини, цикличен нуклеотид и фенолни съединения (Du et al., 2013; Lee, Min, Lee, Kim, & Kho, 2003; Li, Fan, Ding, И Динг, 2007). Специално плодовете хинап съдържат определено количество цикличен аденозин монофосфат (сАМР), който има положителен ефект върху сърдечния мускул, хранителния миокард, диастолните кръвоносни съдове, антиаритмията и антиагрегантната агрегация (Beavo & Brunton, 2002). Разработването на функционални храни, богати на лагер, има голям икономически потенциал и пазарна стойност. Хинапът също се използва като традиционно китайско лекарство (TCM) от хилядолетия с многобройните си здравословни ефекти, като противовъзпалително (Yu et al., 2012), противораково (Plastina et al., 2012), стомашно-чревно защитно (Huang, Yen, Sheu, & Chau, 2008), антиоксидант (Cheng, Zhu, Cao, & Jiang, 2012), анти-безсъние и невропротективни ефекти (Yoo et al., 2010).
Доказано е, че технологията за ферментация на млечнокисели бактерии е ефективен начин за поддържане или подобряване на вкуса, безопасността, храненето, качеството и срока на годност на плодовете и зеленчуците. Хранителната стойност на ферментиралите храни се увеличава чрез натрупване на свободни аминокиселини (FAA) по време на процеса на ферментация. Обикновено някои млечнокисели бактерии произвеждат γ-аминомаслена киселина (GABA), която има невротрансмисия, хипотония, диуретик и транквиланти (Wong, Bottiglieri, & Snead, 2003). Разработването на обогатени с GABA напитки, използвайки метод на ферментация, успя да постигне сок от черна малина (Kim, Lee, Ji, Lee, & Hwang, 2009), мляко (Nejati et al., 2013) и темпе-подобна напитка (Aoki, Furuya, Endo и Fujimoto, 2003). В допълнение, млечнокиселите бактерии като пробиотици все повече се използват като хранителни добавки. Пробиотичните продукти обикновено се предлагат на пазара под формата на ферментирали млечни продукти, плодови или зеленчукови сокове (сок от моркови, доматен сок), които служат като среда за растеж на клетките.
В това проучване се опитваме да увеличим хранителната стойност на концентрирания/извлечен сок от хинап чрез свързване на ензимна трансформация и ферментация на млечнокисели бактерии. Съпоставя се съдържанието на глюкоза и фруктоза в различни видове хинап. Два ензима, GI и DAE, бяха комбинирани, за да превърнат глюкозата и фруктозата в нискокалорична по-сладка D-алулоза. Освен това, ферментацията на сок от хинап с помощта на два вида млечнокисели бактерии се извършва, за да се увеличи съдържанието на GABA и много свободни аминокиселини.
2. МАТЕРИАЛИ И МЕТОДИ
2.1 Ензими, щамове и материали
D-алулозната 3-епимераза (DAE) се приготвя съгласно екстрацелуларното производство чрез секретна експресионна система (Chen et al., 2016). D-глюкозната изомераза (GI) е закупена от Novozymes ®, Ltd в Китай. Активността на DAE достига 31,0 U/ml и GI е 400 IGIU/g. Млечнокисели бактерии, като напр Pediococcus pentosaceus PC ‐ 5, Lactobacillus plantarum М, Lactobacillus rhamnosus, и Lactobacillus acidophilus, се съхраняват в нашата лаборатория. Пет вида плодове хинап, използвани в тази статия, са събрани от септември до октомври 2016 г. в град Тайюан в провинция Шанси, Китай.
2.2 Анализ на съдържанието на захар в пет плода хинап
Ziziphus jujuba обикновено се нарича хинап или китайска фурма. В това проучване плодовете хинап от пет сорта (Changhong, J-CH; Dongzao, J-DZ; Jinsi, J-JS; Pozao, J-PZ и Yuanling, J-YL) бяха събрани през есента. Всички проби от хинап се нарязват, варят се във вода в продължение на 3 часа и след това остатъкът се отстранява, за да се получи концентриран сок. Съдържанието на глюкоза, фруктоза и захароза се анализира чрез високоефективна течна хроматография (HPLC), снабдена с детектор на показателя на пречупване и една колона Sugar-Pak ™ (6.5 mm × 300 mm; Води). Общият полизахарид беше определен с колориметричен метод фенол-сярна киселина (Cheung et al., 2009). Редуциращата захар е открита по DNS метод (Cheung et al., 2009).
2.3 Ензимното превръщане на монозахарид в сок от хинап
Ензимната трансформация, катализирана от GI и DAE, се извършва при 55 ° С в концентриран сок от хинап, рН на който се регулира до 6,0, използвайки 1 М NaHCO3. След реакция в продължение на 4 часа, пробите се анализират чрез HPLC, за да се изчисли концентрацията на D-алулоза. Изследван е ефектът от температурата (от 50 до 65 ° C), рН (от 4,0 до 8,0) и количеството ензим (от 0,5 до 2,0 g/L) върху превръщането на D-алулоза.
2.4 Ферментация на сок от хинап с помощта на млечнокисели бактерии
Pediococcus pentosaceus PC ‐ 5 и L. plantarum М бяха избрани за оценка на клетъчния им растеж, производството на киселина и съдържанието на общите полифенолни и общите флавоноиди. Избраните стартери се култивират предварително в MRS среда при 37 ° C за 24 часа до приблизително 10 8
10 9 c.f.u/ml. След това клетките се инокулират в концентриран сок от хинап с шесткратно разреждане в колби от 500 ml. След това процесът на ферментация се провежда при 37 ° С в продължение на 24 часа. Пробите бяха събрани за HPLC и анализ на клетъчния растеж. Жизнеспособните клетки (cf/u/ml) се определят чрез стандартния метод за броене на плаки.
2.5 Анализ на хранителни съставки
Концентрациите на органични киселини (млечна и оцетна киселина) се определят количествено чрез HPLC, като се използва колона Aminex HPX-87H (изключване на йони, BioRad) с UV детектор, работещ при 210 nm. Използва се подвижна фаза от 10 mM разтвор на H2SO4 при скорост на потока 0,6 ml/min и колоната работи при 60 ° C.
FAA и γ-аминомаслената киселина (GABA) бяха определени чрез HPLC, използвайки ZORBA Eclipse-AAA (4.6 mm × 150 mm; Agilent) с UV детектор, работещ при 338 nm. Подвижните фази бяха А (равновесна фаза): натриев дихидроген фосфат (40 тМ) и В (фаза на елуиране): ацетонитрил: метанол: вода (45:45:10). Боратен буфер се използва като производен реагент. Скоростта на потока е 2 ml/min при 40 ° С.
Концентрацията на сАМР също се измерва чрез HPLC, използвайки обратна фаза Ultimate C18 колона (21,2 mm × 250 mm, 5 μm частици, Welch, Шанхай, Китай) с UV детектор, работещ при 254 nm. Подвижна фаза на калиев дихидроген фосфат (20 mM): разтвор на метанол = 80:20 се използва при 0,8 ml/min и колоната работи при 40 ° C.
Металните йони бяха определени с помощта на атомно-абсорбционен спектрофотометър (Spectra-AA220, Varian Co., Palo Alto, CA, USA) след разграждане в смесени киселини (азотна киселина: перхлорна киселина = 4: 1). Съдържанието на фосфор се определя по метода на молибденово синьо при дължина на вълната 660 nm (Wei, Chen и Xu, 2009).
Общото съдържание на феноли в сок от хинап е определено съгласно колориметричния метод Folin-Ciocalteu (Tawaha, Alali, Gharaibeh, Mohammad, & El-Elimat, 2007). Проба от 0,2 ml се смесва с 0,2 ml реактив на Фолин – Чиокалтеу при стайна температура за 3 минути. След това към сместа се добавят 0,4 ml 10% Na2C03. След престой в продължение на 60 минути, абсорбцията се измерва със спектрофотометър при 725 nm.
Съдържанието на общите флавоноиди се измерва съгласно метода NaNO2 – AlCl3 – NaOH (Fu, Xu, Zhao и Ma, 2006). Накратко, 30 μl разредена проба (1: 2) в метанол се смесва с 9 μl NaNO2 (5%). След реакция в продължение на 6 минути се добавят 18 μl AlCl3 (10%). Допълнителна реакция в продължение на 5 минути, към сместа бяха добавени 60 μl NaOH (1 М). Обемът на сместа се регулира до 300 μl с дестилирана вода и след това се измерва при 510 nm. За изчисляване на стандартната крива бяха използвани различни концентрации на рутин (0,1-500 mg/L).
3 РЕЗУЛТАТИ И ДИСКУСИЯ
3.1 Анализ на съдържанието на захар
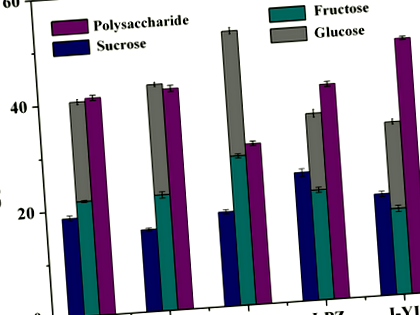
Беше известно, че хинапът съдържа висока концентрация на захар; съдържанието на захар обаче има очевидна разлика между сортовете (Li et al., 2007). Тук сравнихме със съдържанието на обща захар захароза, намалявайки захарта в сок от хинап от пет различни сорта (J-CH, J-DZ, J-JS, J-PZ, J-YL), които са широко разпространени в Китай . Съдържанието на захароза в пет сорта беше
3.2 Биоконверсия на D-алулоза в концентриран сок от хинап
Сокът от хинап J-JS съдържа високо съдържание на глюкоза и фруктоза, които са висококалорична захар. Директното въвеждане на сок от хинап J-JS в хранителна напитка би увеличило риска от затлъстяване, диабет и сърдечно-съдови заболявания (Bocarsly, Powell, Avena и Hoebel, 2010; Goran, Ulijaszek и Ventura, 2013; Stanhope et al., 2015 ). Ензимната стратегия за трансформация чрез използване на глюкозна изомераза (GI), която катализира изомеризацията на глюкоза до фруктоза и D-алулоза 3-епимераза (DAE), която катализира епимеризацията на фруктоза до D-алулоза, успя да превърне глюкозата и фруктоза във високофруктозен царевичен сироп (HFCS) до D-алулоза и повишава нейната хранителна стойност (Men et al., 2014). Тук, за да получим един вид сок от хинап, съдържащ „здравословна захар“, ние се опитахме да комбинираме GI и DAE за превръщане на глюкоза и фруктоза в концентриран сок от хинап в D-алулоза. Концентрацията на D-глюкоза и D-фруктоза в концентрирана хинап е била съответно 350 и 360 g/L (Таблица 1).
| Глюкоза (g/L) | 352,16 ± 10,23 | 305 ± 8,26 | 295 ± 6,32 |
| Фруктоза (g/L) | 360,12 ± 5,32 | 295 ± 3,19 | 293 ± 5,69 |
| Алулоза (g/L) | n.f. | 110 ± 2,10 | 110 ± 3.09 |
| Млечна киселина (g/L) | n.f. | n.f. | 3,2 ± 0,20 |
| Жизнеспособни клетки (cf.u./ml) | n.f. | n.f. | 10 8.47 |
| рН | 4.13 | 6.23 | 4.02 |
| GABA (mg/L) | 0 | 0 | 100 ± 0,98 |
| cAMP (mg/L) | 114 ± 2,67 | 116 ± 1,87 | 116 ± 1,58 |
| Общо феноли (mg/L) | 22,25 ± 0,21 | 21,01 ± 0,13 | 16,13 ± 0,32 |
| Общо флавоноиди (mg/L) | 146,67 ± 0,34 | 135,56 ± 0,15 | 120,12 ± 0,49 |
Най-често търговското производство на редки захари се извършва най-добре в кисели условия. РН на сок от хинап беше киселинно от 3,6–3,8. При това условие и GI, и DAE бяха инактивирани (Men et al., 2014; Zhu et al., 2012). След това регулирахме рН с 1 М NaOH в обхват от 4,0 до 8,0. Измерва се ензимното превръщане при тези условия. Резултатите на фигура 2а показват, че производството на D-алулоза се увеличава заедно с подобряване на стойността на рН (фигура 2а). Когато рН се коригира на 6,5–8,0, съдържанието на D-алулоза сред общия монозахарид (глюкоза, фруктоза и D-алулоза) в сок от хинап достига до 15,2%, което представлява теоретичната стойност (Men et al., 2014).
Ефектът от температурата върху производството на D-алулоза също е оптимизиран чрез контрол на реакционната температура от 50 до 60 ° C. Когато се контролира при 50 ° C, съдържанието на D-алулоза достига до 15% след реакция в продължение на 8 часа; тази стойност обаче намалява до 11,5% при 60 ° C (Фигура 2b). Това вероятно се дължи на намаляването на ензимната активност на DAE при висока температура (Zhu et al., 2012). Общоизвестно е, че за индустриалното производство на редки захари е необходима повишена работна температура, тъй като високите реакционни температури предизвикват по-висока реактивност, по-нисък вискозитет, по-висока стабилност, по-висок добив от процеса и по-малко замърсяване (Mozhaev, 1993). Независимо от това, работата при температури над 70 ° C ускорява неензимната реакция на потъмняване и образуването на странични продукти, а също така унищожава хранителната съставка на плодовия сок.
Добавянето на количество ензим в тази реакция беше допълнително оптимизирано. Открихме, че синтезът на D-алулоза достига реакционно равновесие (съдържание от 15,2%) на 8 часа, когато и двата ензимни количества DAE и GI се определят с 1,0 g/L. Удвояването на количеството ензим с 2,0 g/L намалява времето за реакция до 4 часа. Когато количеството ензим намалее до 0,5 g/L или по-малко, е необходимо повече време за реакция (Фигура 2в).
3.3 Ферментация на млечнокисели бактерии на сок от хинап, съдържащ D-алулоза
3.4 Анализ на хранителния компонент след ферментация
Прави впечатление, че минералите са важни за човешкото хранене (Ekmekcioglu, 2000). След това измерихме минералното вещество в сок от хинап преди и след ферментацията. Резултатите показват, че съдържанието на калий (K +) е 6 388,64 ± 62,31 mg/kg, което представлява преобладаващият минерал в сока от хинап. Съдържанието на магнезий (Mg 2+) е 442,86 mg/kg. Необходимо е за много ензими, особено за киназните семейства, които катализират зависимите от АТР реакции на фосфорилиране (Li et al., 2007). Калций (Ca 2+), който показва биологична активност при понижаване на кръвното налягане (Zemel, 1997), също е открит в сок от хинап. След ферментация в продължение на 24 часа, съдържанието на желязо (Fe 2+) и цинк (Zn 2+) се увеличава съответно с 34% и 20,7% в сравнение с първоначалното състояние. Металният йон Zn 2+, присъстващ във високи концентрации в очната тъкан, особено в ретината и хориоидеята, показва много биологични активности за очите, за които се смята, че взаимодействат с таурин и витамин А, модифицират фоторецепторните плазмени мембрани, регулират реакцията светлина-родопсин, модулират синаптично предаване и служат като антиоксидант. (Bruce, Grahn, Phyllis, Katherine, & Zhen, 2015). Увеличаването на съдържанието на Fe 2+ би подобрило тонизиращата функция на кръвта на сок от хинап (Marcel et al., 1999). Други минерали са почти непроменени (Таблица 2).
| Fe | mg/kg | 2,93 ± 0,11 | 3,93 ± 0,23 |
| Mg | mg/kg | 442,86 ± 7,17 | 448,90 ± 6,34 |
| Mn | mg/kg | 1,49 ± 0,11 | 1,77 ± 0,09 |
| Ca | mg/kg | 82.20 ± 0.57 | 86,74 ± 0,69 |
| Zn | mg/kg | 5,3 ± 0,31 | 6,4 ± 0,42 |
| К | mg/kg | 6 388,64 ± 62,31 | 6 414,68 ± 83,26 |
| P | mg/100 g | 60 ± 1,25 | 69,9 ± 0,97 |
След това изследвахме ефекта на ферментацията върху промяната на компонента на свободните аминокиселини (FAAs) в сок от хинап. След ферментация в продължение на 24 часа компонентът на FAAs очевидно се различава от първоначалното състояние. Обикновено съдържанието на Asp, Glu, Ser, Gly, Thr, Ala, Val, Ile и Leu се увеличава на различно ниво (Фигура 5). Аминокиселините с разклонена верига (BCAA), като Val, Ile и Leu, са необходими за човешкото здраве. Добавките с богати на BCAA диети показват положителни ефекти върху регулирането на телесното тегло, синтеза на мускулни протеини и хомеостазата на глюкозата и са важна и ефективна хранителна добавка за спорта. (Lynch & Adams, 2014). Специално, Asp има защитен ефект върху миокарда. Той намалява количеството азот и въглероден диоксид в кръвта и подобрява функцията на черния дроб и премахва умората (Thomas et al., 2003). Производството на FAAs вероятно е получено от разлагането на протеини или малки пептиди, които се синтезират от млечнокиселата бактериална ферментация на глюкоза и се усвояват по-лесно от тялото в напитките.
4. ЗАКЛЮЧЕНИЕ
ПРИЗНАВАНИЯ
Тази работа беше подкрепена от Националната ключова програма за изследвания и развитие на Китай (2017YFD0400705-3); Националната ключова програма за изследвания и развитие на провинция Дзянси (20171ACH80014). Асоциация за насърчаване на младежките иновации на Китайската академия на науките (2016163).
КОНФЛИКТ НА ИНТЕРЕСИ
Авторите декларират, че нямат конфликт на интереси.
ЕТИЧЕН ПРЕГЛЕД
Това проучване не включва изпитвания върху хора или животни.
- Защо захарта е МНОГО ЛОША за бебета и как да се избягва захарта в бебешката храна
- Използване на препятствия в домашната преработка на храни Светът на науката за храните
- Използване на храна за обръщане на сърдечни заболявания Сентара 28 дни на сърцето
- Използване на концепцията за хранителни диетични насоки за разработване на оптимизирана смесена диета (OMD) за
- Използване на сток кубчета в бебешка храна; Муми готвачи