P S MacLean
Катедра по медицина, Отдел по ендокринология, метаболизъм и диабет, Център за здраве и здраве Anschutz, Медицински факултет на Университета в Колорадо, Аврора, Колорадо САЩ
J A Хигинс
Катедра по медицина, Отдел по ендокринология, метаболизъм и диабет, Център за здраве и уелс Anschutz, Медицински факултет на Университета в Колорадо, Аврора, Колорадо, САЩ
E D Giles
Катедра по медицина, Отдел по ендокринология, метаболизъм и диабет, Център за здраве и уелс Anschutz, Медицински факултет на Университета в Колорадо, Аврора, Колорадо, САЩ
V D Шерк
Катедра по медицина, Отдел по ендокринология, метаболизъм и диабет, Център за здраве и уелс Anschutz, Медицински факултет на Университета в Колорадо, Аврора, Колорадо, САЩ
M R Джакман
Катедра по медицина, Отдел по ендокринология, метаболизъм и диабет, Център за здраве и уелс Anschutz, Медицински факултет на Университета в Колорадо, Аврора, Колорадо, САЩ
Резюме
Въведение
Над 60% от възрастните и близо 20% от децата в САЩ са с наднормено тегло или затлъстяване (1,2). Стратегиите за отслабване са преходно ефективни само за повечето хора, тъй като по-голямата част от хората, които се опитват да отслабнат, не са в състояние да постигнат и поддържат 10% намаление за една година (3). Над една трета от загубените килограми има тенденция да се върне през първата година, а по-голямата част се връща в рамките на 3 до 5 години (4,5). Предложени са редица причини за високите нива на рецидив (5,6), но има сериозни доказателства за биологичен стремеж към възстановяване на теглото след загуба на тегло (7,8). Целта на този преглед е да обобщи приноса на бялата мастна тъкан към този биологичен двигател и да обсъди как промените в нейната клетъчност и метаболитните характеристики могат да улеснят възстановяването на теглото.
Биологичното задвижване за възстановяване на теглото
Биологичният контрол на телесното тегло включва сложен цикъл на обратна връзка между мозъка и периферията. Мозъкът получава сигнали от периферията относно дългосрочни енергийни запаси (т.е. триглицериди на мастната тъкан) и краткосрочна наличност на хранителни вещества (т.е. непосредствена наличност на циркулиращи хранителни вещества) и въз основа на тези интегрирани сигнали, регулира енергийния баланс, за да отговори както на дългосрочните и краткосрочни цели на енергийната хомеостаза. Тази система за обратна връзка се адаптира, когато енергийният прием е когнитивно (при хората) или принудително (при животински модели) ограничен.
Фундаментално разбиране за тази енергийна пропаст, продиктувано единствено от биологичния натиск, се появи от предклиничните проучвания за възстановяване на теглото при модели, предизвикани от диета (DIO). Енергийната разлика при прехода между поддържане и рецидив се влияе по предсказуем начин от състава на диетата (12), от продължителността на времето за поддържане на теглото след загуба на тегло (10) и от нивата на физическа активност (13). Възстановяването на теглото, задвижвано единствено от това биологично налягане, отразява крива на растеж от първи ред (4,11,13), така че енергийната пропаст намалява с напредването на рецидива на затлъстяването. Като такъв, големината на енергийната пролука е най-голяма при най-ниското тегло след загуба на тегло (9,11,13). Освен това тази енергийна празнина не се разсейва с времето при поддържане на теглото. По-скоро проучванията показват, че големината на енергийната пропаст постепенно се увеличава, колкото по-дълго животното поддържа намаленото си тегло с енергийно ограничена диета (10). Последствията от тези наблюдения са, че биологичното налягане може да се засили с времето по време на поддържане на теглото и с количеството загубено тегло.
Бялата мастна тъкан е критичен възел в хомеостатичната система, която контролира телесното тегло и играе особено важна роля в биологичното шофиране за възстановяване на загубеното тегло. През последните няколко десетилетия мастната тъкан е призната за динамичен, многофункционален орган с редица различни видове клетки (14,15). В него се съхранява по-голямата част от съхранената енергия като триглицерид, който се смята за основен целенасочен параметър за регулиране в дългосрочната енергийна хомеостаза. Адипоцитът служи за основната си цел за дългосрочно съхранение на енергия и тъй като теглото се натрупва, губи и възвръща, адипоцитите и техните поддържащи клетки трябва да претърпят значително количество преустройство, за да приспособят печалбата или загубата на съхранената енергия (16). Като интегриран възел в системата за обратна връзка, мастните тъкани трябва да изпращат и получават важни сигнали към и от мозъка и други периферни тъкани, за да регулират по подходящ начин нивото на съхранена енергия.
Промени в клетъчността на адипоцитите
Размер на адипоцитите: силно модифициран
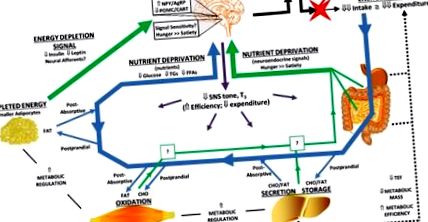
Клетъчността на адипоцитите се променя със загуба на тегло и възстановяване на теглото. Представителните адипоцити са показани в контекста на затлъстяването, след загуба на тегло и след възстановяване на теглото. Загубата на тегло би намалила средния размер на обитаващите адипоцити. Възстановяването на теглото може да включва както хипертрофия, така и хиперплазия. Промените в невроендокринните входове (SNS тон и T3), които могат да допринесат за адаптивния отговор на загуба на тегло, са показани за всеки метаболитен контекст. По същия начин, промените в секрецията на дългосрочния мастен сигнал, отразяващ съхранената енергия (лептин и инсулин), са показани за всеки метаболитен контекст. И накрая, системното въздействие върху наличността на хранителни вещества се представя като относителния поток на глюкоза, триглицериди (TG) и свободни мастни киселини (FFA). Както дългосрочните (лептин), така и краткосрочните (хранителни вещества и техните заместващи сигнали) биха били усетени от хипоталамуса и задния мозък за регулиране на апетита и метаболитните нужди.
Адипоцитен номер: модифициран еднопосочно
Загубата на тегло не води до забележима промяна в броя на адипоцитите в мастната тъкан (11,13,17–19) (Фиг. 2). Броят на адипоцитите при нормален, здрав индивид остава относително постоянен през цялата зряла възраст (20), но има условия, при които броят на адипоцитите в частност на мастните депа може да се увеличи. Нашите изследвания в парадигма на гризачи за загуба на тегло и възстановяване предполагат, че метаболитните условия по време на рецидив на затлъстяване могат да осигурят условия, които насърчават хиперплазията. В началото на процеса на рецидив наблюдаваме появата на много малка популация (2). SNS има установени ефекти върху метаболитното състояние и клетъчността на мастните тъкани (74,75) и спадът на тонуса на SNS в тази тъкан може да обясни промяната в метаболитното състояние, благоприятстващо поемането и отлагането на погълнатата енергия, както и хиперплазията. Други проучвания показват, че както преадипоцитите, така и адипоцитите реагират на тиреоид стимулиращ хормон (TSH) и тиреоидни хормони по подобен начин (76–80). Както SNS, така и хормоните на щитовидната жлеза имат инхибиторен ефект върху пролиферацията на преадипоцитите и стимулиращи ефекти върху диференциацията на преадипоцитите. Като такъв, спадът на тонуса на SNS и активността на оста на щитовидната жлеза по време на поддържане на теглото може да осигури разрешителни условия за пролиферация на преадипоцити, докато обръщането на тези невроендокринни входове по време на възстановяване на теглото може да бъде в основата на хиперплазията. Докато тези невроендокринни входове предоставят правдоподобно обяснение както за метаболитните, така и за адаптациите на клетъчната тъкан със загуба на тегло и възстановяване, техният действителен принос за адаптивния отговор в мастните тъкани изисква допълнително проучване.
Мастни сигнали за дългосрочни енергийни запаси
Това, което усложнява ролята на лептина и инсулина като „мастни сигнали“, е, че връзката им с мазнините се поддържа само по време на енергийния баланс и корелациите се отнасят само за нивата на хормоните на гладно. Когато възникне енергиен дисбаланс, лептинът и инсулинът отразяват метаболитното състояние (анаболно или катаболно) на мастната тъкан, тъй като отлага или мобилизира енергия. Прекомерното хранене увеличава нивата на циркулиране на лептин и инсулин (93) и, при постоянно прехранване по време на възстановяване на теглото, както лептинът, така и инсулинът се разтварят много преди теглото да бъде възстановено напълно (7). Поради тази причина лептинът и инсулинът сами по себе си изглежда не поддържат сигнала за енергийно изчерпване, тъй като теглото се възстановява.
Наличността на хранителни вещества като отражение на способността да се съхранява излишната енергия
Хипотезата за „изчистване на хранителните вещества“ за динамичната фаза на възстановяване на теглото
Тази хипотеза предполага, че енергийната разлика между апетита и изразходваната енергия остава по време на възстановяването на теглото като функция от способността на мастната тъкан да изчиства и съхранява излишната енергия (7) (фиг. 2). В началото на рецидива способността на мастната тъкан да изчиства излишната енергия се сравнява със скоростта, с която хранителните вещества се поглъщат и усвояват. С възстановяването на теглото адипоцитите постепенно увеличават размера си и способността им да изчистват излишната енергия намалява. Екскурзиите на глюкоза и TG стават все по-големи и потискането на FFA при динамични (постпрандиални) състояния на метаболизъм постепенно ще отслабва. След като адипоцитите са близо до критичния праг на размера и максималният капацитет за съхранена енергия, скоростта на възстановяване на теглото ще намалее. Тъй като теглото преди отслабване отново се постига или надминава, ако е настъпила адипоцитна хиперплазия, нивата на гладно и след хранене в циркулиращите хранителни вещества отново ще отразяват високите нива, наблюдавани при инсулинорезистентното състояние.
Тази опростена хипотеза интегрира дългосрочните мастни сигнали, отразяващи нивото на „съхранена енергия“, с краткосрочни сигнали за наличност на хранителни вещества, които по същество отразяват „способността да се съхранява енергия“. И двата сигнала се коренят основно в клетъчните и метаболитните профили на мастните тъкани. Концептуално дългосрочните сигнали, подавани от лептин и инсулин, биха установили глобалния „анаболен“ тон в хипоталамуса, задния мозък и периферните тъкани. В този анаболен контекст циркулиращите хранителни вещества и техните заместващи невроендокринни сигнали ще станат по-важни при условия след хранене и по време на продължителни пристъпи на прехранване, докато теглото се възстановява. Тогава сближаването на тези дългосрочни и краткосрочни сигнали в енергийните хомеостатични вериги на мозъка ще диктува величината и постоянството на енергийната междина.
Заключения
Мастните тъкани представляват ключов възел в хомеостатичната система, който регулира телесното тегло. Загубата на тегло от ограничаване на калориите води до съществени промени, които подготвят мастните тъкани да поемат и съхраняват поетата енергия. В комбинация с другите адаптации в тази хомеостатична система, тези промени в мастните тъкани представляват значително предизвикателство за успешно поддържане на загуба на тегло. Загубата на тегло събужда защитната система на тялото по начин, който е постоянен, наситен с излишъци и добре фокусиран върху целта да възстанови изчерпаните енергийни резерви на тялото. Успешната, дългосрочна загуба на тегло изисква признаване на силата и устойчивостта на този биологичен натиск и по-добро разбиране на това как могат да бъдат противодействани с екологични, поведенчески и фармацевтични интервенции. Мастните тъкани и по-точно адипоцитите могат да осигурят важна цел за разработване на интервенции, като се има предвид тяхната критична роля в адаптивния отговор. За да бъдат ефективни, интервенциите, насочени към предотвратяване на възстановяването на теглото, вероятно ще трябва да бъдат толкова изчерпателни, постоянни и излишни, колкото биологичните адаптации, на които се опитват да противодействат.
Изявление за конфликт на интереси
Авторите не декларират конфликт на интереси.
- Ролята на аминокиселините за изгаряне на мазнини при отслабване
- Ролята на диетата и отслабването при подобряване на вторичния хипогонадизъм при мъже със затлъстяване с или
- Ролята на кръвната химия в процеса на отслабване ARCpoint Labs
- Ролята на аеробните упражнения и диетата в мускулите за отслабване
- Ролята на фазите на Луната при отслабване • Джингаров