Абдала Ф. Зедан
1 Катедра за лазерни приложения в метрологията, фотохимията и селското стопанство, Национален институт за разширени лазерни науки, Университет в Кайро, Гиза 12613, Египет
Амина С. Ал Джебер
2 Катедра по химия и науки за Земята, Факултет по изкуства и науки, Катарски университет, Доха 2713, Катар; [email protected]
Резюме
1. Въведение
2. Материали и методи
2.1. Материали
Използваните в тази работа химикали са закупени от местен доставчик (ITS, Доха, Катар) и са използвани такива, каквито са, без никакви стъпки за третиране. Тези химикали бяха, както следва: безводна лимонена киселина (99,5% GPR, BDH, Лондон, Англия), меден- (II) нитрат-трихидрат (98%, Purum, Sigma-Aldrich, Сейнт Луис, МО, САЩ) и церий- (III) нитратен хексахидрат (основа на следи от метал 99%, Sigma-Aldrich). За приготвянето на всички разтвори е използвана ултрачиста дейонизирана вода (тип 1, Direct-Q 5UV, Millipore, Molsheim, Франция).
2.2. Методи
2.2.1. Синтез на изгаряне на разтвора на CeO2 и катализаторите CuO-CeO2
2.2.2. Характеризиране
2.2.3. Измервания на катализа на окислението на метан
За сравнение, катализаторът с най-добри характеристики е приготвен от различен пластир и е тествана неговата каталитична активност, където той показва подобна каталитична активност. В допълнение, повторяемостта на експерименталните измервания на катализа е потвърдена чрез провеждане на две отделни опити за всеки катализатор и ефективността на катализатора в двата следващи теста е подобна.
3. Резултати
3.1. Морфологична и кристална структура на катализаторите
Чистите и смесени оксиди на рядкоземни и преходни метали могат да бъдат синтезирани чрез няколко физически и влажно-химични метода, като сонохимичен [33], механично смесване [25], химическо утаяване [42], сушене чрез замразяване [34], конвенционална хидротермална синтез [35], синтез с микровълнова помощ [38], приготвяне на зол-гел [43] и синтез на изгаряне на разтвор [36]. Синтезът за изгаряне на разтвор (SCS) получи голям интерес поради способността му да дава материали с висока повърхност, с лекота на мащабиране, минимални стъпки на подготовка и почти не е необходима обработка след синтез, което значително намалява времето, необходимо за подготовка и обработка, позволяваща лесно и бързо получаване на твърди продукти [44,45,46]. SCS е самоподдържащ се високотемпературен термичен процес, включващ зол-гел среда, която претърпява саморазмножаваща се екзотермична реакция между химическото гориво и металния окислител, при което се получават големи количества газообразни продукти и ултрафини твърди материали [46]. В тази работа синтезирахме нанокристални CuO-CeO2 твърди смесени оксидни прахове чрез SCS, използвайки соли на церий и меден нитрат като окислители и лимонена киселина като комплекс и горивен агент, със съотношение гориво към окислител (и): 1 за осигуряване на богати на гориво условия.
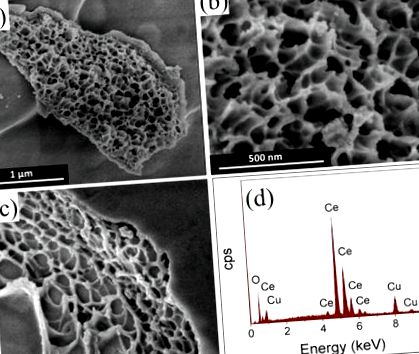
Фигура 1 представя SEM микрографски изображения на CeO2 и 6% CuO-CeO2 (Фигура 1 a-c) и EDX анализ (Фигура 1 d) на 6% CuO-CeO2 материали, синтезирани по метода на изгаряне на разтвора. SEM изображенията на чист CeO2, показани на фигура 1а, б, разкриват гъбеста морфология с макропореста структура, подобна на коралов риф. Смесеният оксид CuO-CeO2 с 6 тегл.% Мед показва гъбести подобни характеристики с големи кухини и малки сферични агломерати на CuO, както може да се види от SEM изображението, показано на фигура 1 c. Повърхностните кухини се образуват поради отделянето на прекомерни обеми газове при реакцията на горене, въвеждане на порьозност на подготвените CuO-CeO2 материали и водещо до намаляване на размера на структурните характеристики. Легирането с мед е видно от EDX спектъра на 6% CuO-CeO2, показан на Фигура 1 d.
SEM микрографски изображения на (а,б) CeO2; (° С) 6% CuO-CeO2, приготвен по метода на изгаряне на разтвора, и (д) EDX спектърът от 6% CuO-CeO2, показващ Cu и Ce елементите.
XRD моделите на чистия CeO2 и избрания CuO-CeO2 смесен оксид с 6 тегл.% Мед, заедно с референтните модели на CeO2 и тенорит CuO, са показани за целите на сравнението на Фигура 2. За чистия CeO2, получен чрез синтез на изгаряне, бяха наблюдавани четири основни XRD пика при ъгли на дифракция 2θ = 28.3 °, 32.8 °, 47.3 ° и 56.2 ° и 58.9 °, съответстващи на решетъчните равнини на (111), (200), ( 220) (311) и (222). Това е характерно за стандартната флуоритна кубична решетка на церия (карта JCPDS № 00-034-0394). Легирането на CeO2 с CuO доведе до появата на два XRD пика при ъгли на дифракция от 35.3 ° и 38.5 ° в случай на 6% CuO-CeO2, характерни за фазата на тенорита, също в съответствие с референтния XRD модел на CuO ( Карточка JCPDS No 00-005-0661). Тези две нови XRD характеристики показват образуването на смесен оксиден твърд разтвор. 100% основният дифракционен пик при ъгъл на дифракция от 28,3 ° ясно се разширява, когато 6 тегл.% Мед е включен в решетката на CeO2 и пълната ширина при половин максимум (FWHM) се увеличава
0,55 ° в случай на CeO2 до
1,1 ° в случай на 6% CuO-CeO2, което показва намаляване на характеристиките на размера, когато медта е била въведена в решетката на церия. Средните размери на кристалитите на CeO2 и 6% CuO-CeO2 материали са изчислени с помощта на формулата на Scherrer и е установено, че включването на 6 тегл.% Cu води до намаляване на средния размер на кристалита от
19 nm в случай на чист CeO2 до
9 nm в случай на CuO-CeO2. Това намаляване на характеристиките на размера, което е свързано с основното разширяване на пика на XRD, е резултат от усъвършенстването на размера на кристалите CuO-CeO2 смесен оксид, поради конкурентния растеж между CuO и CeO2 фазите на смесеното оксидно твърдо вещество.
XRD модели на праховете CeO2 и 6% CuO-CeO2, приготвени по метода на изгаряне на разтвора, в сравнение с референтните модели на CeO2 и тенорит CuO.
Тези XRD резултати се съгласяват с представените по-горе резултати от SEM (Фигура 1 a-c) по отношение на съществуването на CuO като отделна фаза и намаляването на средния размер на кристалита в резултат на вкарването на мед в решетката на CeO2, както е показано от по-големи кухини в порестата структура. Това намаляване на размера разкрива ролята на вмъкването на мед за благоприятното намаляване на растежа на Cu-Ce смесен оксиден кристал. Изчисленият щам на решетката на CeO2 и CuO-CeO2 допълнително доказва влиянието на включването на мед в решетката на церия. Стойността на щама на решетката (%) се е увеличила от 0,9% в случай на CeO2 на 1,8% в случай на 6% CuO-CeO2 в сравнение със стандартните структури. Това щам на решетката може да се отдаде на изкривяването и свиването на решетката, резултат от вмъкването на двувалентни Cu катиони (Cu 2+) с относително по-малки йонни радиуси (0.73 Å) в решетката на церия, като катионите Ce 4+ имат радиуси 0.97 Å [ 47].
3.2. Термични и електронни свойства (TGA и Raman)
Фигура 3 показва графики за термичен гравиметричен анализ (TGA) на CeO2 и CuO-CeO2, приготвени чрез синтез на горене, заедно с този на насипния CeO2 за сравнение. За разлика от общите частици CeO2 (Фигура 3 а), които показват незначителна загуба на тегло при нагряване до 700 ° C, частиците CeO2, приготвени чрез синтез чрез горене (Фигура 3 b), имат загуба на тегло от
2,3% при нагряване до 150 ° C и
6% загуба на тегло след нагряване до 700 ° C. Тази загуба на тегло в случай на синтезирани от изгарянето частици CeO2 може да се отдаде на свиването на пространството, причинено от дехидратацията на водните молекули, които могат да бъдат уловени във фини пори или адсорбирани на повърхността на синтезирания от изгарянето CeO2 частици. [48] По същия начин, CuO-CeO2 частиците със смесен оксид, с тегловно съотношение на Cu 4,5% и 6% (Фигура 3 c, d), показват проценти на загуба на тегло от
6% при нагряване до 300 ° C, съответно, което може да се отдаде на дехидратацията и десорбцията на хидроксилните (–ОН) групи на повърхността на частиците [49]. От друга страна, 15 тегл.% CuO-CeO2 (Фигура 3 д) показват относително по-висока термична толерантност, със само загуба на тегло само
2% при нагряване до температура от 300 ° C. Тази по-висока термична стабилност се дължи на наличието на по-висока фракция мед (15 тегл.%) В композита в сравнение с частиците CuO-CeO2 с 4,5-6 тегл.% CuO. Относително увеличеният толеранс на нагряване на 15 тегл.% CuO-CeO2 частици може да се дължи на намаляването на броя на хидратирани хидроксилни групи (–OH) в смесения оксид, тъй като повърхността на Cu се хидратира с по-малък брой –OH групи в сравнение с носещия оксиден материал [49]. Най-високата дехидратация и десорбция на хидроксилна група, наблюдавана за 6 тегл.% CuO-CeO2 при температури по-ниски от 300 ° C, показва относително по-високия капацитет на частиците към адсорбцията на –OH група, което показва съществуването на по-голяма достъпна повърхност върху порестата структуриран катализатор. Както ще бъде обсъдено по-късно, тази по-голяма повърхностна достъпност може да доведе до относително по-висока каталитична активност на този катализатор към изгаряне на метан. В същото време 6% CuO-CeO2 демонстрира значителна термична стабилност, както се посочва от загубата на само по-малко от 7% от общото тегло при нагряване до 700 ° C, което отразява способността му да издържа на високите температури условия на термохимични каталитични процеси.
TGA профили на (а) насипна церия (б) CeO2, (° С) 4,5% CuO-CeO2, (д) 6% CuO-CeO2 и (д) 15% CuO-CeO2, приготвен чрез метод на изгаряне на разтвор.
Раманова спектроскопия е мощна, чувствителна, неразрушителна и бърза аналитична техника, която може да предостави точна информация за структурните, симетрични и електронни свойства на наноструктурите [50]. Следователно, получени са Раманови спектри на нанокристални чисти церии и избрани медно-цериеви смесени оксидни твърди вещества, за да се изследва ефектът от включването на мед върху решетъчните вибрационни характеристики на церия. Фигура 4 показва Рамановите спектри на чист нанокристален CeO2 и 6 тегл.% CuO-CeO2 твърди прахове, приготвени от SCS. Рамановите спектри на чист нанокристален CeO2 показват подчертан пик, центриран при 467,5 cm -1, който е присвоен на режим на вибрация на решетката F2g, характерен за церион с кубична структура на флуорит. Режимът F2g на CeO2 е свързан със симетричния разтягащ се вибрационен режим на кислородните атоми около кислородните атоми във флуоритната цериева решетка [51]. Раманов спектър на нанокристалния 6% CuO-CeO2 твърд прах показва основна лента, центрирана на 459,3 cm -1, благодарение на режима на вибрация F2g на решетката на CeO2, в допълнение към малък пик на рамото при
Раманови спектри на CeO2 и 6% CuO-CeO2, получени чрез синтез на горене в спектралната област от 200–700 cm −1, показващи както F2g режим на CeO2, така и Ag режим на CuO в случай на 6% CuO-CeO2 катализатор.
3.3. Химичен анализ на повърхността (XPS)
XPS спектри с висока разделителна способност на (а) Ce 3d, (б) Cu 2p и (° С) O 1s от CeO2 и 6% CuO-CeO2 катализатори, синтезирани по метода на изгаряне на разтвора.
3.4. Каталитично проучване за окисляване на CH4
- Засиленото окисляване на мазнините чрез физическа активност е свързано с подобрения в инсулина
- Подобрено производство на лигавични антитела и защита срещу респираторни инфекции след
- Ензимен синтез на аналог на мазнини за кърмачета, обогатен с капринова киселина SpringerLink
- Глицерол изопропил етери директен синтез от алкохоли и синтез чрез редукция на солкетал
- Изгаряне на титаново-сажди високоенергийни смелени топчета в азотно образуване на