Айше Кълъч
1 Институт по лабораторна медицина и патобиохимия, молекулярна диагностика, Университет Филипс Марбург, Марбург, Германия.
Марк Сантолини
2 Център за сложни мрежови изследвания, Катедра по физика, Североизточен университет, Бостън, Масачузетс, САЩ.
3 Brigham and Women’s Hospital, Чанинг, отдел по мрежова медицина, Медицински отдел, Харвардско медицинско училище, Бостън, Масачузетс, САЩ.
4 Център за ракова системна биология (CCSB) и Катедра по биология на рака, Институт по рака Dana-Farber, Бостън, Масачузетс, САЩ.
Тайдзи Накано
1 Институт по лабораторна медицина и патобиохимия, молекулярна диагностика, Университет Филипс Марбург, Марбург, Германия.
Матиас Шилер
5 Клиника по дерматология и венерология, Университетски медицински център Росток, Росток, Германия.
Мизуе Тераниши
6 Институт за изследване на сърцето и белите дробове на Макс Планк, Бад Наухайм, Германия.
Паскал Гелерт
7 Изследователски център за рак на гърдата сега към Института за изследване на рака, Лондон, Великобритания.
Юлия Пономарева
8 Институт за сърдечно-съдова регенерация, Център за молекулярна медицина, Гьоте-университет Франкфурт, Франкфурт, Германия.
Томас Браун
6 Институт за изследване на сърцето и белите дробове на Макс Планк, Бад Наухайм, Германия.
Шизука Учида
9 Институт за сърдечно-съдови иновации, Университет в Луисвил, Луисвил, Кентъки, САЩ.
Скот Т. Вайс
3 Brigham and Women’s Hospital, Чанинг, отдел по мрежова медицина, Медицински отдел, Харвардско медицинско училище, Бостън, Масачузетс, САЩ.
Амитаб Шарма
3 Brigham and Women’s Hospital, Чанинг, отдел по мрежова медицина, Медицински отдел, Харвардско медицинско училище, Бостън, Масачузетс, САЩ.
Харалд Ренц
1 Институт по лабораторна медицина и патобиохимия, молекулярна диагностика, Университет Филипс Марбург, Марбург, Германия.
Свързани данни
Резюме
Въведение
Астмата е основно хронично възпалително заболяване на дихателните пътища с нарастващо разпространение и честота в световен мащаб (1). Последните клинични открития показват сложна и хетерогенна патофизиология сред пациенти с астма (2). В момента подгрупите на пациентите се определят въз основа на клетъчни и молекулярни подписи, които се наричат ендотипове (3, 4). Сред тях ендотипът тип 2 е силно разпространен, обхващащ около половината астматици, и също така е добре дефиниран от централната роля на имунитета на Т хелпер 2 (Th2). Th2 клетките се диференцират от наивните CD4 + Т клетки, които служат като общ предшественик за функционално разнообразните субпопулации на Th клетки (5-9). В наивни Т клетки IL-4 индуцира експресията на транскрипционния фактор GATA3, който насърчава експресията на IL-4, IL-5 и IL-13. В спомагателните клетки тези цитокини индуцират различни отговори надолу по веригата, водещи до ремоделиране на тъканите и тежко увреждане на белодробната функция (10, 11).
Th2 имунният отговор се усилва в саморазмножаващи се бримки, стабилизира се с течение на времето и избягва имунната регулация, например от Treg клетки (12). Домакинът остава неспособен да възстанови имунната хомеостаза. Молекулните механизми, залегнали в поддържането на алергичния отговор в възпалената тъкан, не са добре дефинирани. Следователно, дешифрирането на тези сигнали е ключово за разбирането на патогенните механизми при болестите. Наскоро е доказано, че посттранскрипционните механизми, включително микроРНК (miRs), контролират генната експресия и са признати, че допринасят значително за човешките заболявания.
miRs фино настройва генната експресия чрез улесняване на разграждането на mRNA и потискането на протеиновия синтез (16, 17), както и променена експресия на miRs е документирано за заболявания, задвижвани от Т-клетки, включително астма (18–22). Тъй като miRs са кодирани в гени и генната експресия е силно повлияна от въвеждането на цитокини в Th клетките, вероятно е нивата на експресия на miR да бъдат повлияни от различни стимули, налични в възпалената тъкан и променящи се микро-среди в различни стадии на заболяването. Дали моделът на експресия на miR в Th2 клетките е обект на по-нататъшни промени при хронично алергично възпаление и дали тези промени засягат поддържането на Th2 подгрупата във възпалената тъкан не са изследвани досега.
Широкият целеви спектър на единичен miR затруднява прогнозирането на последиците от miR регулирането върху клетъчните процеси, освен ако не се вземат предвид miR-регулираната експресия на ген и протеин. Подходите за системна биология успешно картографират такива данни за интерактоми и miRNome за идентифициране на регулаторни пътища при болести (23–30).
Тук разработихме мрежова рамка, Impact of Differential Expression Across Layers (IDEAL), която дава приоритет на miRs въз основа на техните модели на взаимодействие в местната околност на диференцирано експресирани (DE) гени (модул за болестта). За да измерим кумулативното влияние на miRs в miR-mRNA и mRNA-mRNA многослойната мрежа, ние въведохме колективно въздействие (CI) като мярка. Този подход идентифицира подгрупа от 5 miRs, свързани с астма, които имат максимално топологично въздействие. Интересното е, че тези miRs показват само умерена промяна на сгъването (FC) и няма да бъдат заснети от традиционните мрежови агностични методи. И накрая, потвърждаваме тези открития in vitro, като антагонизираме тяхната активност в Th2 клетки и откриваме по-ниско производство на Th2-специфични ефекторни цитокини IL-5, IL-9 и IL-13.
Резултати
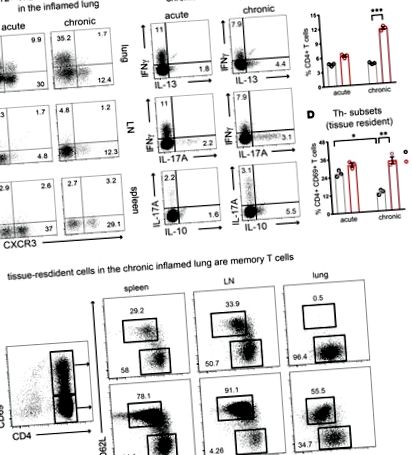
CD4 + Th2 клетъчната популация се стабилизира в хронични възпалени дихателни пътища.
Топлинна карта, изобразяваща диференциално изразени miRs в (A) началото на Th2 и (Б.) стабилни Th2 клетки в сравнение с наивни Т клетки. (° С) Диаграма на Venn, обобщаваща регулираните miRs в ранните и стабилни Th2 клетки.
Въздействие на miRs върху модулите на Th2 болестта.
Като се има предвид, че всеки miR обикновено регулира множество иРНК цели, от решаващо значение е да се интегрира структурата на свързаност на мрежи miR и тРНК, за да се разбере динамиката на Th2 сигнатурата на молекулярно ниво. Последният напредък в картирането на miRNome и интерактома демонстрира зрелостта и стойността на такива системни биологични подходи при откриване на регулаторни пътища при болести (23–30). Преместването на крачка напред, интегрирането на miRNome и интерактома заедно с експресията на транскриптома ни позволи да дадем приоритет на miRs със значително колективно въздействие (Фигура 4А). Използвахме човешките протеин-протеинови взаимодействия (PPI) и miR-mRNA мрежите, с установеното наблюдение, че човешките PPI мрежи са добре запазени при мишки (36, 37) (вж. Методи).
Гените на заболяванията са склонни да се агрегират в локализирани квартали на интерактома, определени като модули на заболяването (29). Тук изследвахме дали DE гените по отношение на наивните Th клетки следват същия модел на клъстериране. DE гените над различни FC гранични стойности бяха картографирани към човешкия интерактом и агрегацията на съответните протеини беше измерена от размера на най-големия свързан компонент (LCC) - броя на възлите в най-големия свързан подграф. Сравнението със случайни набори от гени със същия размер ни позволи да извлечем значимост Z оценка (вж. Методи). Забелязахме, че гените DE образуват силно взаимосвързани клъстери за междинни FC (FC = 1,3, Z = 5,3 за стабилен Th2, Фигура 4B; и FC = 1,8, Z = 4,3 за ранен Th2, Фигура 4C). Тези FC са избрани за определяне на ранните и стабилни модули на Th2 болестта. Тази методология разчита само на моделите на свързаност между гените на DE, като по този начин се избягва традиционната ловушка на необходимостта да се избере предварително определен FC cutoff.
След това попитахме дали DE miRs въздействат върху топологично централните цели в получените модули на заболяването. Във всяко състояние въздействието на DE miRs беше оценено чрез премахване на предвидените им цели в съответния модул на заболяването, подход, напомнящ на атаката върху мрежи без мащаб (38). Както в ранните, така и в стабилните случаи установихме, че сплотеността на модулите е загубена след отстраняване на целта, като размерите на LCC падат до незначителни нива (Фигура 4D, червен боб). От друга страна, модулите все още бяха сплотени при случайна атака на същия брой цели (Фигура 4D, сив боб).
Приоритизиране на miRs чрез тяхното въздействие върху модулите на болестта.
За да дадем приоритет на важни диференциално изразени (DE) miRs, разработихме метод за измерване на тяхното колективно топологично въздействие върху модула на болестта, The Impact of Differential Expression Across Layers (IDEAL). (A) IDEAL започва с болестен модул, образуван от болестните гени (кръгове) в интерактома, с набор от DE miRs (диаманти), насочени към него. Най-големият свързан компонент (LCC) е показан в оранжево. (Б.) Взаимодействията между miRs и mRNAs с противоположна гъвкава промяна (FC) се запазват. (° С) Централният miR има максимално въздействие, измерено чрез намаляване на размера на LCC при премахване на целта си, и следователно е първият IDEAL miR. След това процедурата повтаря, за да намери новия miR с най-голямо въздействие, премахва целите си и продължава, докато всички miRs бъдат класирани.
(A) Кумулативното въздействие след отстраняване на n miRs се измерва чрез колективно въздействие (CI), мярка, която систематично сравнява относителния размер на най-големия свързан компонент (LCC) след атака от n miRs с очаквания на случаен принцип. Наблюдаван е пик на CI при приблизително 5 miRs, показващ максимално въздействие за стабилен Th2 и приблизително 10 miRs за ранен Th2 (Б.). (° С) Диаграма на Venn, сравняваща най-високо класираните miRs с методите за промяна на сгъването (FC) и въздействието на диференциалното изразяване върху слоеве (IDEAL). (д) Показан е стабилният модул на болестта Th2 (гени, кръгове; miRs, V’s). Топ 5 miRs са подчертани в червено, а целите им в тъмно червено. Размерът на възела е пропорционален на степента. Подмрежата подчертава най-добрите пътища, обогатени сред целевите гени и първите съседи на конкретен miR в интерактома. Сините кръгове маркират mTOR, жълто EGFR1, лилаво TGF/SMAD, червено IL-5 и зелено пътеката TRIF. Общите възли сред пътеките са оградени в черно.
MiRs от IDEAL и от FC са сравнени на фигура 6С. Класирането на FC дава значителен списък от подобни кандидати между ранни и стабилни условия. От друга страна, класирането IDEAL дава ортогонални набори, които са силно специфични за всяко условие, като само miR-203 се споделя между ранни и стабилни условия. И накрая, miR-27b, най-високо класираният кандидат от класацията IDEAL в стабилен Th2, също се прогнозира да има висок FC както в ранни, така и в стабилни условия, което го прави силен кандидат.
Като цяло установихме, че малък набор от miRs (5 от 142;
4% от всички DE miRs) са имали максимален CI на модула за стабилна Th2 болест. Този комплект включва комбинация от регулирани (miR-27b и -23b) и заглушени (miR-206, miR-106b и miR-203) miRs. За да се изследва възможната биологична роля на тези miRs, непосредствените миР цели и техните първи съседи в интерактома бяха подложени на анализ на пътя (вижте раздела за методи, таблица 1 и фигура 6D). Най-горният път, насочен от miR-27b, беше ядрен SMAD2/3, а сигналната пътека EGFR1 се регулира от miR-23. И двата пътя са свързани с имуносупресия от и активност на регулаторните Т клетки (39, 40). Активното заглушаване на тези пътища в стабилни Th2 клетки може да помогне да се избегне присъщата имунна регулация. За разлика от тях, miRs, заглушени в Th2 клетки, активно насочват компоненти на сигналните пътища, които са свързани с поляризация (41), активиране и пролиферация (42), както и действат надолу по веригата на цитокини (43, 44), които са илюстрирани за IL 5. Взети заедно, тези резултати показват, че потискането на активността на тези специфични miRs в комбинация с активно заглушаване на имуносупресивните пътища може да осигури поддържане на Th2 клетките.
маса 1
Насочването на IDEAL miRs облекчава производството на цитокини в Th2 клетките.
Този предсказан набор от miRs беше допълнително валидиран в няколко функционални анализа. За всеки miR е избран целеви ген със силна свързаност в модула на заболяването и запазване на последователността от семена от човек към мишка за допълнителен анализ (допълнителна фигура 3, методи). Това доведе до избора на CTCF за miR-27b, NCOA3 за miR-206, ELK3 за miR-106b, AHR за miR-203 и ELF2 за miR-23b. Анализът с двоен репортер на луцифераза разкрива регулиране на избраните целеви гени от съответните miRs, както е показано чрез маркираното и значително намаляване на сигнала на луцифераза, открит за всички последователности на дивия тип (WT) 3′-UTR. Специфичността на последователността беше потвърдена чрез изтриване на miR семенните последователности (мутант), което доведе до непроменен луциферазен сигнал (Фигура 7А). Тези резултати потвърждават регулирането на гените, централни за множество пътища, сливащи се във възпаление, чрез IDEAL miRs.
Дискусия
Този системен имунологичен подход - IDEAL - идентифицира ключови генно-регулаторни промени, предизвикани от miRs в целия набор от молекулни взаимодействия в клетка (интерактом). IDEAL допълнително претегля нетните последици от miR активността върху интерактома чрез прилагане на мрежово базиран алгоритъм за приоритизиране. Оценявайки кумулативния резултат от смущения, за да определи броя и идентичността на miRs, които заедно преминават прага на спокойствие и водят до възпаление, IDEAL прогнозира максимално колективно въздействие от 5 miRs в стабилни Th2 клетки, включващи нагоре и надолу регулирани miRs. Антагонизирането на нивото на експресия на тези miRs in vitro значително намалява производството на цитокини в Th2 клетките. Като цяло вярваме, че това е първото проучване, описващо промените в експресията на miR като механизъм за стимулиране на персистирането на алергичния имунен отговор.
В заключение ние систематизирахме Th2 клетки и разработихме инструмент за системна биология (IDEAL), за да оценим ролята на miRs в контрола на устойчивостта на астматичния Th2 отговор. Излязохме отвъд обичайния израз, базиран на FC анализ и изследвахме разпространението на влиянието на miRs в мрежата за молекулярно взаимодействие (интерактом). Ние предоставяме доказателства и доказателства за полезността на холистичния системен имунологичен подход за дешифриране на деликатни взаимодействия, сближаващи се до патологични черти, и предоставяме доказателство за сложна и комбинаторна активност на уникален набор от miRs в Th2 клетките. Идентифицирането на това колективно въздействие на miR може да отвори нови възможности за терапевтични интервенции, насочени към комбинация от miRs за лечение на Th2-задвижвана болест.
Методи
За експериментите бяха използвани женски мишки BALB/c (Charles River) на възраст 6-8 седмици. Мишките бяха настанени при стандартни условия със свободен достъп до чау и гризачи за гризачи.
- Системен подход към здравословното хранене
- Системният подход разкрива MAVS сигнализацията в миелоидни клетки като критична за устойчивостта към ебола
- Лекарствени дозиращи системи за гризачи Bio-Serv (Rodent MD s ™); алтернатива за дозиране с нисък стрес за
- Резюме P268 Въздействие на наднорменото тегло и затлъстяването при разпространението и лечението на хипертонията
- 3 основни енергийни системи предоставят тайни; Позволете на обучителите да усъвършенстват упражнения, ориентирани към целите!