Резюме
Заден план
За да се оцени имунитетът срещу грип, проучванията за предизвикване на мишки обикновено се извършват чрез интраназално вливане на вирусна суспензия на упоени животни. Това води до неестествена среда в долните дихателни пътища по време на инфекция и следователно има известна загриженост, че имунните механизми, идентифицирани в този модел, може да не отразяват тези, които предпазват от инфекциозни вирусни частици, доставени директно в долните дихателни пътища като аерозол.
Метод
За да се оценят разликите в защитата срещу вкаран и инхалиран вирус, мишките бяха имунизирани с грипни антигени, за които е известно, че индуцират антитяло или клетъчно-медиирани отговори и след това предизвикани със 100 LD50 A/PR/8/34 (PR8) под формата на аерозол (вдишване) или течна суспензия (вкарана).
Резултати
Мишките, имунизирани с рекомбинантен аденовирус (Ad), експресиращ хемаглутинин, бяха защитени срещу загуба на тегло и смърт и в двата предизвикателни модела, но имунизацията с Ad експресиращ нуклеопротеин на грип A (NPA) или M2 доведе до по-голяма защита срещу инхалиран аерозолизиран вирус, отколкото вирус, вкаран в течна суспензия . Ad-M2, но не и Ad-NPA-имунизирани мишки бяха защитени срещу по-ниска доза за предизвикване на вливане.
Заключения
Тези резултати демонстрират различия в защитата, които зависят от метода на предизвикване, и предполагат, че медиираният от клетките имунитет може да бъде по-точно демонстриран в проучвания за вдишване на мишки. Освен това данните показват, че имунните механизми, обикновено характеризирани като непълни или слаби при модели на мишки, използващи течно интраназално предизвикателство, могат да предложат по-голям имунитет срещу грипна инфекция, отколкото се смяташе досега.
Заден план
Годишните грипни епидемии водят до приблизително 40 000 смъртни случая в САЩ и поне един милион смъртни случая по целия свят [1, 2]. Ваксинацията осигурява защита срещу заболяване, когато антигените в инактивираните разделени ваксини са антигенно съпоставени с циркулиращите грипни вируси, отразявайки активността на антителата, които неутрализират заразността на вируса и ограничават разпространението на вируса. Инхибиращите хемаглутинин (НА) и невраминидазата (NA) антитела са независими корелати на имунитета [3]. Клетъчно-медиираният имунитет допринася за вирусното изчистване, като броят на IFN-γ секретиращите Т-клетки корелира с ефикасността на жива, атенюирана грипна ваксина при деца [4].
Ранните проучвания на мишки показват, че са необходими по-малко инфекциозни единици за заразяване на мишки чрез вдишване, отколкото вливане [21] и че за директно отлагане в долните дихателни пътища аерозолизираните капчици трябва да бъдат
Резултати и дискусия
Имунизация с жив вирус и рекомбинантен аденовирус (Ad), експресиращи грипни протеини
Мишките BALB/c бяха изложени интраназално на сублетална доза PR8 (H1N1) или хетерологичен реасорант H3N2 вирус X-31 или ваксинирани интрамускулно с рекомбинантен аденовирус (Ad), експресиращ HA, M2 и NP на грипни вируси A (Ad-NPA ) или NP на грипни вируси B (Ad-NPB). Последната група ваксини, както и наивните мишки, служеха като отрицателни контроли, тъй като тези мишки не трябва да бъдат защитени срещу предизвикване с PR8. Три седмици след ваксинацията на мишките е направена кръв и е измерен титърът на антителата за инхибиране на хемаглутинацията (HAI). Мишките, имунизирани с Ad-HA, но не Ad-M2 или Ad-NP, имат HAI титри приблизително 1: 100, което показва, че тази стратегия за ваксиниране е ефективна при предизвикване на отговор на антитела. Капацитетът на Ad-M2 и Ad-NP да индуцират M2-специфични антитела и NP-специфични CD8 + Т клетки е установен от други, използвайки същите тези рекомбинантни аденовирусни препарати [5, 6, 28]. HAI антитела, реактивни с PR8, също присъстват в серумите на мишки, изложени на сублетална доза PR8 (титри на HAI от приблизително 1: 600), но не след експозиция на X-31 (H3N2). Както съобщават други, специфичните за NP8 CD8 + Т клетки се активират след инфекция с жив грипен А вирус и се набират в значителен брой в белите дробове след предизвикателство с вирус, който е от различен подтип [29].
Репликацията на вируса в белите дробове на ваксинирани мишки е подобна 4 дни след вдишване и насаждане на PR8 предизвикателство
Пет седмици след излагане на вируса или ваксинация, равен брой мишки (n = 10) във всяка ваксинална група бяха изложени на PR8 като инхалиран аерозол или като инстилирана течна суспензия. Аерозолното предизвикателство се провежда, както е описано в Методи и материали, като се използва система за експозиция само с нос, без да седират мишките. За разлика от това, инстилацията се провежда чрез поставяне на капки от вирусна суспензия върху нарите на анестезирани мишки. Използвана е същата летална доза (100 LD50); тъй като мишките BALB/c умират при вдишване на 10 пъти по-ниско количество PR8 в сравнение с интраназалната инстилация [26], количеството на вируса, използвано при инхалационното предизвикателство, е приблизително 10 пъти по-малко, отколкото при предизвиканото вдишване.
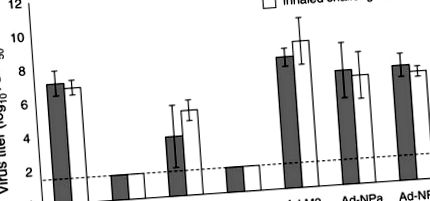
Пет мишки от всяка група бяха умъртвени 4 дни след предизвикване и белите дробове бяха отстранени за титруване на вируса; клиничните признаци на заболяване и смъртност са наблюдавани при останалите животни. Тези резултати показват сходни количества вирус в белите дробове на предизвикани мишки, независимо от метода на предизвикване (Фигура 1). По това време вирусът не е открит в белите дробове на мишки, изложени преди това на PR8 или ваксинирани с rAd-HA. Налице е значително намаляване на титрите на белодробния вирус за мишки, изложени преди това на хетероложния X-31 вирус, предоставяйки доказателства, че хетеросубтипичният имунитет, индуциран от предишна жива вирусна инфекция, осигурява подобна защита срещу инхалиран и вкаран вирус. Имунизацията с Ad-M2 и Ad-NPA обаче не намалява титрите на вируса на ден 4 след вдишване или вливане.
Сравнение на титрите на вируса в белите дробове на ваксинирани мишки след предизвикване на вливане и вдишване PR8. Показани са средногеометрични титри на вируса (TCID50/ml) за мишки, подложени на инстилация (сиви ленти) и вдишване (бели ленти). Титрите на вируса бяха определени за белите дробове (5 мишки на група), събрани на ден 4 след предизвикване, и хомогенизирани в 1 ml среда без серум. Лентите за грешки показват стандартно отклонение, а пунктираната линия е границата на количественото определяне за този анализ.
Пълен имунитет срещу инхалиран и инстилиран грип при мишки, изложени преди това на жив хомоложен или хетерологичен вирус или ваксинирани с Ad-HA
Мишките, които преди това са били изложени на инфекциозен PR8 или които са били имунизирани с rAd-HA, не са имали вирус в белите си дробове 4 дни след инхалация или инстилация на 100 LD50 от хомоложния вирус (Фигура 1). Тези мишки не само бяха защитени от инфекция, но и бяха напълно защитени срещу загуба на тегло (Фигура 2) и смърт (Фигура 3). Тази защита корелира с наличието на HA-инхибиращи антитела, за които е известно, че неутрализират инфекциозността на вируса.
Мишките, имунизирани с rAd-M2 и rAd-NP, са защитени срещу загуба на тегло при вдишване на вируса, но не и при вливане на вирус. Средният процент от изходното тегло за всяка група е показан за мишки, които са били предизвикани от (A) вливане и (Б.) вдишване. Мишките от всяка група (n = 5) се претеглят индивидуално всеки ден след предизвикване. Всяка графика показва средната промяна в теглото на групата спрямо базовите тегла на тялото, като лентите за грешки показват стандартното отклонение за групата.
Въпреки че в белите дробове беше измерена известна репликация на вируса, мишките, изложени преди това на хетероложен жив X-31 вирус, бяха напълно защитени срещу загуба на тегло (Фигура 2) и смърт (Фигура 3) след вдишване и насаждане на вируса. Тези мишки не са имали антитела, които инхибират активността на HA или NA на провокиращия вирус, PR8 (не е показано). Както се съобщава в многобройни изследвания на хетероложна защита, тази защита обикновено се медиира от специфични за грипа CD4 + и CD8 + Т клетки, които убиват заразени клетки [5, 29], въпреки че антителата към консервирани антигенни епитопи, като M2e, също могат да допринесат за хетеросубтипичен имунитет [9, 30, 31].
Имунитет срещу инхалиран, но не насаден грип при мишки, ваксинирани с рекомбинантен Ad-M2 или Ad-NPA
Ad-M2, Ad-NPA и Ad-NPB имунизирани мишки отслабват със същата скорост като наивните мишки след предизвикване с течна суспензия от PR8 (Фигура 2). Всички тези групи мишки умряха на 8-ия ден след предизвикателството (Фигура 3). Интересното е, че това беше един ден по-късно, когато предизвиканите наивни мишки умряха, което предполага известна полза от имунизациите Ad-M2, Ad-NPA и Ad-NPB. За разлика от това, загубата на тегло след аерозолно предизвикване на Ad-M2 и Ad-NPA имунизирани мишки се забавя 3 дни след аерозолно предизвикване, въпреки че теглото им остава значително по-малко от Ad-HA групата (p Фигура 4
(A) Титри на вируси, (B) загуба на тегло и (C) смъртност от 10LD 50 насажда PR8. Групи мишки (n = 10) бяха имунизирани както преди и предизвикани чрез вливане на PR8. Четири дни след предизвикване, 5 мишки от всяка група бяха евтаназирани, за да се позволи титруване на вируса в белите дробове, теглото и оцеляването на останалите мишки бяха наблюдавани до ден 12 (A) показва средно геометрични титри на вируса, заедно със стандартното отклонение; пунктираната линия е границата на количественото определяне за този анализ. (Б.) показва процентното намаление на теглото спрямо базовото тегло на тялото, като лентите за грешки показват стандартно отклонение. Ключ за групите е показан вдясно от тази графика. (° С) показва процент на оцеляване на мишките от всяка група. Ключ за тези групи е показан вдясно от графиката. Оцеляването на мишки, ваксинирани с Ad-HA и Ad-M2, е значително по-голямо (тест на Mantel-Cox, p = 0,0016) от мишките, имунизирани с Ad-NPA или Ad-NPB. Последните 2 групи не се различават една от друга или наивни мишки.
Предизвикателството чрез вдишване на много малки съдържащи вирус аерозолни частици има по-ниска доза LD50 [26] и следователно просто обяснение за разликата в защитата е, че по-малък брой вириони навлизат в долните дихателни пътища на мишки, вдишвайки вирус, отколкото при мишки, изложени на насаден вирус. Тествахме тази идея чрез инокулиране на мишки с 10 пъти по-малко вкаран вирус. Нашите резултати показаха, че това не е така - мишките, имунизирани с Ad-NPA, не бяха защитени срещу предизвикване с еквивалентен брой вдишани и накапани вирусни частици.
Докато разликата в градиента на хемокините осигурява потенциална причина за клетъчно-медиирана защита срещу инхалиран, но не вкаран вирус, има и други обяснения, които трябва да се разгледат. Например, разликите в активираните или вродени клетъчни типове механизми могат да доведат до по-ефективно изчистване на инхалирания от насадения вирус от специфични за грипа CD8 + Т клетки. Следователно бъдещите експерименти трябва да изследват хистопатологията на белите дробове от заразени мишки, за да определят броя и видовете възпалителни клетки, наети в белите дробове, и да сравнят степента на инфекция, заразените видове клетки и клетъчните увреждания, тъй като вирусната или имунната патология също може да допринесе за разлики в защитата срещу вкаран и инхалиран вирус. Други фактори, които оправдават тестването, включват потенциалното въздействие на изофлуран върху заразената вирусна инфекциозност и функцията на реагиращите клетки [34] и възможни разлики в имунните отговори, индуцирани в горните дихателни пътища от вкаран и инхалиран вирус. Очевидно са необходими допълнителни експерименти, за да се идентифицират причините за разликата в индуцираната от Ad-NPA защита срещу вкаран и инхалиран вирус.
Нашите резултати показват, че мишките са били напълно защитени срещу смъртоносно предизвикателство PR8 чрез предварително излагане на хетеросубтипичния вирус, X31. Докато антителата допринасят за кръстосана защита [30], клетъчно-медиираният имунитет играе съществена роля в имунитета с голям брой NP-специфични CD8 + Т клетки, рекрутирани в белите дробове [35]. Нашите резултати, показващи неефективна защита на Ad-NP-имунизирани мишки срещу вкаран вирус в нашия модел, използвайки единична доза ваксина, предполагат, че специфичният за NP имунен отговор и възможната защита срещу вкаран вирус могат да бъдат подобрени чрез прилагане на допълнителни дози или в комбинация с адювант.
В обобщение, сравнихме защитата срещу инхалиран и инстилиран вирус при мишки, които преди това са били изложени на хомоложен и хетеросубтипичен вирус или преди това са били имунизирани с рекомбинантни аденовируси, експресиращи НА, М2 или NP. Нашите резултати показват подобна защита срещу вдишване и насаждане на предизвикателство за мишки, които преди това са били заразени или ваксинирани с Ad-HA, но не и за мишки, имунизирани с Ad-M2 или Ad-NPA. В тези последни групи имаше значителна защита срещу вдишване, но не и насаждане на PR8. Тези резултати предполагат, че имунните механизми, често характеризирани като слаби, като NK или CD8 + Т-клетъчно-медиирани убийци, могат да играят по-значима роля в защитата срещу болести и смърт, отколкото се предполагаше по-рано от проучвания, при които мишките са били предизвикани чрез вливане на течна суспензия на вирус . Нашите данни предполагат, че животински модели, използващи аерозолни предизвикателства, могат да бъдат подходящ подход за оценка на потенциалната ефикасност на противогрипните ваксини, за които клетъчно-медиираните отговори са корелат на имунитета.
Методи и материали
Препарати за вируси и ваксини
Мишки и дизайн на проучване
Женски мишки BALB/c бяха закупени от The Jackson Laboratories (Bar Harbor, ME) и настанени в Центъра за оценка и изследване на биологичните вещества (CBER), където бяха имунизирани. Мишки, които са били подложени на предизвикателство за вдишване само с нос, са изпратени в Южния изследователски институт (SR, Бирмингам, Алабама) приблизително 1 седмица преди началото на проучването. Размерът на клетката и грижите за животните отговарят на указанията, предписани в Ръководството за грижа и употреба на лабораторни животни, Министерството на земеделието на САЩ чрез Закона за хуманно отношение към животните.
Мишките бяха предизвикани чрез вливане при CBER и вдишване само с нос при SR. Всички експерименти са проведени по протоколи 2006-22 и 10-217, одобрени от институционалните комитети за грижа и употреба на животните, съответно в CBER и SR. Мишките са били на възраст около 15 седмици и са тежали между 19 и 26 грама по време на заразяване с вируса чрез вдишване или вливане.
Система за предизвикателство при вдишване
Преди провеждане на инхалационни предизвикателства, системата се характеризира с използване на PR8 вирус [26]. Характеристиката включваше постигане и поддържане на целеви диапазон на концентрациите на аерозоли, както се определя чрез анализ на плака за анализ на проби от импингер и демонстрация на разпределението на аерозолните частици по размер на предизвикващия аерозол, определен чрез APS анализ.
Вирусно предизвикателство
Вдишване на вируса: Три последователни дни преди инхалационното предизвикателство, мишките са били обучавани в обезопасителните тръби само за нос. В деня на предизвикателството пулверизаторът Collison 3-Jet беше напълнен с суспензия от вирусен запас и свързан към линията за доставка на биоаерозол. Разреждането на вируса, необходимо за доставяне на 100 LD50, беше предварително определено [26]. Събрана е проба суспензия на пулверизатор преди пулверизиране, за да се потвърди, че е приготвено правилното разреждане на вируса. Мишките бяха поставени в задържащи епруветки само за нос и свързани с пленума за инхалационно предизвикателство, използвайки носови конуси с положителен Flow-By ™ (In-Tox Products, LLC; Albuquerque, NM). Групи от мишки бяха изложени на пулверизиран вирус в продължение на 30 минути. Началото на предизвикателния период (T = 0) започна, след като пулверизаторът беше активиран и зададен на 30 psi. Инхалационната доза (приблизително 870 PFU) се изчислява като продукт на концентрация на аерозол, мишна минутна вентилация (0,062 L/min [37]) и продължителност на предизвикателството.
Инстилация на вирус: Групи мишки се анестезират чрез излагане на 3% изофлуран в присъствието на 3% O2 и след това се инокулират с 30 μl PR8, разреден в PBS (приблизително 5160 PFU), чрез нанасяне на капчици от суспензията върху двете нари.
Всички мишки са наблюдавани два пъти дневно по време на карантина и периоди на проучване за признаци на заболеваемост и смъртност. Теглото на тялото се записва ежедневно. Животните, които са загубили ≥25% от изходното си тегло, са евтаназирани. Тези мишки бяха умиращи, с прегърбена поза, бездействие и никакъв отговор на манипулацията. Кривите на оцеляване са начертани, като се вземат предвид както евтаназирани, така и животни, намерени мъртви.
статистически анализи
Статистически анализи за данни за телесно тегло бяха извършени с помощта на автоматизираната система за събиране на данни Provantis (Instem; Стафордшир, Великобритания). Разликите в теглото между групите бяха определени чрез двупосочни повтарящи се мерки ANOVA (Microsoft Excel 2003, Redmond, WA), а разликите в оцеляването бяха определени чрез log-rank Mantel-Cox тест, използвайки GraphPad PRISM 5 софтуер. Средната стойност, стандартното отклонение и коефициентът на дисперсия са изчислени за аеробиологични данни с помощта на Excel или SigmaPlot (Systat Software, Inc., Сан Хосе, Калифорния), когато е подходящо.
Титруване на вируса
Инфекциозната доза от 50% тъканна култура (TCID50) се определя чрез титруване върху MDCK клетки (ATCC линия CCL-34), следвайки стандартна процедура, описана по-рано [36]. Накратко, серийни десеткратни разреждания на всеки белодробен хомогенат се инокулират в четирикратни ямки на 96-ямкова плака, съдържащи еднослоен слой от MDCK клетки. След 1 h в CO2 инкубатор при 37 ° C се добавя еднакъв обем безсерумна среда, съдържаща 3% BSA и третиран с TPCK трипсин (5 μg/ml). След 3-дневна инкубация, останалите клетки се оцветяват с кристално виолетово в глутералдехид. Титърът TCID50 се определя като обратното на разреждането, което показва цитопатичен ефект в 50% от ямките.
- Спокойно вземете хапчетата за повишаване на имунитета, казват лекарите - Bangalore Mirror
- Дисбиоза на чревната микробиота, предизвикана от диетата и ефектите върху имунитета и заболяванията
- Клинична ефективност на лираглутид при лечение на диабет тип 2 в реалния свят А
- Ефективност на плуването като форма на тренировка
- Ефективност на тестваните клубове за отслабване - NHS