От Кели Маккол, Антъни Л. Шварц и Франк Л. Шварц
Изпратено: 19 септември 2013 г. Преглед: 28 март 2014 г. Публикувано: 14 май 2014 г.
информация за глава и автор
Автори
Кели Маккол
- Университетски колеж по остеопатична медицина, Охайо, САЩ
Антъни Л. Шварц
- Университетски колеж по остеопатична медицина, Охайо, САЩ
Франк Л. Шварц *
- Университетски колеж по остеопатична медицина, Охайо, САЩ
* Адресирайте цялата кореспонденция на: [email protected]
От редактирания том
Редактиран от Кели Маккол
1. Въведение
2. Генетична връзка с рак на панкреаса
Семейната агрегация на рака на панкреаса предполага генетична връзка и са идентифицирани няколко важни гена за чувствителност към рак на панкреаса, включително гени с висока проникване: BRCA2, PALB2, PRSS1, SPINK1, STK11 наскоро бяха прегледани [5] и гените за възстановяване на ДНК не съвпадат. Проучванията за асоцииране в целия геном (GWAS) също намират едногенен полиморфизъм (snps), който също е свързан с повишен риск от рак на панкреаса, включително: ABO, 1q32.1, 13q22.1, CLP ™ 1/TERT, CFTR [18, 19].
3. Екологични причини за хроничен панкреатит
4. Епидемиология на затлъстяването, T2DM и рак на панкреаса
За разлика от това, има взаимна връзка между количеството упражнения и риска от затлъстяване, T2DM и рак на панкреаса. Самото упражнение изгаря калории и намалява риска и/или тежестта на затлъстяването, намалява инсулиновата резистентност и насърчава производството на противовъзпалителни цитокини, които противодействат на всички възпалителни и онкогенни процеси, които са разгледани по-долу [10].
5. Молекулни пътища, свързващи затлъстяването, възпалението, диабета и рака на панкреаса
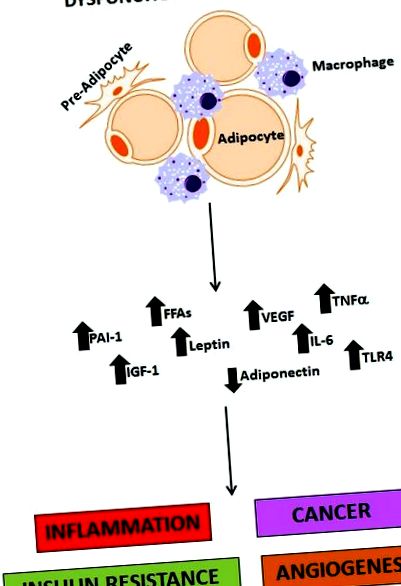
Когато приемът на калории надвишава нормалното метаболитно търсене, има нужда да се съхранява тази излишна енергия и това е основната функция на адипоцита. Мастната тъкан обаче е нещо повече от депо за съхранение. Мастна тъкан (особено висцерална мазнина) се състои от множество клетъчни типове (адипоцити, преадипоцити, макрофаги, фибробласти и кръвоносни съдове) и сега е признат като важен ендокринен орган, който експресира и секретира множество хормони (лептин, адипонектин, резистин), възпалителни цитокини (TNF -α, IL-6 и IFN-β), компоненти на комплемента, инхибитор на плазминогенов активатор-1 (PAI-1), съдов ендотелен растежен фактор (VEGF) и други протеини като моноцитен хемоаттрактант протеин (MCP-1). Понастоящем се смята, че тези фактори, получени от мастна тъкан (Фигура 1), допринасят драстично за индуцирането на хронично възпаление, което се изразява като инсулинова резистентност [29], хиперинсулинемия, T2DM, хиперлипидемия, хипертония и атеросклероза [30] и също допринася за онкогенезата на много солидни тумори [11, 16]. Висцералното затлъстяване е депото на мазнини, най-тясно свързано с производството на тези вещества и последващото развитие на инсулинова резистентност, T2DM и онкогенеза на рак на панкреаса.
5.1. Хранителни вноски
Диети с високо съдържание на мазнини (HFD) и излишък на свободни мастни киселини (FFA):
В самите висцерални мастни клетки FFA (палмитат и др.) Директно индуцират освобождаването на възпалителни цитокини [16] и също така задействат патологичното сигнализиране на тол-подобни рецептори (TLR); активирането на TLR4, по-специално, увеличава допълнителното производство на възпалителни цитокини, допринасяйки за иницииране на инсулинова резистентност [34] и адипогенеза, допълнително увеличаване на масата на адипоцитите и хроничното възпалително състояние, свързано сега със затлъстяването, T2DM и онкогенезата.
Високофруктозен царевичен сироп (HFCS):
Фигура 1.
Ролята на дисфункционалната мастна тъкан при затлъстяването. Дисфункционалната мастна тъкан е критичен източник на молекули, които медиират възпалението, рака, инсулиновата резистентност и ангиогенезата. PAI-1 (инхибитор на плазминогенов активатор-1); FFA (свободни мастни киселини); IGF-1 (инсулиноподобен растежен фактор 1); VEGF (съдов ендотелен растежен фактор); IL-6 (интерлевкин 6); TNF-α (фактор на туморна некроза алфа); TLR4 (таксоподобен рецептор 4).
По отношение на рака на панкреаса има все повече доказателства за специфична дозозависима връзка между приема на HFCS и появата му и този риск не зависи от затлъстяването или ИТМ [15]. Освен това, фруктозата директно стимулира повишен синтез на нуклеинова киселина чрез пентозофосфатния път (катализиран от транскетолаза), който е необходим за пролиферацията на злокачествени клетки и консумацията на HFCS сега е свързана както с онкогенезата, така и с разпространението на тумора и метастазите [15].
Канцерогени в храните:
Високият прием на преработени меса, съдържащи хетероциклични амини и бензо (а) пирини или приготвени при високи температури (пържени или на скара), е свързан с рака на панкреаса [42], както и други храни, съдържащи афлатоксини [43] и други мутагени, връзката с рака на панкреаса по това време са доста слаби.
5.2. Молекулни пътища, задействани от хранителни съставки
Възпалителни протеини, получени от адипоцити:
Възпалителни цитокини (адипокини) като TNF-α, IL-6, IL8, VEGF и IFN-β е доказано, че са повишени при състояния на висцерално затлъстяване [16], както и при остър и хроничен панкреатит и рак на панкреаса [11]. Висцералните адипоцити/макрофаги са основни източници на свързаните със затлъстяването цитокини, за които се смята, че насърчават инсулиновата резистентност [29] (виж по-долу), както и пряко допринасят за онкогенезата чрез няколко пътища [16], включително други рецептори на растежен фактор, цитокинови рецептори или нерецепторни тирозин кинази. Всеки от тези пътища може да увеличи Janus киназа (JAK)/сигнална трансдукция и активатор на транскрипция Преобразувател на сигнали и активатор на транскрипция (STAT), от които STAT3 [44, 45] е пряко свързана с рак на панкреаса. И двата пътя могат да стимулират клетъчната пролиферация - трансформация чрез (1) регулиране нагоре на гени, кодиращи регулатори на клетъчния цикъл (циклини D1/D2, c-Myc), (2) увеличаване на вероятността от мутация (например, клетъчни прото-онкогени, ДНК и клетъчни механизми за възстановяване), (3) инхибиране на апоптозата (Bcl-xL, Mcl-1), (4) намалена клетъчна адхезия и/или (5) стимулиране на ангиогенезата (VEGF) [46].
Лептин също се секретира от адипоцитите и играе ключова роля в регулирането на метаболизма и апетита. Лептинът е известен като хормон на ситостта, но нивата на серумния лептин са повишени при затлъстяване поради централната устойчивост на лептинов рецептор (чрез механизми, подобни на инсулина, обсъдени по-долу) Лептинът има митогенни действия в много ракови клетъчни линии, които изглежда са чрез митоген-активирана протеин-киназа (КАРТА) опосредствани пътища; обаче при някои клетъчни линии на рак на панкреаса той инхибира растежа [47], така че ролята му в този рак в момента е неясна [48, 49].
Адипонектин се секретира изключително от адипоцитите и има както противовъзпалително, така и сенсибилизиращо инсулина действие. Известни като „добри адипокини“ серумните нива на лептин са обратно свързани с ИТМ и нивата са намалени при пациенти със затлъстяване и при много видове рак. Високите нива на адипонектин са обратно свързани с честотата на рак на панкреаса [49].
PAI-1 е инхибитор на серин протеаза, произведен от адипоцити и стромални клетки във висцералната мастна тъкан, свързан е с инвазия на туморни клетки, метастази и ангиогенеза на много злокачествени заболявания, а свръхекспресията на PAI-1 е доказана при много тумори, свързани със затлъстяването, което предполага, че допринася до разпространението на злокачествени заболявания [50]. Интересното е, че високата експресия на инхибитора на плазминогеновия активатор-2 (PAI-2) е предиктор за подобрена преживяемост при пациенти с аденокарцином на панкреаса [51].
VEGF е друг полипептид, получен от адипоцити, който е замесен в растежа на рака, доказано е свръхекспресиран при много видове рак на панкреаса и неговата експресия в тези тумори е свързана с по-лоша преживяемост [52, 53].
Инсулинова резистентност, хиперинсулинемия и повишени сигнални пътища за инсулин/IGF-1 рецептор
Хипергликемията предизвиква изразяване на епидермален растежен фактор на рак на панкреаса
Както вече обсъждахме в тази глава, диабетът е свързан с повишен риск от рак на панкреаса от различни сигнални пътища за цитокини и хормонални рецептори и че голям брой пациенти с рак на панкреаса развиват диабет и повишени глюкози. Интерес представлява и директният ефект на хипергликемията върху онкогенезата, растежа и разпространението на рака на панкреаса. Епидемиологичните проучвания показват, че контролът на глюкозата при пациенти с рак на панкреаса води до подобрена преживяемост, което предполага, че високите нива на глюкоза могат пряко да стимулират растежа и прогресията на тумора [59]. Последните in vitro проучвания на клетъчни култури демонстрират, че глюкозата по дозозависим начин насърчава различен растеж на клетъчната линия на рака на панкреаса и периневрална инвазия чрез регулиране на експресията на невротропен фактор (GDNF) и епидермален растежен фактор (EGF), получен от глиални клетъчни линии повишена трансактивация на рецептора на епидермален растежен фактор (EGFR) [60]. Тези наблюдения подкрепят интензивния контрол на глюкозата като потенциална цел за подобряване на преживяемостта на пациента при рак на панкреаса.
6. Затлъстяване, рецептори, подобни на таксите, и онкогенеза на панкреаса
Доказано е, че хроничното възпаление е важен рисков фактор за появата и прогресията на множество ракови заболявания, включително рак на панкреаса [67-72] [72-75]. Смята се, че хроничното възпаление предизвиква злокачествена трансформация чрез активиране на онкогени, индукция на имуносупресия и инхибиране на туморни супресорни гени и лимфоцити. Патологичното активиране на TLRs играе критична роля в възпалителния отговор, предизвикан от диети с високо съдържание на мазнини и HFCS чрез индуциране на производството на множество провъзпалителни цитокини и те са показали, че са важни за индукцията, пролиферацията, оцеляването, метастазите и бягството от имунно наблюдение и на много от тези видове рак [70, 76]. Някои от най-важните TLR-индуцирани цитокини, замесени в рака, включват TNF-α, IL-1, IL-6, IL-8, IL-10 и IL-23. Провъзпалителната продукция на цитокини след това води до активиране на много тумори, стимулиращи транскрипционни фактори и анти-апоптотични гени. Ядрен фактор каппа бета (NF-кВ) и сигнал преобразувател и активатор на транскрипция 3 (STAT3) са два от най-добре проучените онкогенни транскрипционни фактори.
7. Патологична сигнализация, подобна на такси, рецептор за растеж на панкреаса и устойчивост на терапия
8. TLR като потенциална терапевтична цел
За разлика от това, също е показано, че TLR агонистите могат да насърчават оцеляването и миграцията на раковите клетки и прогресията на тумора. Например, доказано е, че агонистите на TLR повишават жизнеспособността на тумора и метастазирането на човешкия рак на белия дроб (TLR7/8) [103]; пролиферация на човешки миелом (TLR3) [104]; адхезия и метастази на човешки колоректален рак (TLR4) [105]; и миграция на човешки глиобластом (TLR4) или рак на гърдата при човека (TLR2) [106]. Що се отнася до рака на панкреаса, наскоро беше съобщено, че TLR7 не е силно изразена при рак на панкреаса при мишки и хора, но лигирането на TLR7 доведе до ускорена прогресия на тумора чрез STAT3 растежните пътища, обсъдени по-рано. По този начин изглежда, че има нож с две остриета между намаляване или насърчаване на растежа на тумора, използвайки терапии, базирани на агонисти за различни TLR.
От друга страна, използването на TLR антагонисти се оказа полезно за инхибиране на туморния растеж в животински модели, в които микросредата на тумора насърчава оцеляването и метастазирането чрез TLR сигнализиране. TLR антагонистите могат също да намалят нивото на активиране на стромални клетки като тумор-свързани макрофаги. Макрофагите изразяват набор от TLR и са способни да произвеждат няколко растежни фактора чрез TLR сигнализация [107]. Нещо повече, отмяната на TLR-4 сигнализирането в свързаните с тумора макрофаги намалява растежа на тумора in vivo [108].
9. Превенция на свързания със затлъстяването рак на панкреаса
Понастоящем има убедителни доказателства, че затлъстяването, хроничното възпаление и свързаната с тях секреция на множество възпалителни цитокини, хормони и растежни фактори, описани тук, допринасят както пряко, така и косвено за повишения риск от рак на панкреаса, по-агресивен туморен растеж, както и лоша реакция на терапевтична интервенция. По този начин, в допълнение към спирането на пушенето и умереността при консумация на алкохол, модификация на начина на живот с упражнения, поддържане на нормален ИТМ, консумация на по-големи количества пресни плодове и зеленчуци, по-малко животински мазнини и преработени храни; особено тези, обогатени с HFCS, са очевидни препоръки. Освен това има все повече доказателства, че други противовъзпалителни средства като нестероидните противовъзпалителни средства (НСПВС) [110], лекарствата за понижаване на липидите на Statin и лекарствата за T2DM като тиазолидиндионите (TZD) [111] и метформин [112, 113] имат специфични защитни ефекти срещу онкогенезата, както и растежа на тумора и отговора на лечението.
10. Заключение
Затлъстяването допринася за повишен риск от множество солидни ракови заболявания, включително рак на панкреаса. По-специално за рака на панкреаса, затлъстяването насърчава провъзпалителна среда, която насърчава онкогенезата, растежа на тумора, метастатичното разпространение, както и устойчивостта към терапия чрез различни молекулярни пътища. Принципните пътища, свързани със затлъстяването, включват повишаване на TNF-α, IL-1, IL-6, IL-8, IL-10 и IL-23, както и активиране на NF-κB и STAT3. Настоящите диети на индустриализираните държави, които съдържат твърде много въглехидрати с нисък гликемичен индекс, наситени мазнини и HFCS, са основните причинители на патологичните сигнални пътища на TLR3 и TLR4 в адипоцитите, които след това допринасят за развитието на инсулинова резистентност, отлагане на извънматочна мазнина в множество тъкани включително панкреаса, който от своя страна усилва описаните тук пътища за растеж и сигнализация, които водят до онкогенеза и разпространение на тумора.
- Свързано ли е детското затлъстяване с хирургичния департамент на рака на панкреаса в Колумбийския университет
- Как влияе затлъстяването на развитието на рака на панкреаса и лечението Онкологичен съветник по медицинска сестра
- Рецепти за обяд за пациенти с рак на панкреаса - Мрежа за действие на рака на панкреаса
- Дългосрочен оцелял Етап IV Рак на панкреаса - Моето лечение - Нека; s Победа
- Недохранване, слабост и саркопения при оценки на пациенти с рак на панкреаса и интервенции