Резюме
Заден план
Повече от просто последица от лошия избор на начин на живот, затлъстяването е заболяване, което е сложно, полигенно, многофакторно, хронично и устойчиво на много форми на лечение. Затлъстяването предразполага към развитие на сърдечно-съдови заболявания (ССЗ), захарен диабет тип 2 (T2D), хипертония и много други състояния [1].
През периода между 1980 и 2014 г. световното разпространение на затлъстяването се е увеличило повече от два пъти. Според Световната здравна организация (СЗО) над 1,9 милиарда възрастни на възраст над 18 години са с наднормено тегло (38% от мъжете и 40% от жените), от тези над 600 милиона са със затлъстяване (11% от мъжете и 15% от жените ) през 2014 г. Четиридесет и два милиона деца под 5-годишна възраст са били с наднормено тегло или затлъстяване през 2013 г. В развиващите се страни нарастването на наднорменото тегло и затлъстяването при деца е било с повече от 30% по-високо от това на развитите страни [2]. Например в Бразилия 16,8% от мъжете и 24,4% от жените са били със затлъстяване, докато 56% от възрастното население са били с наднормено тегло през 2013 г. [3].
Индексът на телесна маса (ИТМ) е опит за количествено определяне на количеството тъканна маса (мускули, мазнини и кости) поотделно и категориите на ИТМ се определят, както следва: постно под 18,5, нормално тегло 18,5–24,9, наднормено тегло 25–29,9 и затлъстяване над 30 kg/m 2 [2]. В съответствие със СЗО, източноазиатците с нормално тегло имат ИТМ 18,5–23, наднормено тегло 23–27,4 и затлъстяване над 27,5 kg/m 2 [4]. ИТМ има значителни ограничения, тъй като не винаги проявява риск от други хронични състояния, свързани с теглото [5]. Sharma et al. са предложили проста клинична и функционална система за стадиране, а именно Edmonton Obesity Staging System (EOSS). Когато се използва заедно с друга антропометрична класификация, EOSS предоставя по-точно измерване на свързаните със затлъстяването рискове за здравето, тъй като включва наличието на съпътстващи заболявания, за да подпомогне вземането на решения в клиничната практика [6], което е важно, като се има предвид, че метаболитно здравите затлъстяващи включват приблизително 20% от затлъстелите лица [7].
В Съединените щати повишеното разпространение на затлъстяването е причина за почти 40 милиарда щатски долара увеличени медицински разходи до 2006 г., включително 7 милиарда щатски долара за лекарства, отпускани с рецепта. Finkelstein et al. са показали до каква степен наднорменото тегло е увеличило годишните медицински разходи: разходите за наднормено тегло и затлъстяване биха могли да достигнат 78,5 милиарда долара през 1998 г. и 147 милиарда долара през 2008 г. [8]. Въз основа на данни от 2000 до 2005 г. Cawley и Meyerhoefer са изчислили, че разходите за медицинско обслужване на САЩ за заболявания, свързани със затлъстяването при възрастни, са 209,7 милиарда щатски долара, което съответства на 20,6% от националните разходи за здравеопазване [9].
Факторите, водещи до развитието на затлъстяване, са широко проучени през последните години. Централната регулация на апетита, особено по отношение на хедоничния апетит, е поле, силно вълнуващо. Наскоро бяха одобрени нови лекарства за лечение на затлъстяване в САЩ: лираглутид, фентермин/топирамат, налтрексон/бупропион и лоркасерин.
Лираглутидът е агонист на подобен на глюкагон пептид 1 (GLP-1), който споделя 97% хомология с естествения GLP-1, удължавайки полуживота на циркулиращия GLP-1 от 1 до 2 минути до 13 часа. Лираглутид е одобрен за първи път за лечение на T2D в Европа през 2009 г. [10]. Сред новите лекарства за затлъстяване лираглутидът е най-изследван, особено по отношение на неговите важни ефекти чрез действия върху лимбичната система [11].
Този преглед ще разгледа основните констатации относно централната регулация на апетита и основните проучвания с новите лекарства против затлъстяване, с по-голям акцент върху лираглутид 3,0 mg.
Патофизиология на затлъстяването
Освен добре познатите фактори, които водят до затлъстяване, като увеличаване на енергийния прием чрез поглъщане на преработени храни с висока енергийна плътност и намаляване на физическата активност, трябва да се имат предвид няколко различни фактора. Някои предполагаеми фактори, допринасящи за затлъстяването, включват чревната микробиота, ендокринните разрушители, епигенетиката, увеличаването на възрастта на майката, по-голямата плодовитост сред хората с по-голямо затлъстяване, асортиращо чифтосване, дълг на съня, фармацевтична ятрогенеза, намаляване на променливостта на околната температура и вътрематочни и междупоколенни ефекти [12 ]. Човешката затлъстяване и предразположението към наддаване на тегло се влияят от множество гени и най-вероятната оценка за наследствеността на телесните мазнини при хората варира от около 25 до 75% [13]. Генните мутации, които са достатъчно достатъчни, за да причинят затлъстяване при хората, са изключително редки. Съобщени са почти 176 случая на човешко затлъстяване поради мутации в повече от десет различни гена. Забележимо е, че почти всички тези мутации са ограничени в пътя на лептина/меланокортина на хипоталамуса, което е от решаващо значение за корекцията на енергийната хомеостаза на цялото тяло [14].
Към изследването на често срещаното затлъстяване или полигенно затлъстяване се подхожда чрез проучвания за свързване, проучвания на кандидат-генни асоциации и проучвания за асоцииране в целия геном (GWAS), в опит да се намерят асоциации между генетични вариации и свързана със затлъстяването черта. Досега GWAS беше идентифицирал почти 100 локуса, свързани със признаци, свързани със затлъстяването, сред тях най-подходящ е полиморфизмът rs9939609, разположен в гена на FTO [15, 16].
Невъзможността да се ограничи прекомерният прием на храна вероятно е ключов процес, който допринася за неконтролирано наддаване на тегло, главно защото изглежда задоволително да се яде по-вкусен енергичен и обезогенен тип храна. Високата хедонична стойност и изкусителните храни са основните виновници за преяждане или ядене извън непосредствените метаболитни нужди (поведение за възнаграждение за храна) [17]. Връзката между енергийния прием и разход се модулира не само от фактори на околната среда и поведението, но също така и от генетични детерминанти и механизми за невроендокринна обратна връзка. Тези механизми се регулират от хипоталамуса, централното място за хомеостатичното регулиране на телесното тегло. Хипоталамусът интегрира периферни хормонални сигнали от стомашно-чревния тракт [грелин, холецистокинин, пептид YY, панкреатичен полипептид (PP), GLP-1], панкреас (инсулин) и мастна тъкан (лептин), които модифицират централната орексигенна [напр. невропептид Y (NPY)], свързан с агути пептид (AgRP) и анорексигенен [напр. алфа-меланоцит стимулиращ хормон (α-MSH), произведен от проопиомеланокортин (POMC) пептид], кокаин- и амфетамин-регулиран транскрипт [CART]) невропептиди [18].
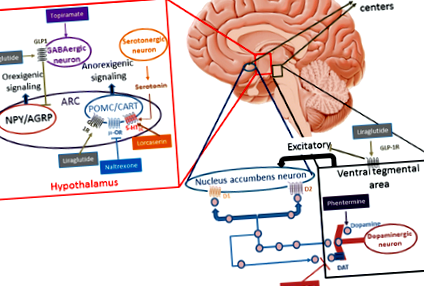
При проучвания върху животни GLP-1 директно стимулира POMC/CART невроните и индиректно инхибира невротрансмисията в неврони, експресиращи NPY и AgRP чрез сигнализация, зависима от гама-аминомаслена киселина (GABA) [19,20,21]. Тези открития показват, че GLP-1 рецепторите (GLP-1R) на POMC/CART експресиращи дъговидни (ARC) неврони вероятно медиират индуцирана от лираглутид загуба на тегло (Фиг. 1). Загубата на тегло се намалява чрез локална блокада на GLP-1R върху ARC неврони с антагонист на GLP-1R [22]. Въпреки че е добре документирано в животински модели, действието на лираглутид в човешкия хипоталамус е по-трудно да се докаже. Изследвания с функционално ядрено-магнитен резонанс (fMRI) при хора не са установили модификации на неговата невронална активност с използването на лираглутид; това отсъствие на сигнал може да се дължи на малкия размер на хипоталамуса и неговата непосредственост към синусите [23, 24].
(Адаптирано от Kim et al., Baggio et al. И Wang et al. [19,20,21])
Механизъм на действие на лекарствата против затлъстяване. 5-HT2C-R: 5-хидрокситриптамин (серотонин) 2С рецептор; ДЪГА дъговидно ядро, КОШИЦА кокаин и амфетамин-регулирана транскрипция, D1 допаминов рецептор D1, D2 допаминов рецептор D2, DAT допаминов транспортер, ГАМК гама-аминомаслена киселина, GLP-1R глюкагон-подобен пептид-1 рецепто, NPY/AgRP неврони, експресиращи невропептид Y и свързан с агути пептид, POMC проопиомеланокортин, μ-OR μ-опиоиден рецептор
Регулирането на хедоничния апетит се извършва в лимбичните области, като хипокампус, амигдала, nucleus accumbens, вентрална тегментална област, цингуларна извивка, орбитофронтална кора, инсула и префронтална кора. Тези области участват в развитието на условния отговор и възнаграждението. Въпреки че класическите невротрансмитери, участващи в тази мрежа, са допамин, серотонин и GABA, няколко проучвания върху животни подчертават приноса на GLP-1 в системата [25, 26]. Hsu et al. оцени диетичното поведение на плъхове, получили екзедин-4 във вентралната част на хипокампалната формация. В допълнение към намаляването на общия енергиен прием и теглото се наблюдава значително намаляване на приема на мазнини и увеличаване на стандартната консумация на фуражи, когато им е било позволено да избират каква храна да ядат. Тази констатация подчертава значението на GLP-1 в мозъчните региони, участващи в контрола на наученото и мотивационното поведение при консумация на храна [26].
Farr et at. идентифицира, чрез имунохистохимичен анализ, наличието на GLP-1R в ядрата на хипоталамуса, продълговатия мозък, областта postrema и теменната кора на мозъка на хората [23]. Долната теменна кора е част от мрежата за внимание, която може да се активира от важни или силно желани стимули, като вкусна храна. Хората, приемащи лираглутид, представят при fMRI намаляване на активирането на теменната кора в отговор на по-желаната храна. Това париетално активиране в отговор на високоенергийна храна е обратно свързано със загубата на тегло. Пациентите с най-ниска теменна активация отчитат, че ще бъде по-малко приятно да се яде, докато е на лираглутид, когато е на гладно. В същото проучване се съобщава за намаляване на активирането при инсула и путамен при пациенти, приемащи лираглутид, когато са изложени на вкусни хранителни сигнали. Инсулата участва в обработката на изтъкнатост и обществото, от своя страна, путамен изглежда допринася за обработката на наградата за храна [23]. Предишно проучване с екзенатид, друг агонист на GLP-1 рецептор (получен от екзендин-4), също показва намален мозъчен отговор на вкусни хранителни снимки в инсула, амигдала, путамен и орбитофронтална кора [27].
Друго скорошно проучване, използващо fMRI, определя ефектите на ендогенния GLP-1 (използвайки GLP-1 антагонист) и на лираглутид върху активирането на централната нервна система (ЦНС) при здрави слаби индивиди, както и при пациенти с T2D. Доказано е, че ендогенният GLP-1 повлиява централната реакция на вкусната консумация на храна. В сравнение със здрави сухи пациенти, пациентите с T2D показват намалено активиране на дясната инсула от шоколадово мляко. При пациенти със затлъстяване с T2D, лираглутид подобрява наблюдавания дефицит в отговор на вкусна храна, което може да допринесе за загубата на тегло, наблюдавано при лираглутид [28].
Аспект, който наскоро беше разгледан в изследването на затлъстяването, е хормоналната адаптация към загуба на тегло. Sumithran et al. включи 50 пациенти с наднормено тегло или затлъстяване с недиабет в 10-седмична програма за отслабване, състояща се от диета с много ниска енергия. В края на 10 седмици, след средна загуба на тегло от 13,5 ± 0,5 kg, се наблюдава значително намаляване на концентрациите на аноректичните пептиди лептин, пептид YY, холецистокинин, инсулин и амилин. Наблюдавани са също повишения в концентрациите на орексигенните пептиди грелин, глюкозозависимият инсулинотропен полипептид (GIP) и РР. Една година след първоначалната загуба на тегло все още имаше значителни разлики в средните концентрации на тези пептиди в сравнение с изходното ниво; Нивата на GLP-1 също са по-ниски от изходните. Авторите заключават, че промените в циркулиращите медиатори на апетита, които насърчават възстановяването на теглото, продължават след една година от загубата на тегло. Те подчертават значението на стратегиите за противодействие на тази промяна, за да се предотврати рецидив на затлъстяването, в противен случай дългосрочните резултати ще останат незадоволителни [29].
Лечение на затлъстяването
Нефармакологичното лечение на затлъстяването може да бъде ефективно, но процентът на дългосрочен успех е нисък и възстановяването на загубеното тегло е основен проблем. Рандомизираните проучвания показват, че по-голямата първоначална загуба на тегло, постигната с промени в начина на живот, свързани с други стратегии (например диети с течна формула или аноректични лекарства), подобрява дългосрочното поддържане на теглото, при условие че е последвано от 1-2 години интегрирано поддържане на теглото програма, състояща се от интервенции в начина на живот, включващи промяна в диетата, хранително образование, поведенческа терапия и повишена физическа активност. Следователно, по-голямата първоначална загуба на тегло като първата стъпка с фармакологична интервенция може да доведе до подобрено поддържано поддържане на теглото [30].
Wing и сътр. демонстрира, че степента на загуба на тегло за една година е силно свързана с подобрения в кръвното налягане (АН), както и нивата на глюкоза, триглицериди и HDL на холестерол на гладно, но не и на нивата на LDL холестерол. В сравнение с участниците със стабилно тегло, тези, които са загубили 5 до 2), са назначени на следните дози лираглутид: 1,2, 1,8, 2,4 и 3,0 mg (n = 90–95) или на плацебо (n = 98), прилагани веднъж дневно ( QD) подкожно или към орлистат (120 mg; n = 95) 3 пъти дневно през устата. Освен това участниците имаха 500 kcal дневна диета с енергиен дефицит и увеличиха физическата си активност. Промяната в теглото беше анализирана по намерение за лечение (ITT) и беше основната крайна точка. Последва 84-седмично отворено удължаване. Както е показано на фиг. 2, индуцирана от лираглутид загуба на тегло значително по-висока от тази при плацебо (P = 0,003 за лираглутид 1,2 mg и P фиг. 2
Адаптиран от Astrup et al. [35]
Промяна в телесното тегло след лечение на затлъстели индивиди с четири дози лираглутид (1,2, 1,8, 2,4 или 3,0 mg) или плацебо, прилагано веднъж дневно подкожно, или орлистат (120 mg) три пъти дневно през устата. Данните са средни (95% CI) за популацията ITT с последното пренесено наблюдение (LOCF)
- Гладът в света все още не намалява след три години и затлъстяването все още расте - доклад на ООН
- Световно затлъстяване на живо - Световна федерация за затлъстяване COVID-19 и Webinar Series за затлъстяване
- Топ клиника в Бад Рагац с топ лечения при затлъстяване
- Тежестта на затлъстяването при жени в репродуктивна възраст и по време на бременност в условия на среден доход A
- Световната федерация по затлъстяването признава затлъстяването като хронично рецидивиращо прогресивно заболяване Д-р