Спандана Раджендра Копали
1 Катедра по наука за живота, Колеж по биомедицински и здравни науки, Университет Конкук, Чунджу, Република Корея
Кю-Мин Ча
1 Катедра по наука за живота, Колеж по биомедицински и здравни науки, Университет Конкук, Чунджу, Република Корея
Санг-Хо Ли
1 Катедра по наука за живота, Колеж по биомедицински и здравни науки, Университет Конкук, Чунджу, Република Корея
Джи-Хун Рю
1 Катедра по наука за живота, Колеж по биомедицински и здравни науки, Университет Конкук, Чунджу, Република Корея
Seock-Yeon Hwang
2 Катедра по биомедицински лабораторни науки, Колеж по приложни науки и промишленост, Университет Daejeon, Daejeon, Република Корея
Мин-Сик Джонг
1 Катедра по наука за живота, Колеж по биомедицински и здравни науки, Университет Конкук, Чунджу, Република Корея
Йонг-Хван Сун
3 Ilhwa Co., Ltd., Изследователски институт за женшен, Гури, Република Корея
Си-Куан Ким
1 Катедра по наука за живота, Колеж по биомедицински и здравни науки, Университет Конкук, Чунджу, Република Корея
Резюме
Заден план
Повишената температура на тестисите нарушава сперматогенезата и причинява безплодие. В настоящото проучване е изследван защитният ефект на ензимно биотрансформирания Panax ginseng Meyer от пектиназа (GINST) срещу хронично интермитентно увреждане на тестисите, предизвикано от топлинен стрес при плъхове.
Методи
Плъховете от мъжки тип Sprague – Dawley (на възраст 4 седмици, 60–70 g) бяха разделени на четири групи: нормален контрол (NC), контрол на топлинния стрес (HC), топлинен стрес плюс GINST-100 mg/kg (HG100) и топлинен стрес плюс GINST-200 mg/kg (HG200) групи за лечение. Всяка доза GINST (100 mg/kg и 200 mg/kg) се смесва отделно с обикновена диета с пелети и се прилага перорално в продължение на 24 седмици. За предизвикване на топлинен стрес, плъховете в групата с NC се поддържат при 25 ° C, докато плъховете в групите HC, HG100 и HG200 са изложени на 32 ± 1 ° C в продължение на 2 часа дневно в продължение на 6 месеца. На 25-та седмица тестисите и серумът от всяко животно бяха анализирани за различни параметри.
Резултати
Значителен (p Ключови думи: топлинен стрес, безплодие, женшен Panax, реактивни кислородни видове, сперматогенеза
1. Въведение
Регулирането на телесната температура е от решаващо значение за осигуряване на оптимално функциониране на различни органи в зависимост от молекулярните и клетъчните механизми, свързани с всеки конкретен процес [1], [2]. Повишената температура на тестисите нарушава сперматогенезата и причинява безплодие [3], [4]. Обширни предклинични проучвания при плъхове, мишки и маймуни показват, че лекият тестикуларен топлинен стрес (43 ° C в продължение на 15 минути) предизвиква масивно намаляване на производството на сперматозоиди заедно с окислително увреждане чрез активиране на различни сигнални пътища. Неблагоприятното въздействие на хипертермията върху нормалните тестиси при възрастни при хора е добре известно [5], [6]. Повишените температури стават все по-разпространени поради съвременния начин на живот и опасностите, свързани с професията. Тези фактори по-специално могат да повлияят на производството на сперматозоиди и да допринесат за мъжко безплодие [7], [8].
Тестикуларният топлинен стрес включва окислително увреждане на зародишните клетки, клетките на Лейдиг и най-вероятно клетките на Сертоли [9]. Производството на свободни радикали и реактивни кислородни форми (ROS), включително супероксидния анион и водородния пероксид, може да предизвика положителни промени във функцията на сперматозоидите, като хиперактивация, капацитация и акрозомна реакция [10], [11]. Свръхпроизводството на ROS обаче може да навреди на сперматозоидите и може да доведе до мъжко безплодие. Сперматозоидите са силно чувствителни към ROS-индуцирани увреждания [12]. Тъй като както сперматогенезата, така и стероидогенезата на клетъчните клетки на Leydig са уязвими на оксидативен стрес, пероксидативното увреждане се счита за най-важната причина за нарушена функция на тестисите. Повишената телесна температура отрицателно променя метаболитната функция, като по този начин засилва образуването на ROS, което води до тежък оксидативен стрес [13]. Оксидативният стрес възниква след нарушаване на баланса между производството на ROS и антиоксидантните защитни системи [14]. Следователно, за да се гарантира качеството на сперматозоидите, е важно да се предотврати топлинния стрес на цялото тяло.
2. Материали и методи
2.1. Подготовка на GINST и анализ на течна хроматография с висока производителност
2.2. Експериментални животни
Мъжки плъхове Sprague – Dawley (общо 40, на възраст 4 седмици, 60–70 g) са закупени от Samtako Bio Korea, Inc. (Osan, Корея) и са били аклиматизирани в съоръжението за животни в продължение на 1 седмица преди експеримента. Те бяха снабдени със стандартна диета с гранули и бяха държани при постоянна температура (23 ± 2 ° C) и относителна влажност (55 ± 5%) при 12/12-часов цикъл светлина/тъмнина с достъп до храна и вода ad libitum . Плъховете бяха държани в Регионалния център за иновационни центрове за експериментални животни, Университет Конкук, Корея, в съответствие с Институционалните насоки на Комитета за грижа и употреба на животните. Проучването е одобрено от Комитета по етика на животните (Разрешение №: KU12052) в съответствие с член 14 от корейския Закон за експериментална защита на животните.
2.3. Експериментален дизайн
2.4. Измерване на серумни биохимични параметри
Взема се кръв от коремната вена и се събира в тръба за активиране на гел и съсирек SST (Becton and Dickinson, Franklin Lakes, NJ, USA). Серумът се отделя чрез центрофугиране при 1500 g в продължение на 10 минути при стайна температура. Серумни биохимични параметри като серумна глутаминова оксалоцетна трансаминаза (GOT), глутаминова пирувична трансаминаза (GPT), концентрация на албумин (ALB), общ серумен холестерол (T-CHO), липопротеин-холестерол с ниска плътност (LDL-C), триглицериди (TG) ) и глюкозата (GLU) бяха анализирани, използвайки съответните им налични в търговската мрежа комплекти (Diagnostic Product Corporation, Лос Анджелис, Калифорния, САЩ).
2.5. Измерване на кинематичните стойности на спермата
Проби от сперма бяха извлечени от левия каудален епидидим чрез изрязване с ножица; една капка опашна течност веднага се поставя в съд за култивиране, съдържащ 5 ml балансиран солев разтвор на Hank, предварително загрят до 37 ° C и допълнен с 10 mg/ml BSA (говежди серумен албумин). След инкубация в продължение на 5 минути при 37 ° С, аликвотна част от суспензията се събира с микропипета и се разрежда, за да съдържа 40 ± 10 сперматозоиди под определеното микроскопично поле (увеличение 100 ×). След това суспензията (10 μL) се добавя към 2X-CEL предметно стъкло (дълбочина: 80 μm, дебелина: 0,15 mm; Hamilton Thorne Res., Beverley, MA, USA), което е предварително затоплено в CO2 инкубатор (Sanyo Electric Co., Осака, Япония) при 37 ° C. Подвижността на сперматозоидите е регистрирана с помощта на компютърно подпомаган анализатор на сперматозоиди (CASA; Hamilton Thorne Res.) С обектив × 4 за обектив и свързана със заряд камера камера. Най-малко 200 сперматозоиди във всяка проба са били наблюдавани за анализ на модела на подвижност.
2.6. Western blot анализ
Равни количества протеини на тестисите от всяка проба се разделят чрез 10% натриев додецил сулфат полиакриламиден гел електрофореза и се прехвърлят в мембрана от поливинилиден флуорид (Millipore, Billerica, МА, САЩ). Всяка мембрана се инкубира за 1 час в буфериран с Tris физиологичен разтвор, съдържащ 0,1% Tween-20 и 5% обезмаслено мляко, за да блокира неспецифичното свързване на антитела. Впоследствие мембраните бяха инкубирани със специфични първични антитела (разреждане 1: 2000; Santa Cruz Biotech, Santa Cruz, CA, USA). Бета-актинът се използва като вътрешен контрол. Всеки протеин беше открит с помощта на конюгирани с хрян пероксидаза вторични антитела и система за откриване на хемилуминесценция (GE Healthcare Life Sciences, Little Chalfont, Великобритания).
2.7. РНК изолация и верижна реакция на полимеразна обратна транскрипция в реално време
За in vivo анализ, общата РНК се екстрахира от тестикуларната тъкан, като се използва реагентът RNA-Bee, съгласно инструкциите на производителя, и РНК (1 μg) се транскрибира обратно, следвайки процедурите, описани по-горе [26]. Използваните грундове са изброени в Таблица 1. Полимеразна верижна реакция (PCR) се извършва в продължение на 30 цикъла при 95 ° С за 40 s, 56 ° C за 40 s и 72 ° C за 40 s. След амплификация, PCR продуктите се разделят с помощта на електрофореза върху 2.0% агарозен гел, съдържащ етидиев бромид, и лентите се визуализират с ултравиолетова флуоресценция. Интензивността на лентите беше анализирана с помощта на софтуерния пакет ImageJ (версия 1.410; Национален институт по здравеопазване, Bethesda, MA, САЩ).
маса 1
Грундове, използвани в изследването
| Пероксиредоксин (PRx) 4 | Напред: 5′-CTG ACT GAC TAT CGT GGG AAA TAC T-3 ′ |
| Реверс: 5′-GAT CTG GGA TTA TTG TTT CAC TAC C-3 ′ | |
| Глутатион-S-трансфераза (GST) m5 | Напред: 5′-TAT GCT CCT GGA GTT TAC TGA TAC C-3 ′ |
| Реверс: 5′-AGA CGT CAT AAG TGA GAA AAT CCA C-3 ′ | |
| Глутатион пероксидаза (GPx) 4 | Напред: 5′-GCA AAA CCG ACG TAA ACT ACA CT-3 ′ |
| Реверс: 5′-CGT TCT TAT CAA TGA GAA ACT TGG T-3 ′ | |
| Инхибин-α | Напред: 5′-AGG AAG GCC TCT TCA CTT ATG TAT T-3 ′ |
| Реверс: 5′-CTC TTG GAA GGA GAT ATT GAG AGC-3 ′ | |
| Андрогенен рецептор (AR) | Напред: 5′-CTG GAC TAC CTG GAT CTC TA-3 ′ |
| Реверс: 5′-CCT GGG CTG TAG TTT TAT TG-3 ′ | |
| Фоликулостимулиращ хормон рецептор (FSHR) | Напред: 5′-GGA CTG AGT TTT GAA AGT GT-3 ′ |
| Реверс: 5′-TTC CAT AAC TGG GTT CAT CA-3 ′ | |
| Рецептор на лутеинизиращ хормон (LHR) | Напред: 5′-CTA TCT CCC TGT CAA AGT AA-3 ′ |
| Реверс: 5′-TTT GTA CTT CTT CAA ATC CA-3 ′ | |
| Нектин-2 | Напред: 5′-AGT GAC CTG GCT CAG AGT CA-3 ′ |
| Реверс: 5′-TAG GTA CCA GTT GTC ATC AT-3 ′ | |
| Глицералдехид-3-фосфат дехидрогеназа (GAPDH) | Напред: 5′-AAC TTT GGC ATT GTG GAA GGG C-3 ′ |
| Реверс: 5′-ACA CAT TGG GGG TAG GAA CAC G-3 ′ | |
| cAMP отзивчив елемент, свързващ протеин 1 (CREB-1) | Напред: 5′-ACT GGC TTG GCA CAA CCA GA-3 ′ |
| Реверс: 5′-GGC AGA AGT CTC TTC ATG ATT-3 ′ |
2.8. Статистически анализ
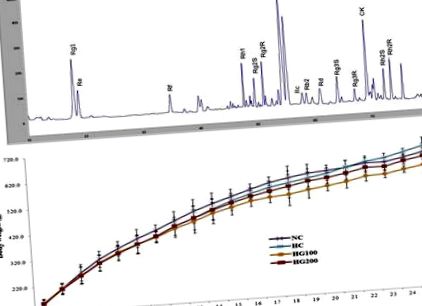
Данните са изразени като средно ± стандартно отклонение. Значимостта беше анализирана с помощта на Student t тест за сравнения между две групи и дисперсионен анализ за множество сравнения, като се използва GraphPad Prism версия 4.0 (Graph Pad Software, Сан Диего, Калифорния, САЩ). Стойност на p Фиг. 1 А. По-рано наблюдавахме, че по време на третирането с пектиназа, основните пикове на сапонин, включително гинзенозиди Rg1, Rg2 R, Rb1, Rb2 и Rd в екстракта от P. женшен са значително намалени [26]. В съгласие с предишните ни данни, пиковете, свързани с гинзенозидите в GINST, бяха намалени в партидата, използвана за настоящото проучване. Освен това се наблюдава повишен пик с по-високи концентрации на CK. Съдържанието на гинзенозид в GINST, определено на база сухо тегло, е както следва: Rg1 (46,72 mg/g), Re (18,66 mg/g), Rf (62,18 mg/g), Rh1 (33,68 mg/g), стереоизомер Rg2 S (10,02 mg/g), стереоизомер Rg2R (10,34 mg/g), Rc (53,49), Rb1 (18,99 mg/g), Rb2 (79,98 mg/g), Rd (103,77 mg/g), Rg3 S (21,65 mg/g), Rg3R (28.85 mg/g), CK (280.48 mg/g), стереоизомери Rh2S (35.68 mg/g) и Rh2R (53.94 mg/g).
HPLC анализ на пръстови отпечатъци на GINST и ефект на GINST върху нарастването на телесното тегло при плъхове с топлинен стрес. (А) HPLC хроматограма. (Б) Показано е общото телесно тегло на групите NC, HC, HG100 и HG200 от седмици 1 до 25. Всяка точка представлява средната стойност (n = 10). b.w., телесно тегло; GINST, третиран с пектиназа екстракт от женшен Panax; NC, нормален контрол; HC, контрол на топлинния стрес; HG100, топлинен стрес и получи GINST 100 mg/kg телесно тегло; HG200, топлинен стрес и получи GINST 200 mg/kg телесно тегло; HPLC, високоефективна течна хроматография.
3.2. Ефект на GINST върху нарастването на телесното тегло и теглото на органи при плъхове с топлинен стрес
Както е показано на фиг. 1 Б, са наблюдавани незначителни разлики в нарастването на телесното тегло между групите, но тези отклонения не са статистически значими. Крайното телесно тегло на 24-та седмица за групата с NC е 624,8 ± 46,5 g, 646,3 ± 59,3 g за HC, 598,3 ± 49,6 g за HG100 и 610,4 ± 36,8 g за HG200. Всички животни са оцелели от експерименталния период и не е наблюдавано ненормално поведение в групите, третирани само с NC, HC и/или HG100- и HG200 по време на проучването.
Данните са изразени като средна стойност ± SEM (n = 10). Статистическият анализ беше извършен чрез тест на Student и еднопосочен ANOVA с помощта на GraphPad Prism версия 4.0.
- Пълнотекстови екстракти от листен женшен Panax с хранителни вещества, упражняващи ефекти срещу затлъстяване при високо съдържание на мазнини
- Метаболитни ефекти на периодично гладуване Годишен преглед на храненето
- Забележка Хронична инфекция на пикочните пътища поради Candida utilis
- Разпространение на малкия чревен бактериален растеж сред пациенти с хроничен панкреатит A
- Оксалат Неразпозната причина за хронична болка и неразположение; Център за лечебно хранене