1 Първият отдел по вътрешни болести и Център за медицинско образование и кариерно развитие, Медицински университет Фукушима, 1 Хикаригаока, Фукушима 960-1625, Япония
2 Катедра по кардиология, Медицинска катедра, Медицинско училище Дейвид Гефен в UCLA, Лос Анджелис, Калифорния 90095-1679, САЩ
Резюме
За да изясним ролята на хем оксигеназа-1 (HO-1) в сърдечно-съдовата система, ние анализирахме едногодишни HO-1 нокаутиращи мишки. Хомозиготните HO-1 нокаутиращи мишки са имали тежък аортит и коронарен артериит с мононуклеарна клетъчна инфилтрация и образуване на мастни жилки дори при стандартна диета с чау. Нивата на общия холестерол и HDL в плазмата са сходни сред трите генотипа. Обаче, хомозиготните HO-1-нокаутиращи мишки имат по-ниско телесно тегло и плазмен триглицерид. Дефицитът на HO-1 води до промяна в състава на HDL. Съотношението на аполипопротеин AI към AII при HO-1-нокаутиращи мишки е намалено около 10 пъти в сравнение с мишки от див тип. В допълнение, параоксоназата, ензим срещу оксидативен стрес, беше намалена с по-малко от 50% при HO-1-нокаутиращи мишки. Нокаутиращите мишки също показват значително повишаване на плазмените липидни хидропероксиди. Това проучване, използващо остарели HO-1 нокаутиращи мишки, затвърди идеята, че HO-1 функционира за потискане на системното възпаление в артериалната стена и предотвратява плазменото липидно пероксидиране.
1. Въведение
Хем оксигеназата (НО) окислително катализира хема до биливердин, въглероден оксид и свободно желязо, използвайки NADPH-цитохром Р450 редуктаза като електронен донор [1–3]. Редица проучвания предполагат потенциална защитна функция на този ензим срещу оксидативен стрес при различни условия с транскрипционно активиране на хем оксигеназа-1 (HO-1) [4, 5]. Антиоксидантната активност на HO произтича както от елиминирането на прооксидантния хем, така и от биологичните дейности на неговите продукти. Биливердин и неговият метаболит чрез биливердин редуктаза, билирубин, ефективно инхибират LDL окисляването [6, 7]. Свободното желязо регулира синтеза на феритин чрез реагиращ на желязо елемент [8]. Доказано е, че феритинът има цитопротективен ефект срещу окислителни наранявания [9]. Въглеродният оксид (CO) модулира активността на разтворим гуанилат синтетаза като азотен оксид [10] и р38 митоген-активирана киназна активност [11].
Натрупващите се данни показват, че окисленият LDL (oxLDL) играе важна роля по време на ранните фази на атерогенезата чрез нейните възпалителни свойства [5]. Наскоро съобщихме, че HO-1 е забележително индуциран от леко oxLDL както в ендотелните клетки, така и в гладкомускулните клетки [12]. Експресията на HO-1 също така силно реагира на окислени биоактивни окислени фосфолипиди, съществуващи в LDL [12]. В допълнение, използвайки кокултури на артериалната стена, установихме, че HO-1 инхибира oxLDL-зависимия хемотаксис на моноцитите чрез своите продукти билирубин и биливердин [12]. След това извършихме in vivo изследвания, за да изследваме ролята на HO-1 за развитието на атеросклероза. HO-1 е силно изразена в атеросклеротична лезия при мишки C57BL/6J, апоЕ-нокаут и LDL-рецептор-нокаут [13]. Когато модулираме експресията на HO при мишки с LDL-рецептори с високо съдържание на мазнини, инхибирането на HO значително води до прогресия на образуването на атеросклеротични лезии в сравнение с мишките, при които HO е индуциран [13]. Тези резултати ни водят до хипотеза на защитните роли на HO-1 за атерогенезата.
Смята се, че липопротеините с висока плътност (HDL) работят за антиатерогенезата. Тези антиатерогенни свойства са обяснени с обратен транспорт на холестерола от клетките до черния дроб [14]. Предишни проучвания обаче разкриват, че самият HDL работи като антиоксидант за минимално окислени липопротеини с ниска плътност [15] и че параоксоназата и аполипопротеинът AI в HDL играят важна роля като антиоксиданти [16, 17]. Съобщава се обаче, че окислителната модификация на HDL губи ефекта, за да стимулира изтичането на холестерол от пенестите клетки [18] и че окисленият HDL активира тромбоцитите, подобни на окисления LDL [19].
За по-нататъшно укрепване на идеята, че HO-1 функционира като противовъзпалителен ензим в артериалната стена и че HO-1 проявява антиоксидантно действие върху плазмените липопротеини, анализирахме едногодишни HO-1-нокаутиращи мишки, отглеждани на стандартна диета с чау . Изследвания, използващи HO-1 нокаутиращи мишки [4, 20, 21] разкриха, че (i) HO-1-хомозиготен нокаут (HO-
) мишките развиват анемия с натрупване на желязо в черния дроб и бъбреците, (ii) култивираните НО- ембрионални фибробласти произвеждат високи свободни радикали, когато са изложени на водородни пероксиди, паракват или кадмиев хлорид, (iii) НОМ-мишките са уязвими към смъртност, когато са предизвикани с ендотоксин и (ix) експресията на HO-1 гарантира оцеляване на сърдечния ксенотрансплантат.
В това проучване изследвахме артериални стени и плазмени липопротеини на мъжки HO-1-нокаутиращи мишки на възраст между 1 и 1,5 години, отглеждани на стандартна диета с чау. НО-1 нокаутиращите мишки са имали тежка инфилтрация на мононуклеарни клетки в тяхната възходяща аортна стена и коронарни артерии и малка атеросклеротична лезия в аортния синус. При нокаутиращи мишки HO-1 HDL изглежда се окислява. Освен това, съставът на аполипопротеините AI и AII в HDL се променя. Тези резултати показват HDL окисляване при HO-1-нокаутиращи мишки. В допълнение, нокаутиращите мишки HO-1 показват по-ниско ниво на параоксоназа в плазмата и по-високо ниво на липиден пероксид, което предполага, че липсата на HO-1 е довела до окисление на плазмените липопротеини и активиране на възпалителни реакции в артериалната стена.
2. Материали и методи
2.1. Реактиви
Използваните реагенти са получени от Sigma, освен ако не е посочено друго.
2.2. Работа с животни и процедури
Всички експерименти с животни са проведени в съответствие с насоките на UCLA и Комитета за изследвания на животните в Медицинския университет Фукушима. Генерирането на мишки, съдържащи целенасочено разрушаване на гена HO-1, беше извършено, както беше описано по-горе [4]. Мишки с дефицит на HO-1 са генерирани със смесен генетичен фон C57BL/6J и 129/sv. C57BL/6J мишки за обратен кръст бяха закупени от лабораторията Jackson (Bar Harbor, ME). Мишките бяха хранени със стандартна диета с гризачи, съдържаща 4% (тегло/тегло) мазнини и -1 cm -1. 1 единица параоксоназна активност се определя като 1 nmol 4-нитрофенол, образуван за минута при горните условия на анализ [27]. За пречистени стандартни разтвори на параоксоназа се изолират изоформи на параоксоназа, както е описано по-горе [27].
2.7. Други процедури
Плазменото липидно пероксидиране като малондиалдехид беше измерено с комплект от Oxis (Portland, OR). Всички стойности са изразени като средни стойности ± SD. Значителна разлика се определя чрез еднопосочен ANOVA анализ с последващ тест на Fisher.
се счита за значимо.
3. Резултати и дискусия
3.1. Аортит, коронарен артериит и атеросклероза при HO-1-нокаут мишки
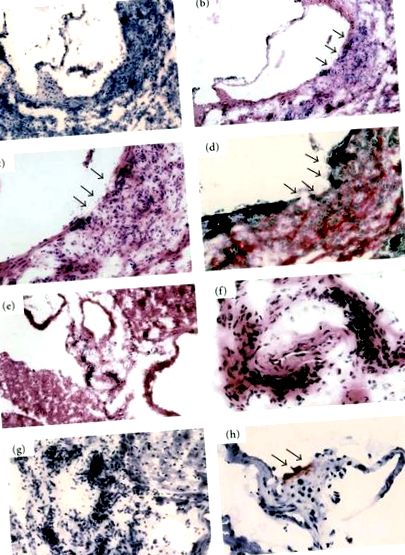
За да изясним ефекта на HO-1 върху съдовата система, ние изследвахме мъжки HO-1-нокаутиращи мишки на възраст над 1 година, които бяха отглеждани на стандартна диета с гризачи. Тези мишки са имали смесен генетичен произход от 129Sv и C57BL/6J. HO-мишките са имали тежка инфилтрация на мононуклеарни клетки в тяхната възходяща аортна стена (100%) (Фигури 1 (а) и 1 (б)). Тази инфилтрация беше трансмурална и еластичната ламинална структура на интимата беше силно разрушена (Фигури 1 (в) и 1 (г)). Тази мононуклеарна клетъчна инфилтрация се наблюдава не само в аортата, но и в коронарните артерии (Фигури 1 (д), 1 (е) и 1 (ж)). Оцветяването с маслено червено O разкрива малка атеросклеротична лезия в аортния синус на HO-мишки, дори при стандартна чау диета, въпреки че мишки от див тип не развиват такива лезии (Фигура 1 (h)). Тези възпалителни промени на артериите се наблюдават и при хетерозиготни мишки; това обаче беше по-рядко. Не е ясно дали тези артериални възпаления при мишки с дефицит на HO-1 са отговор срещу микроорганизми или автоимунен отговор [28].
3.2. Променени свойства на HDL в HO-1-нокаут мишки
Таблица 1 показва телесно тегло и плазмени нива на липиди на анализирани HO-1 нокаутиращи мишки. HO-мишките бяха значително по-леки от HO-1 див тип (HO-
- Урея и бъбречна функция в прозренията на 21 век от Американското общество на нокаутиращите мишки
- Уртикарен васкулит, предизвикан от извънборсови хапчета за отслабване, доклад за случая на Световната алергична организация
- Васкулит - д-р
- Влиянието на диетите с високо съдържание на мазнини върху физиологичните промени при еутиреоидни и тиреоидни плъхове
- Какво трябва да знае всяка жена, за да постигне желаните си цели в състава на тялото