Субекти
Резюме
Епидемиологичните проучвания показват връзка между затлъстяването на майката и неблагоприятните неврологични резултати при потомството. Нашата цел беше да сравним глобалния протеомичен портрет в мозъчната кора между мишки, родени от майки на високомаслена или контролна диета, които самите са били хранени с високомаслена или контролна диета. Мъжки мишки, родени от язовири, хранени с контролна (С) или богата на мазнини (Н) диета 4 седмици преди зачеването и по време на бременността и лактацията са били назначени на диета С или Н при отбиване. Мишките бяха убити на 19 седмици и техните мозъчни кортикали бяха анализирани с помощта на двумерна методология на течна хроматография-мас спектрометрия. Общо са идентифицирани 6 695 протеина (q
Въведение
Жените в репродуктивна възраст не са освободени от епидемията от затлъстяване. 1 Тъй като теорията „Barker“ възниква преди 22 години, 2 натрупващи се доказателства потвърждават, че адаптациите на плода към вътрешноматочна среда с нарушена хранителна стойност (например недохранване, затлъстяване) могат да доведат до неблагоприятни последици за здравето в последващ живот, процес, определен като програмиране на развитието. 3, 4 Епидемиологичните проучвания са установили връзка между затлъстяването на майката и невропатологичните характеристики на потомството като когнитивни проблеми в детска възраст, хранителни разстройства в юношеска възраст и психотични епизоди в зряла възраст. 5
Затлъстяването, предизвикано от диета с високо съдържание на мазнини, се използва широко като in vivo модел за изследване на ефектите от затлъстяването върху различни системи от органи. 6 Доколкото ни е известно, глобалната тъканна протеомика досега не се е прилагала за оценка на ефектите от затлъстяването на майката върху мозъчните области на възрастното потомство. Нашата цел беше да разгледаме и сравним ендофенотипния портрет на мозъчните кортикети на възрастни мишки от мъжки пол, чиито майки по време на бременност/кърмене и себе си след отбиването са били изложени на диета с високо съдържание на мазнини или контрол.
Материали и методи
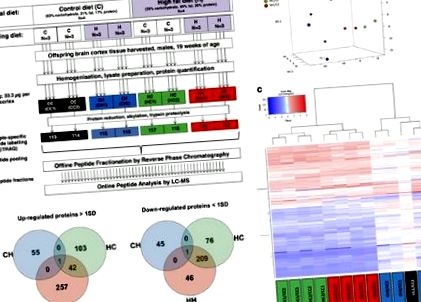
Доказаните язовири C57b1/6 бяха хранени с контрола (C) (21% kcal мазнини, 17% kcal протеин, 63% kcal въглехидрати, н= 4) или диета с високо съдържание на мазнини (H) чау (45% kcal мазнини, 20% kcal протеин, 35% kcal въглехидрати; Special Diet Services, Великобритания, н= 4) 4 седмици преди зачеването и по време на бременност и кърмене. При отбиването, 4-седмично мъжко потомство (н= 24) са определени за C или H, генерирайки четири групи (CC, CH, HC, HH, н= 6 за всеки) (Фигура 1а).
(а) Протеомичен работен процес и схема за етикетиране, (б) Анализ на основните компоненти на съотношенията iTRAQ на всички анализирани протеини в мозъчната кора, показващ групиране на мишки въз основа на диетата на майката, а не текущата им диета, т.е.сини точки (CH/CC), групирани отделно от червеното (HH/CC) и зелени точки (HC/CC) по главния компонент 1. Разделянето на пробата по главния компонент 2 е резултат от разделяне на всяка проба от различен контрол, т.е. CC1 (точки отгоре) или CC2 (точки отдолу). (° С) Диаграми на Venn на често регулирани нагоре и надолу протеини в мишки CH, HC и HH в сравнение с контролите (CC). (д) Йерархичен клъстерен анализ на модулирани протеини: HC и HH групите имат подобен протеомичен портрет, който е различен от този на CH мишки.
Деветнадесет седмични мишки бяха анестезирани, перфузирани интракардиално с буфериран с фосфат физиологичен разтвор, извадени мозъци, дисектирани за фронтопариетални корти и замразени. Експерименталните процедури бяха одобрени от институционалния комитет за грижи и употреба на животните в университета в Саутхемптън и Министерството на вътрешните работи. 7
Необработените сурови файлове бяха предоставени на Proteome Discoverer 1.4 за търсене на примамка със SequestHT за триптични пептиди, което позволява две пропуснати разцепвания, толеранс 10 ppm, минимална дължина на пептида 6 и 2 максимални променливи (1 еднакви) модификации: окисляване (M), дезаминиране ( N, Q), фосфорилиране (S, T, Y), iTRAQ 8plex (Y). Methythio (C) и iTRAQ (K и N-teminus) бяха определени като фиксирани модификации. Допустимите отклонения на масата на йони на фрагменти са 0,02 Da и 0,5 Da за индуцираните от сблъсък по-високи енергийни спектри и дисоциационните спектри, предизвикани от сблъсък, съответно. Честотата на фалшивите открития (FDR) е оценена с Percolator на at 0,01 и валидиране е зададено на q-стойност
Резултати
Протеомният анализ доведе до идентифициране на 18 543 пептида, заместващи до 6695 уникални протеина (допълнителна таблица 1). Средната вариация на коефициента за iTRAQ съотношенията на всички протеини, профилирани в биологични репликати, беше определена съответно на 16%, 12% и 13% за групите СН, НС и НН. Стойности на вариации на аналогични коефициенти между биологични повторения са докладвани от авторите, използвайки подобни методологии на протеомиката. 8, 9 Анализът на основните компоненти на анализирания протеом показва групиране на мишки, перинатално изложени на диета с високо съдържание на мазнини, независимо от настоящата им диета (Фигура 1b). Общо 662 протеина (допълнителна таблица 2) са намерени модулирани в поне една от трите групи. Тяхното йерархично групиране разкрива, че мозъчната кора на мишки, чиито майки са били на диета с високо съдържание на мазнини, независимо от собствената им диета, споделят много подобен ендофенотипен портрет, който е различен от този на мишки, чиито майки са били на контролна диета (Фигура 1в).
От модулираните протеини 251 са често срещани в групите HC и HH (Фигура 1г и допълнителна таблица 3). Анализът на MetaCore показа, че отговорът на хипоксия/оксидативен стрес (FDR коригиран P-стойност = 1.45E-02) и пътя на стреса на апоптоза/ендоплазмен ретикулум (FDR коригиран P-стойност = 3.53E-02) са били значително свръхпредставени процеси само в мозъчните кори на мишки, перинатално изложени на диета с високо съдържание на мазнини (Фигура 2). Индукцията на апоптоза от оксидативен стрес беше кръстосана с BiNGO (допълнителна фигура 1). За разлика от тях тези функции не са значително обогатени при CH мишки.
Обработвайте мрежов анализ с помощта на MetaCore: значително обогатяване за (а) отговор на хипоксия/оксидативен стрес (коригиран FDR P-стойност = 3,53E-02) и (б) апоптоза/път на стреса на ендоплазмен ретикулум (коригиран FDR P-стойност = 1,45Е-02) в мозъчната кора на възрастното потомство в резултат на диета с високо съдържание на мазнини при майките. Анализираните протеини се обозначават с кръг (червено = повишено регулиране, синьо = понижено регулиране).
Дискусия
Нашето изследване представлява най-изчерпателното протеомично профилиране на мозъчната кора на мишката до момента. Резултатите предоставят нови доказателства за връзка между диетата с високо съдържание на мазнини при майката и ендофенотипичните промени в мозъчната кора на възрастното потомство. Моделите на епигенетично метилиране на ДНК могат да бъдат възможен механизъм, чрез който е установено това „хранително отпечатване“ 10, но дешифрирането на това е извън обхвата на това проучване.
В силико интерпретация на протеини, често модулирани в мозъчната кора на мишки, перинатално изложени на диета с високо съдържание на мазнини, разкрива значително свръхпредставяне на отговор на хипоксия/оксидативен стрес и апоптоза/ендоплазмен стрес на ретикулума (Фигура 2), и двете предполагащи прогресия към невродегенеративен фенотип.
Анализираните ензими, свързани с отговора на хипоксия/оксидативен стрес, са пероксиредоксин-1, пероксиредоксин-2, пероксиредоксин-4, супероксиддисмутаза (Mn) митохондрии, глутатион пероксидаза 1, глутатион S-трансфераза омега 1, тиоредоксин редуктаза 1 оксидаза. Намаляването на регулацията на тези протеини за отстраняване на реактивни кислородни видове (ROS) може да предполага повишен оксидативен стрес в мозъчната кора на възрастни мишки в резултат на затлъстяването на майките.
По-рано беше съобщено, че диетата с високо съдържание на мазнини при майките води до повишен оксидативен стрес в мозъчните области на възрастното потомство чрез измерване на нивата на 3-нитротирозин и протеиново карбоксилиране, осигурявайки по този начин индиректен знак за оксидативен стрес. 11 Окислителният метаболизъм на мастните киселини обикновено генерира ROS, които причиняват ковалентна модификация на вътреклетъчни нуклеофили като митохондриална ДНК и протеини, включително тези, участващи в редокс обработката. 12 Натрупването на продукти на окислително увреждане в цитоплазмата на невроните предшества отлагането на Ар при церебрална амилоидна ангиопатия и болестта на Алцхаймер. 13 ROS-медиираната ковалентна модификация на Ар, наред с други протеини, може също да има роля за намаления му клирънс. 14.
Глобалната церебрална исхемия/реперфузия (I/R) е полезен модел за ефектите на повишения оксидативен стрес в мозъчните региони. I/R води до повишено производство на свободни радикали и оксидативен стрес, който от своя страна може да причини невронална апоптоза. 15 Чрез I/R модела е установено, че чрез намаляване на оксидативния стрес може да се предотврати увреждането на невроните в мозъка. 16 Тъй като невроналната апоптоза е необратим процес, облекчаването на оксидативния стрес може да намали риска от невродегенеративно заболяване. Неотдавнашно проучване показа невропротективните ефекти на β-мирцен, естествен продукт, получен от мащерка и магданоз, при мишки след I/R. 17 В това проучване лечението с β-мирцен, едновременно с индукция на I/R намалява оксидативния стрес и предотвратява невродегенерацията чрез индуциране на ROS-ензимни ензими като глутатион пероксидаза и супероксид дисмутаза.
Друго проучване показа, че предварителната обработка на швейцарски мишки-албиноси със S-алил цистеин, фитохимикал в чесъна, предотвратява когнитивното и поведенческо увреждане на предизвиканата от стрептозотоцин експериментална деменция. Този ефект се дължи на индуцирането на ROS-чистящи протеини, включително глутатион пероксидаза. 18 Подобни тенденции се наблюдават и при получените от плодове полифеноли. Въпреки тяхната ниска системна бионаличност и бавна реактивност при директното секвестиране на ROS видове, полифенолите задействат клетъчни и молекулярни механизми, отчасти чрез индуциране на ROS-ензимни ензими, които водят до намалено невронално окислително увреждане и когнитивен спад. 19 Дени Джоузеф и др. 20 подчерта ефективността на комбинирането на рибено масло и кверцетин, съединение, намерено в червения лук, за намаляване на оксидативния стрес в мозъка на плъхове и по този начин защита срещу невродегенерация.
Ограниченията на изследването включват невалидираните резултати от анализа на масова спектрометрия, използващи алтернативни подходи (например имунохистохимия), липсата на функционални анализи и оценка на състоянието на окисление на протеините. Те представляват цели за проспективни проучвания. В заключение, нашето проучване демонстрира, че затлъстяването при майките води до различни протеомични портрети, което предполага неврогенеративен фенотип в мозъчната кора на възрастното поколение.
Препратки
Flegal KM, Carroll MD, Ogden CL, Curtin LR. Разпространение и тенденции в затлъстяването сред възрастните в САЩ, 1999–2008. ДЖАМА 2010; 303: 235–241.
Barker DJ. Феталният произход на болестите в напреднала възраст. Eur J Clin Nutr 1992; 46: S3 – S9.
Iozzo P, Holmes M, Schmidt MV, Cirulli F, Guzzardi MA, Berry A и др. РАЗВИТИЕ НА ЗДРАВОСЛОВНОТО И ЗДРАВОСЛОВНОТО СТАРЕНЕ: ролята на майчиното затлъстяване - въведение в DORIAN. Факти за обеса 2014; 7: 130–151.
Gluckman PD, Hanson MA, Cooper C. Торнбург KL. Ефект на вътреутробните и ранните условия на здравето и здравето на възрастните. N Engl J Med 2008; 359: 61–73.
Van Lieshout RJ, Taylor VH, Boyle MH. Предебременност и затлъстяване при бременност и невроразвитие при потомството: систематичен преглед. Obes Rev 2011; 12: e548 – e559.
Zambrano E, Nathanielsz PW. Механизми, чрез които затлъстяването при майки програмира потомство за затлъстяване: доказателства от проучвания върху животни. Nutr Rev 2013; 71: S42 – S54.
Хоукс Калифорния, Джентълмен SM, Никол JA, Караре RO. Пренаталната диета с високо съдържание на мазнини променя мозъчно-съдовата система и клирънса на β-амилоид при възрастни потомци. J Pathol 2014; 235: 619–631.
Papachristou EK, Roumeliotis TI, Chrysagi A, Trigoni C, Charvalos E, Townsend PA и др. Протеотичното изследване на пушката с човешка мазка на шийката на матката ThinPrep с помощта на iTRAQ масово маркиране и 2D LC-FT-Orbitrap-MS: откриване на човешки папиломен вирус на ниво протеин. J Proteome Res 2013; 12: 2078–2089.
Al-Daghri NM, Al-Attas OS, Johnston HE, Singhania A, Alokail MS, Alkharfy KM и др. Цялостната серумна 3D LC-nESI-FTMS количествена протеомика разкрива сексуален диморфизъм в Milieu Intérieur на възрастни с наднормено тегло и затлъстяване. J Proteome Res 2014; 13: 5094–5105.
Soubry A, Murphy SK, Wang F, Huang Z, Vidal AC, Fuemmeler BF и др. Новородените от родители със затлъстяване са променили моделите на метилиране на ДНК при отпечатани гени. Int J Obes (Лондон) 2013. Електронна кръчма преди печат 25 октомври 2013 г. doi: 10.1038/ijo.2013.193.
Бял CL, Pistell PJ, Purpera MN, Gupta S, Fernandez-Kim SO, Hise TL и др. Ефекти от диетата с високо съдържание на мазнини върху ефективността на лабиринта на Морис, оксидативен стрес и възпаление при плъхове: принос на майчината диета. Neurobiol Dis 2009; 35: 3–13.
Jacobs AT, Marnett LJ. Системен анализ на модификация на протеини и клетъчни реакции, индуцирани от електрофилен стрес. Acc Chem Res 2010; 43: 673–683.
Carare RO, Hawkes CA, Jeffrey M, Kalaria RN, Weller RO. Преглед: церебрална амилоидна ангиопатия, прионна ангиопатия, CADASIL и спектърът на ангиопатии на неуспех при елиминиране на протеини (PEFA) при невродегенеративно заболяване с фокус върху терапията. Neuropathol Appl Neurobiol 2013; 39: 593–611.
Butterfield DA, Bader Lange ML, Sultana R. Участие на продукта на липидната пероксидация, HNE, в патогенезата и прогресията на болестта на Алцхаймер. Biochim Biophys Acta 2010; 1801: 924–929.
Heo JW, Han SW, Lee SK. Свободните радикали като задействащи образуването на мозъчен оток след инсулт. Безплатно Radic Biol Med 2005; 39: 51–70.
Oztanir MN, Ciftci O, Cetin A, Aladag MA. Хесперидин намалява окислителното и невронално увреждане, причинено от глобална церебрална исхемия/реперфузия в модел на мишка C57BL/J6. Neurol Sci 2014; 35: 1393–1399.
Ciftci O, Oztanir MN, Cetin A. Невропротективни ефекти на β-мирцен след глобална церебрална исхемия/реперфузионно медиирано окислително и невронално увреждане при мишка C57BL/J6. Neurochem Res 2014; 39: 1717–1723.
Javed H, Khan MM, Khan A, Vaibhav K, Ahmad A, Khuwaja G и др. S-алил цистеин отслабва свързаното с оксидативния стрес когнитивно увреждане и невродегенерация в миши модел на стрептозотоцин-индуцирана експериментална деменция от типа на Алцхаймер. Brain Res 2011; 1389: 133–142.
Сингх М, Арсено М, Сандерсън Т, Мърти V, Рамасами С. Предизвикателства за изследване на полифеноли от храни при болестта на Алцхаймер: бионаличност, метаболизъм и клетъчни и молекулярни механизми. J Agric Food Chem 2008; 56: 4855–4873.
Дени Джоузеф КМ, Муралидхара. Подобрен невропротективен ефект на рибено масло в комбинация с кверцетин срещу индуциран от 3-нитропропионова киселина оксидативен стрес в мозъка на плъхове. Prog Neuropsychopharmacol Biol Психиатрия 2013; 40: 83–92.
Благодарности
Това проучване е финансирано от BBSRC, Rosetrees Trust и Wessex Cancer Trust and Medical Research, Великобритания. Длъжни сме на г-н Роджър Олсоп, г-н Дерек Коутс и „Надежда за Гернси“ за техния ентусиазъм, набиране на средства и визия при създаването на протеомичната инфраструктура в Университета в Саутхемптън - Науки за рака/Институт за науките за живота. Благодарим на д-р X Zhang и д-р D Ankrett за използването на високоефективната система за течна хроматография. Също така бихме искали да благодарим на екипа на PRIDE за тяхната подкрепа.
Информация за автора
S D Garbis и R O Carare: SDG и ROC съвместно ръководиха изследването и са съ-старши автори.
Принадлежности
Център за протеомични изследвания, Институт за науките за живота, Университет в Саутхемптън, Саутхемптън, Великобритания
A Manousopoulou, H E Johnston & S D Garbis
Клинични и експериментални науки, Университет в Саутхемптън, Саутхемптън, Великобритания
A Manousopoulou, J Woo, C H Woelk, A Singhania, C Hawkes, S D Garbis & R O Carare
Науки за рака, Университет в Саутхемптън, Саутхемптън, Великобритания
H E Johnston & S D Garbis
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Автори-кореспонденти
Кореспонденция на S D Garbis или R O Carare.
Етични декларации
Конкуриращи се интереси
Авторите не декларират конфликт на интереси.
Допълнителна информация
Допълнителната информация придружава този документ на уебсайта на International Journal of Obesity
- 5 лесни рецепти за сос за потапяне за вашите кнедли Сериозни ястия
- 5 храни за повишаване на енергийната ви хранителна мрежа Здравословни ястия Рецепти, идеи и хранителни новини Хранителна мрежа
- Може ли вашата диета за бременност да повлияе на бъдещата здравна майка на вашето бебе; Скъпа
- 16 замразени вечери, всъщност ще се почувствате добре, когато обслужвате децата си работеща майка
- 5 зрънца, които не поставяте в кошницата си (но трябва) Хранителна мрежа Здравословни ястия Рецепти, идеи,