Мария Калехо
1 Катедра по фармакология и токсикология, Медицински факултет, Universidad Complutense de Madrid, 28040 Мадрид, Испания; [email protected]
2 CIBER Enfermedades Respiratorias, Ciberes, 28029 Мадрид, Испания; tac.cinilc@arebrabj
3 Instituto de Investigación Sanitaria Gregorio Marañón (IISGM), 28007 Мадрид, Испания
Джоан Алберт Барбера
2 CIBER Enfermedades Respiratorias, Ciberes, 28029 Мадрид, Испания; tac.cinilc@arebrabj
4 Катедра по белодробна медицина, Болница Clínic-Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS), Universitat de Barcelona, 08036 Барселона, Испания
Хуан Дуарте
5 Катедра по фармакология, Фармацевтично училище, Университет де Гранада, 18071 Гранада, Испания; se.rgu@etraudmj
6 CIBER Enfermedades Cardiovasculares, CiberCV, 28029 Мадрид, Испания
7 Instituto de Investigación Biosanitaria (ibs.Granada), 18012 Гранада, Испания
8 Centro de Investigaciones Biomédicas (CIBM), 18016 Гранада, Испания
Франсиско Перес-Вискаино
1 Катедра по фармакология и токсикология, Медицински факултет, Universidad Complutense de Madrid, 28040 Мадрид, Испания; [email protected]
2 CIBER Enfermedades Respiratorias, Ciberes, 28029 Мадрид, Испания; tac.cinilc@arebrabj
3 Instituto de Investigación Sanitaria Gregorio Marañón (IISGM), 28007 Мадрид, Испания
Резюме
1. Белодробна хипертония
1.1. Етиология
1.2. Патофизиология
1.3. Настоящи фармакологични терапии
През последните десетилетия интензивните изследвания на клетъчните и молекулярните механизми и сигналните пътища осигуриха по-добро разбиране на патофизиологията на БАХ и следователно идентифициране на различни фармакологични лечения. За съжаление окончателно излекуване за БАХ не съществува. Понастоящем петте класа терапии, одобрени за PAH, са насочени към влизането на Ca 2+ и трите основни дисфункционални ендотелни пътища: NO, простациклин и ендотелин-1 пътища [27,28]. Инхибиторите на цикличната нуклеотидна фосфодиестераза тип 5 (PDE-5), силденафил и тадалафил, усилват действието на ендогенния NO и стимулират вазодилатацията [5,27,28]. Разтворимата гуанилат циклаза (sGC) също действа в NO сигналния път, катализиращ трансформацията на GTP в cGMP. SGC стимулаторът риоцигуат насърчава синтеза на cGMP благоприятства вазодилатацията и инхибира клетъчната пролиферация. Действието на riociguat е независимо от наличието на NO. Наличните терапии, свързани с простациклин, включват синтетични (епопростенол), аналози на простациклин (трепростинил и илопрост) и агонист на простациклиновия рецептор селексипаг [27,28]. Ендотелин-1 рецепторните антагонисти (ERA) включват бозентан, мацитанан и амбрисентан [5,27,28].
Въпреки одобрените понастоящем лекарства като монотерапия показват благоприятно въздействие върху клиничните, функционалните и хемодинамичните резултати, често се наблюдава прогресия на заболяването. На 5-ия Световен симпозиум на PH и въз основа на високото ниво на доказателства, събрани от множество рандомизирани, контролирани проучвания, беше предложено използването на последователна комбинирана терапия, поне при пациенти с ПАХ с неадекватен отговор на монотерапия и възможна терапия от първа линия в пациенти с напреднало заболяване (Нюйоркска сърдечна асоциация функционален клас III/IV). Освен това, за да се постигне по-голям терапевтичен отговор, в момента се препоръчва начална комбинирана терапия по време на диагностицирането. Нещо повече, режимите на тройна комбинация също се разглеждат при тежка БАХ, когато двойната терапия е неуспешна [27,29].
1.4. Нефармакологични терапии
В рандомизирани контролирани проучвания упражняващата терапия подобрява толерантността към упражненията, функционалния капацитет и качеството на живот, с положително въздействие върху социалните, емоционалните и психологическите аспекти [3,30]. Поради това се препоръчват контролирани програми за рехабилитация на упражнения [3]. Освен това се препоръчва пациентите да избягват прекомерно физическо натоварване, което води до тревожни симптоми, като например поради лош обмен на газ или неправилна вентилация. Освен това програмите за упражнения не са добре установени и представляват няколко ограничения, основани на пропуските в знанията за оптималния метод, интензивност и продължителност на обучението [31].
Диетичната модификация е една от първите стъпки в лечението на сърдечно-съдови заболявания. Рутинното лечение на системна артериална хипертония включва диетични интервенции за всички пациенти, включително ограничаване на солта и алкохола; увеличена консумация на зеленчуци, пресни плодове, пълнозърнести храни, разтворими фибри, риба, ядки и зехтин; ниска консумация на червено месо; и консумация на нискомаслени млечни продукти [32]. Въпреки това, Европейското кардиологично общество (ESC) и Насоките на Европейското респираторно общество (ERS) [3] не са установили конкретни препоръки за хранителни навици или хранителни добавки за PAH.
Интересното е, че наскоро се съобщава за връзки между хранителни фактори и PAH както при епидемиологични проучвания при хора, така и при животински модели. Напоследък се съобщава, че многоцелева хранителна интервенция с допълнителни протеини, левцин, рибено масло и олигозахариди може да бъде нова стратегия за предотвратяване на патофизиологичните промени като хипертрофия на сърдечните и скелетните мускули при PAH [33].
Тук се фокусираме върху научните доказателства за това как дефицитът на желязо и витамини С и D, както и други диетични компоненти като флавоноиди могат да повлияят на прогресията на БАХ. И накрая, ролята на чревната микробиота и нейното взаимодействие с диетата и имунната система гостоприемник се появява при множество сърдечно-съдови и дихателни заболявания, включително ПАХ. Други диетични фактори като n-3 полиненаситени мастни киселини (PUFAs), витамин Е, мелатонин и коензим Q10 теоретично могат да имат ефект върху PAH, но няма експериментални или клинични доказателства в негова подкрепа и те не са обсъдени тук.
2. Диетични компоненти с въздействие върху PAH
2.1. Витамин Ц
Витамин С, известен още като аскорбинова киселина, е водоразтворим витамин, съдържащ се в няколко плода и зеленчука. Необходим е за активността на няколко ензима, участващи в възстановяването на тъканите, важни за функцията на имунната система и действащи като антиоксидант. Силният дефицит на витамин С води до скорбут, причинявайки обща слабост, анемия, кръвоизливи по кожата, заболявания на венците и загуба на зъби [34,35].
Много проучвания показват, че оксидативният стрес участва в сърдечно-съдовите заболявания [36]. Инактивацията на азотен оксид от реактивни кислородни видове е ключово събитие при ендотелната дисфункция, свързана с хипертония и атеросклероза и други съдови патологии [37]. От друга страна, окисляването на LDL в ендотелната стена прави тези частици по-атерогенни и им позволява да се натрупват в артериалните стени [36]. Това доведе до широкото използване на антиоксиданти, включително витамин С, за да забави прогресията на атеросклерозата. Мета-анализът на обобщените данни от рандомизирани контролирани проучвания стига до заключението, че добавянето на антиоксидантни витамини няма ефект върху честотата на големи сърдечно-съдови събития, инфаркт на миокарда, инсулт, обща смърт и сърдечна смърт [38].
Няколко доклада показват, че белодробната хипертония е усложнение на скорбут [39,40,41,42]. Повишеното mPAP беше обратимо след приложението на аскорбат. Предложени са два възможни механизма за ангажиране на дефицита на витамин С в PAH [41]. Първо, витамин С увеличава наличността на ендотелен NO, който има съдоразширяващ и антипролиферативен капацитет [43]. Второ, дефицитът на витамин С може да дезактивира пролил хидроксилазите, клетъчните кислородни сензори, отделяйки индуцируемия от хипоксия фактор (HIF) от контрола на кислорода [44]. Неконтролираната HIF активност може да доведе до активиране на белодробни хипертонични механизми [45].
Дали умереният дефицит на витамин С, а не клиничният скорбут, който е рядък в западните общества, играе роля при БАХ, не е известно. Освен това ефектът на добавките с витамин С върху пациентите с БАХ все още не е добре адресиран и има само предварителни експериментални доказателства за неговата ефективност. Например, проучване при пилета-бройлери показа, че витамин С намалява честотата на PAH и свързаната с него мускуларизация на белодробните артериоли [46].
2.2. Витамин D
Няма ясен консенсус относно определението за дефицит на витамин D; оптималните нива и хранителните изисквания са несигурни [52,53]. Въпреки това, дори при използване на консервативни прагове, в днешно време има пандемия на дефицит на витамин D [54]. Основните причини за ниските 25 (OH) D3 нива са неадекватно излагане на слънце и/или намален хранителен прием [54].
Класически дефицитът на витамин D е свързан с костни заболявания. Понастоящем поради VDR се откриват много тъкани, като имунни и сърдечно-съдови клетки, дефицитът на витамин D също е свързан с инфекции, рак и респираторни и сърдечно-съдови заболявания [53,55,56]. Всъщност дефицитът на витамин D е свързан с повишена смъртност от всички причини и сърдечно-съдова смъртност [57,58]. Откриването на VDR в много тъкани, които не участват в калциевата и фосфорната хомеостаза, доведе до идентифициране на голямо разнообразие от функции, медиирани от VDR, като клетъчна пролиферация и диференциация, имуномодулация и вътреклетъчен метаболизъм, наред с други [48].
В контекста на PAH има някои основни и клинични доказателства, които предполагат роля на витамин D в патофизиологията на заболяването. VDR е идентифициран в съдовите клетки, включително ендотелните и гладкомускулните клетки. Той участва в многобройни процеси с потенциално значение при сърдечно-съдови заболявания, като клетъчна пролиферация, диференциация и апоптоза; клетъчна адхезия; оксидативен стрес; ангиогенеза; и имуномодулираща и противовъзпалителна активност [53]. Следователно се предполага, че нивата на витамин D могат да повлияят на развитието на БАУ.
За да се изясни дали нивата на витамин D могат да бъдат включени в прогресията на PAH, Tanaka et al. лекувани плъхове PAH с диета, съдържаща 10 000 UI/kg холекалциферол [59]. По-специално, в това проучване те откриха, че добавянето на витамин D при плъхове PAH подобрява преживяемостта и отслабва някои типични характеристики на PAH като ремоделиране на дясната камера, оценено чрез индекса на Фултън (съотношението на теглото на дясната камера към лявата камера плюс теглото на преградата) и медиалната дебелина на мускулните белодробни артерии. Въпреки тези ползи от витамин D, лечението с холекалциферол не намалява налягането в белодробната артерия [59]. Нещо повече, при in vitro настройка, лечението с калцитриол инхибира индуцираната от хипоксия пролиферация и миграция в ендотелни клетки на белодробна артерия на плъхове (PAEC) чрез miR-204/TGFβ/Smad сигнален път. По-конкретно, калцитриолът потиска експресията на Tgfbr2, α-SMA и Smad7 и индуцира експресия на miR-204, p21 и Smad2 [60]. В същото проучване са открити подобни резултати при in vivo модел на плъхове. Забележително е, че интраперитонеалното приложение на калцитриол (20 mg/kg) отчасти обръща покачването на mPAP и индекса на Фултън, предизвикано от три седмици хипоксия [60].
Диетата е критичен регулатор на състава и функцията на микробиотата [131]. Многобройни проучвания са фокусирани върху ефектите на макронутриентите (мазнини, въглехидрати и протеини) върху чревния микробиом. Други диетични компоненти като разтворими или неразтворими фибри също могат да бъдат важни [132, 133]. Освен това няколко хранителни компонента са субстрати за бактериални ензими. Тези ензимни процеси водят до производството на други странични продукти, които могат да бъдат абсорбирани в червата. Важно е, че SCFAs, особено маслена и оцетна киселина, които произхождат главно от бактериалната ферментация на фибри, се считат за насърчаващи сърдечно-съдовото здраве. За разлика от тях, триметиламин-N-оксидът (TMAO), метаболит, произведен от чревната микробиота от холин, бетаин и карнитин, които са богати на месо, яйца и риба, е свързан с прекомерен риск от сърдечни заболявания [134].
Освен това се съобщава, че някои диетични компоненти като подсладители, минерали и витамини могат да модифицират микробиотата. Забележително е, че някои от хранителните вещества с въздействие върху прогресията на PAH, както е описано по-горе, като дефицит на желязо и витамин D, както и кверцетин и ресвератрол значително влияят върху чревната микробиота [135, 136, 137]. Следователно, освен гореспоменатите механизми на действие на тези диетични компоненти, промените в чревната микробиота също могат да бъдат отговорни за действията на желязото, витамин D или полифенолите. Напротив, съставът на микробиотата може да повлияе на усвояването на калций, фосфат, желязо и цинк. Освен това, в допълнение към хранителните източници на водоразтворими витамини, микробиотата може да синтезира и някои от тези витамини [132].
3. Заключения
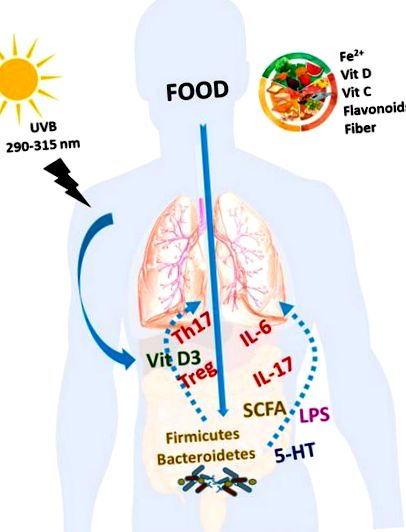
Въздействие на храненето при БАУ. Диетични компоненти като Fe 2+, витамини С и D, флавоноиди и други свързани полифеноли и фибри, както и витамин D, получени от излагането на слънчева светлина, могат да имат положително въздействие върху качеството на живот и прогнозата на пациентите с БАХ. Всеки хранителен фактор може да има свой механизъм на действие. Въпреки това, част от ефектите на тези хранителни вещества могат да бъдат свързани с ефекта им върху имунната система с възстановяване на Т-клетките и цитокините, промени в микробиотата и техните бактериални продукти и бактериална транслокация.
Възможните положителни ефекти на полифенолите кверцетин, ресвератрол и генистеин в PAH остават да бъдат определени в клинични проучвания. На този етап не може да се препоръчва използването на добавки, съдържащи тези полифеноли. Въпреки това, предвид обнадеждаващото въздействие на плодовете и зеленчуците върху сърдечно-съдовото здраве с особено въздействие върху системната хипертония, изглежда разумно да се стимулират пациентите с БАХ да се придържат към диети, богати на тези храни.
Ролята на чревната дисбиоза в патогенезата на БАХ не е твърдо установена. Понастоящем не могат да бъдат установени препоръки, насочени към модифициране на червата или белодробната микробиота. Ако обаче ролята на дисбиозата бъде потвърдена, могат да бъдат приложени няколко интервенции за коригиране или компенсиране на променената микробна екосистема, включително използването на специфични бактериални щамове (пробиотици), фибри и диетични полифеноли (т.е. пребиотици), фекална трансплантация, антибиотици и бета-адренергични антагонисти или заместване на дефицита в специфични SCFA (напр. ацетат).
Принос на автора
F.P.-V. очерта рецензията, M.C. написа проект и J.A.B., J.D. и F.P.-V. преработен и разширен окончателната версия. Всички автори са прочели и са се съгласили с публикуваната версия на ръкописа.
Финансиране
Това проучване беше подкрепено от безвъзмездни средства от Mineco (SAF2016-77222-R и SAF2017-8489-R), със средства от Европейския съюз (Fondo Europeo de Desarrollo Regional FEDER) и Fundación Contra la Hipertensión Pulmonar (грант за съпричастност). M.C. се финансира от Universidad Complutense de Madrid.
Конфликт на интереси
Авторите не декларират конкуриращи се интереси.
- Влияние на храненето върху мозъчната циркулация и когницията при метаболитния синдром
- Влияние на елиминиращите диети върху храненето и растежа при деца с множество хранителни алергии -
- Променена ли е диетата Ви след блокиране на форумите за белодробна хипертония
- Въздействие на затлъстяването върху изпълнението на упражненията и белодробната рехабилитация - DREHER - 2012 -
- Как влияе храненето на нарушенията на съня Преглед на съня