Резюме
Заден план
Коремното затлъстяване при жените е свързано с хиперандрогенемия (HA), но малко проучвания разглеждат възможната връзка между HA и метаболитен синдром (MetS) сред затлъстелите жени. Някои проучвания показват, че инсулиновата резистентност може да причини НА чрез различни механизми. От друга страна се предлага двупосочна връзка между НА и инсулинова резистентност. По този начин имахме за цел да проучим дали заболелите от затлъстяване жени с НА имат по-висок шанс за MetS и неговите компоненти, отколкото тези без HA (контроли), независимо от статуса на поликистозни яйчници (PCOS).
Методи
Това проучване на напречното сечение обхваща 1900 последователни лечения, търсещи болестно затлъстели жени с 0.6 дефинирани НА. Жените с предварително диагностициран СПКЯ и тези с олиго-/ановулация, комбинирани с клиничен или биохимичен хиперандрогенизъм, са определени като имащи СПКЯ. Мулти коригираните асоциации между HA и MetS бяха оценени чрез логистичен регресионен анализ.
Резултати
От 1900 заболели жени със затлъстяване, 1089 (57%), 846 (45%) и 312 (16%) са имали MetS, HA и PCOS, съответно. В сравнение с контролите (без HA), жените с HA са по-млади (34 [1] години срещу 39 [2], стр
Заден план
Синдромът на поликистозните яйчници (СПКЯ) е най-често срещаната женска ендокринопатия, засягаща 8 - 12% от жените в репродуктивна възраст [1] и 10–35% от затлъстелите жени [2–4]. PCOS се свързва с безплодие, хиперандрогенемия, нарушен глюкозен толеранс и диабет тип 2 [5]. Смята се, че комбинация от повишени нива на андрогени и инсулин допринася за патофизиологията на СПКЯ [5]. Хиперандрогенемията (HA) включва биохимичния отличителен белег на СПКЯ с повишени нива на свободен тестостерон, отчитащи по-голямата част от необичайните лабораторни находки при жени с олигоменорея [6].
Излишното телесно тегло е свързано с НА [7]. Освен това, хиперинсулинемията при жени със затлъстяване може директно да повиши нивата на свободен тестостерон чрез намаляване на синтеза на глобулин, свързващ половите хормони в черния дроб [8]. От друга страна, модели на гризачи са показали, че HA насърчава инсулиновата резистентност, намалява разхода на енергия и съответно увеличава риска от коремно затлъстяване и метаболитни рискови фактори [9, 10]. В мултиетническа извадка от повече от 2500 американски жени на възраст между 42 и 52 години олигоменореята се свързва с метаболитния синдром (MetS) само когато съвпада с HA [11]. Обратно, жените с HA са имали значително повишен риск от MetS, независимо от състоянието на менструалната честота [11].
Отговорът на яйчниците към лутеинизиращия хормон (LH) е основният източник на повишени андрогени при СПКЯ [12]. Също така, повишеният отговор на надбъбречните стероиди при жени с СПКЯ, поддържан само с надбъбречна стимулация на ACTH, предполага вторичен ефект на увеличеното производство на надбъбречни андрогени, а не на вроден ензимен дефицит на надбъбречната жлеза [13].
Не е ясно как HA може да повлияе на сърдечно-съдовите заболявания. Коремни жени със затлъстяване със СПКЯ се считат за изложени на висок риск от сърдечно-съдови заболявания и се съобщава за положителна връзка между коронарната артериална болест и клиничната хиперандрогения (хирзутизъм и акне) [14]. От друга страна, популационно проучване показва, че жените с наднормено тегло в пременопауза с PCOS нямат по-висок риск от коронарна артериална болест от тези без PCOS [15]. Независимо от това, жените с PCOS и HA имат по-висока честота на затлъстяване и неблагоприятни метаболитни аномалии в сравнение с тези без HA [16]. Доколкото ни е известно, нито едно предишно проучване не е оценило въздействието на HA върху MetS, независимо от наличието или отсъствието на PCOS сред затлъстелите жени.
Основната цел на това проучване е да се изследва дали лечението, търсещо предменопаузални жени със затлъстяване с HA, има по-високи шансове за MetS и неговите компоненти (нисък HDL-холестерол, хипертриглицеридемия, повишено кръвно налягане и дисгликемия), отколкото жени без HA, независимо от състоянието на PCOS.
Методи
Проектиране и проучване на популацията
Общо 2681 последователно лечение, търсещо пациенти със затлъстяване със затлъстяване, посещаващи Центъра за болест при затлъстяване в Vestfold Hospital Trust, Норвегия, през периода от 28 ноември 2005 г. до 28 юли 2014 г. са оценени за допустимост. За да се избегне биологично пристрастие за включване на жени преди и след менопаузата, ние изключихме 743 жени ≥50 години [17–19]. Липсват данни за HA за 38 жени (PCOS отсъства n = 34 и PCOS присъства n = 4), оставяйки 1900 болестно затлъстели жени в репродуктивна възраст да бъдат включени в този анализ на напречното сечение. Изследването е одобрено от Регионалния комитет по етика на медицинските и здравни изследвания (S-05175). Участниците бяха включени след предоставяне на писмено информирано съгласие и проучването беше проведено в съответствие с Декларацията от Хелзинки [20].
Дефиниции
Дефинирахме MetS съгласно съвместното междинно изявление на Международната диабетна федерация на работната група по епидемиология и превенция; Национален институт за сърце, бял дроб и кръв; Американска сърдечна асоциация; Световна сърдечна федерация; Международно общество за атеросклероза; и Международна асоциация за изследване на затлъстяването (2009); ако WC ≥ 80 cm в комбинация с минимум два от четири критерия: 1) нисък HDL-холестерол; HDL-холестеролът 0.6) се определя като притежаващ НА [25]. Жените с предварително диагностициран СПКЯ и тези с FTI> 0,6 или хирзутизъм, комбиниран с олиго-/ановулация, са определени като имащи СПКЯ [16, 26].
Събиране на данни
Пациентите са измервали теглото и ръста си, облечени в леки дрехи, без обувки и впоследствие е изчислен ИТМ (kg/m 2). Измерихме WC по средата между най-ниския ръб на ребрата и гребена на илиачната кост. Кръвното налягане се измерва с подходящ маншет след поне 5 минути почивка с пациент, седнал в изправено положение. Регистрирани са три измервания и в изследването е използвана средната стойност на второто и третото измерване. Всички антропометрични и кръвни измервания са извършени от обучен персонал за изследване.
Лабораторен анализ
Кръвни проби бяха получени чрез венепункция след едно нощно гладуване и събрани в Vacutainers® гел епруветки. Серумът се отделя от клетките в рамките на два часа.
Статистически анализ
Данните са представени като средно (SD) или пропорции. Непрекъснатите и категориални променливи бяха сравнени с помощта на независими проби t-тест и χ 2 тест или точен тест на Fisher, както е подходящо. Корелациите бяха изчислени с коефициента на корелация на Pearson (r) за нормално разпределени променливи и Spearman’s Rho (ρ) за ненормално разпределени променливи. Бяха анализирани демографски, антропометрични и метаболитни променливи, включително цялата популация на изследването и след стратификация за наличие или отсъствие на PCOS.
MetS и неговите компоненти са моделирани като зависими променливи, а HA като основна обяснителна променлива. Връзката между HA и MetS е коригирана за значителни объркващи фактори, идентифицирани с помощта на обратна логистична регресия. Променливите с р-стойности под 0,10 бяха включени в окончателния модел (тест на Wald). Следователно, коронарна артериална болест (да/не), използване на преднизолон (да/не), хронична обструктивна белодробна болест (да/не), болки в ставите (да/не), използване на естрогени или гестагенни лекарства (да/не) и тиреостимулиращият хормон е премахнат от регресионния модел. Моделите бяха коригирани за следните ковариати в крайния мултивариативен анализ: възраст (години), фамилна анамнеза за диабет (да/не), пикочна киселина (μmol/L), тревожност или депресия (да/не), холелитиаза (да/не), анамнеза за тютюнопушене (настоящо или предишно/никога), физическа активност (≥1 час енергично физическа активност/седмица), паратиреоиден хормон (pmol/L) и витамин D-25-OH (nmol/L). Решихме да не приспособяваме към WC и HOMA IR, за да избегнем възможността за прекомерно приспособяване от променливи, за които е известно, че са в причинно-следствената пътека между HA и MetS [10, 28].
Използвани са едномерни и многовариантни модели на логистична регресия за оценка на връзките между HA и MetS и нейните компоненти (хипертриглицеридемия, нисък HDL-холестерол, повишено кръвно налягане и дисгликемия) при всички 1900 пациенти. В допълнение, анализите се повтарят съответно в подгрупа от жени със затлъстяване без PCOS и друга група с PCOS. Възможни модификации на ефекта по възраст и PCOS бяха изследвани чрез включване на продуктите възраст * HA и PCOS * HA като термини за взаимодействие в многовариационните анализи с MetS като зависима променлива.
Доброто прилягане беше тествано с помощта на теста Hosmer и Lemeshow. P-стойностите под 0,05 се считат за статистически значими. Поради значителния брой проведени статистически тестове, особено внимание трябва да се насочи към по-малките P-стойности, т.е. тези под 0,01. Анализите бяха приложени с помощта на статистиката на IBM SPSS 20.
Резултати
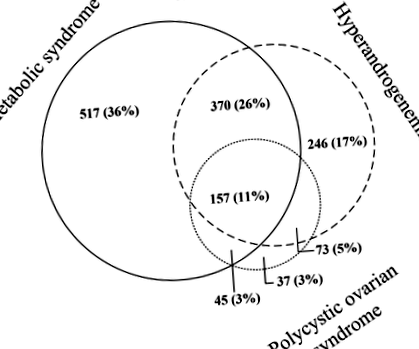
Общо 1089 (57%), 846 (45%) и 312 (16%) от 1900 пациенти с болестно затлъстяване на възраст под 50 години (средна възраст 37 [SD 8] години) са имали съответно MetS, HA и PCOS. Общо 1445 жени са имали или метаболитен синдром (MetS), хиперандрогенемия (HA) или синдром на поликистозни яйчници (PCOS), докато 455 жени не са имали нито MetS, HA или PCOS. Припокриването на жени с MetS, HA и PCOS е представено на фиг. 1.
Фигурата показва припокриването между 1445 жени, характеризиращи се с метаболитен синдром, синдром на поликистозните яйчници и хиперандрогенемия (HA). Жени без никое от тези състояния (n = 455) не са включени във фиг. 1
В цялата популация на проучването жените с НА са по-млади (средна [SD] възраст 34 [1] срещу 39 [2] години, стр Таблица 1 Характеристика на пациента според наличието или отсъствието на синдром на поликистозните яйчници (PCOS) и хиперандрогенемия (HA)
Делът на жените с НА е намалял от 80% (фиг. 2
FTI корелира слабо с HDL-холестерол, систолично кръвно налягане и диастолично кръвно налягане (r = 0,10, стр 0,111). Не открихме значими взаимодействия между HA и възрастта (стр = 0.834) или между HA и PCOS (стр = 0,527).
В едновариантния анализ HA е свързан с 1,5 пъти увеличен шанс за MetS (OR 1,45 [95% CI 1,20, 1,74]). Тази връзка остава статистически значима след корекции за възможни объркващи фактори (1.61 [1.27, 2.02]) (Таблица 2 и Фигура 3А). Нещо повече, НА се свързва с приблизително 1,5 пъти увеличени коригирани шансове за дисгликемия (1,65 [1,28, 2,11]), нисък HDL-холестерол (1,58 [1,27, 1,97]) и хипертриглицеридемия (1,43 [1,15, 1,79]). НА не е свързано с повишено кръвно налягане (1,06 [0,85, 1,34]). Под-анализ на 1588 жени без СПКЯ показва, че НА остава значително свързана с MetS (OR 1.52 [95% CI 1.18, 1.96), дисгликемия (1.71 [1.30, 2.25]), нисък HDL-холестерол (1.55 [1.22, 1.98] ) и хипертриглицеридемия (1.36 [1.06, 1.74]) (Фиг. 3В). За разлика от това, HA не е нито свързана значително с MetS, нито неговите компоненти при жени с PCOS (фиг. 3C).
Фигурата показва мултипроменливите коефициенти на шансове с 95% доверителни интервали (OR [95% CI]) за метаболитен синдром (MetS) и неговите компоненти при пациенти със затлъстяване със затлъстяване с хиперандрогенемия в сравнение с жени без хиперандрогенемия (HA) (справка) Панел А включва всички жени, включени в проучването (н = 1900), докато панел В и С включва жени, включени в поданализите; PCOS отсъства (н = 1588) и PCOS (н = 312)
Дискусия
Основната и новаторска констатация на това проучване на бели, болни с наднормено тегло жени в пременопауза, е, че НА е свързана с 61% увеличени коригирани шансове на MetS и че тази асоциация се дължи главно на повишени шансове за дисгликемия и дислипидемия. Въпреки че разпространението на HA намалява, докато разпространението на MetS се увеличава с увеличаване на възрастта, HA остава независим предиктор на MetS и неговите компоненти, дисгликемия и дислипидемия.
Хиперандрогенемия и метаболитният синдром
Резултатите от настоящото проучване съвпадат с друго напречно сечение на 2543 жени с мултиетнично наднормено тегло преди и перименопауза, които са били на средна възраст с десет години по-възрастни от участниците в настоящото проучване (съответно 46 срещу 37 години) [11]. В предишното проучване, жените с НА, независимо от менструалния цикъл, са имали 1,5 пъти повишен риск от MetS в сравнение с тези без НА [11]. Жените както с олигоменорея, така и с HA имали двойно увеличен шанс за MetS [11]. В нашия субанализ на 1588 жени със затлъстяване без СПКЯ, HA остава важен предиктор за MetS, дисгликемия, нисък HDL-холестерол и хипертриглицеридемия. За разлика от това, при скорошно проучване на жени в пременопауза не е разкрита връзка между излишъка на андроген, менструалното нарушение и инцидентния MetS или самоотчитане на сърдечно-съдови заболявания [28].
Възможни механизми, свързващи хиперандрогенемия с инсулинова резистентност и висцерално затлъстяване
Проучванията върху животни (гризачи) показват, че андрогените могат да предизвикат инсулинова резистентност чрез директни ефекти върху скелетните мускули и мастната тъкан, медиирани от промени в синтеза на инсулиновия рецептор - гликоген, чрез промяна на секрецията на адипокин и чрез увеличаване на висцералното затлъстяване [9]. Освен това, малко проучване на 13 жени със затлъстяване и 30 жени с наднормено тегло показва, че антиандрогенното лечение отчасти обръща периферната инсулинова резистентност само при жени без наднормено тегло, докато централното затлъстяване може да има пряка роля в андрогенната хиперсекреция [29, 30]. Също така, скорошно проучване на млади жени с наднормено тегло предполага, че връзката между телесните мазнини и НА е медиирана предимно от инсулинова резистентност [24]. Взаимовръзките между телесните мазнини, инсулиновата резистентност и НА допринасят за сложния модел, което прави трудна задача да се определи ролята на всеки компонент. Въпреки че констатациите на Tosi et al. може да не е пряко сравнима с нашата, ние също съобщаваме за слаба, но значителна връзка между инсулиновата резистентност и HOMA IR и FTI. Съответно, въпреки че HA е независимо свързан с MetS, инсулиновата резистентност може отчасти да е медиирала този ефект.
Асоциация между хиперандрогенемия и дислипидемия
Нашето проучване демонстрира значителна обратна връзка между нивата на HA и HDL-холестерол, което е в съответствие с предишни проучвания на жени с PCOS [31, 32]. Намалени нива на HDL-холестерол също са докладвани при жени в пери- и постменопауза, получаващи андрогенни състави, добавени към хормонозаместителна терапия и след лечение с трансдермален тестостерон [33, 34]. Освен това, ниските нива на SHBG при жени с СПКЯ са свързани с ниски нива на HDL-холестерол, независимо от инсулиновата резистентност и затлъстяването [35]. И обратно, скорошно проучване на млади жени с наднормено тегло не показва разлики в дислипидемията при жени с НА в сравнение с жени без НА [24]. По този начин въздействието на HA върху дислипидемия остава неясно и са необходими по-нататъшни изследвания.
Хиперандрогенемия и дисгликемия
Делът на жените с НА намалява, докато делът на жените с дисгликемия се увеличава с възрастта (фиг. 2). Въпреки това открихме значителна връзка между HA и дисгликемия, независимо от възрастта.
Проучванията показват висок процент на конверсия от нарушен глюкозен толеранс към захарен диабет при жени с СПКЯ [36, 37]. Нашите констатации демонстрират, че жените със и без СПКЯ са имали сравнително разпространение на дисгликемия. Въпреки това, пациентите с HA са имали приблизително 65% повишени шансове за дисгликемия в сравнение с тези без HA и връзката е засилена след изключването на жени с PCOS. Тези открития подкрепят хипотезата, че НА може да участва в патофизиологията на дисгликемията, независимо от състоянието на СПКЯ.
Хиперандрогенемия и кръвно налягане
Не открихме значителна връзка между НА и повишеното кръвно налягане. Това е в контраст с резултатите от проучване на млади азиатски жени с нормално до наднормено тегло с PCOS, което демонстрира, че високите бионалични нива на тестостерон са свързани с повишено кръвно налягане [38]. В друго проучване на жени на нормално до наднормено тегло на средна възраст хирзутизмът на лицето е свързан с по-високо систолично кръвно налягане, докато хирзутизмът на крайниците е свързан с по-ниско диастолично кръвно налягане [39]. В настоящото проучване, предменопаузалните пациенти със затлъстяване с HA всъщност са по-малко склонни да използват лекарства за понижаване на кръвното налягане в сравнение с жените без HA (18% срещу 25%). Интересното е, че наскоро публикувано проучване на напречно сечение на шведски мъже и жени с нормално до наднормено тегло показва силна обратна връзка между кръвното налягане и SHBG, докато концентрацията на свободен тестостерон не е свързана с хипертония [40]. Авторите предполагат, че SHBG може да има директен ефект върху ендотелните клетки чрез рецептора за SHBG, но тази връзка е била значима само при жени в постменопауза на възраст ≥50 години [40]. За разлика от това, нашето проучване не показва никаква връзка между SHBG и повишеното кръвно налягане при жени в пременопауза (данните не са показани).
Силни страни и ограничения
Основната сила на настоящото проучване е голямата кохорта от последователно включено лечение, търсещо болно затлъстели жени. Участниците в проучването обаче бяха насочени към център за третична помощ за оценка и лечение с бариатрична хирургия, медицинска терапия или дългосрочна рехабилитация на начина на живот при болестно затлъстяване. Съответно, резултатите не могат да бъдат обобщени за общата популация със затлъстяване (т.е. субекти, които не търсят лечение).
Използвахме имуноанализ за измерване на тестостерон. Въпреки че конвенционалните имуноанализи измерват надежден тестостерон при високи нива, се съобщава, че имуноанализите са по-малко надеждни при ниски концентрации [41]. Процедурата за разделяне на диетиловата екстракция обаче се извършва ръчно и по този начин трябва да намали броя на фалшиво повишените резултати.
Освен това, въпреки че дефинирахме FTI> 0,6 като НА в настоящото проучване, други адренокортикални предшественици стероиди, включително прегненолон, 17-хидроксипрегненолон, дехидроепиандростерон (DHEA), андростендион, 11-дезоксикортизол и кортизол може да са допринесли за клиничните прояви на НА. Независимо от това нивата на свободен тестостерон остават преобладаващата лабораторна находка при жени с олигоменорея, а яйчниците са основният източник на излишък на андроген при жени със и без СПКЯ [6, 12].
За съжаление нямахме точни данни за менопаузата. Има някои доказателства, че по-високият ИТМ може да причини по-късна менопауза. Едно проучване съобщава, че затлъстелите жени (ИТМ ≥30 kg/m 2) са имали средна възраст при менопауза от 53 години [17]. Следователно, като се изключат жени над 50-годишна възраст, някои болестно затлъстели жени в пременопауза може да са останали извън нашия анализ.
И накрая, по-голямата част (97%) от заболелите от затлъстяване жени са били от бялата раса и като такива резултатите от може да не са приложими за жени от други етнически групи.
Заключение
В това проучване разпространението на MetS, PCOS и HA е високо сред заболелите жени със затлъстяване
- Пикочна киселина, метаболитен синдром и бъбречна болест Американско общество по нефрология
- Какво представлява критериите за метаболитен синдром, симптоми, диета и лечение
- Триетапна лапароскопска хирургия при болно затлъстял пациент с дивертикулит на Hinchey III в случай
- Метаболитният синдром Медицина на Джон Хопкинс
- Затлъстелите видове - специален брой за модели на заболяванията, свързани със затлъстяването и метаболизма; Механизми