Фернандо М март
1 Nerve Regeneration Group, Instituto de Biologia Molecular e Celular-IBMC, Университет в Порто, Порто, Португалия
Азад Бони
2 Харвардско медицинско училище, Бостън, Масачузетс, САЩ
3 Медицинско училище във Вашингтон, Сейнт Луис, Мисури, САЩ
Mónica M Sousa
1 Nerve Regeneration Group, Instituto de Biologia Molecular e Celular-IBMC, Университет в Порто, Порто, Португалия
Резюме
Въпреки че невроните изпълняват вътрешно присъща програма за растеж на аксоните по време на развитието, след установяването на връзки, капацитетът за растеж на развитието намалява. Освен предизвикателствата за околната среда, този превключвател до голяма степен обяснява и неуспеха на регенерирането на аксоните на централната нервна система (ЦНС) при възрастни. Тук ние обсъждаме вътрешния вътрешен контрол на регенерацията на аксоните, включително не само регулирането на транскрипционните и епигенетичните механизми, но и модулацията на местния протеинов транслация, ретрограден и антерограден аксонен транспорт и динамиката на микротубулите. По-нататък изследваме причините, които са в основата на неуспеха на невроните на ЦНС да създадат енергичен регенеративен отговор и парадигмите, демонстриращи активирането на вътрешните програми за растеж на аксоните. И накрая, представяме потенциални механизми за подпомагане на регенерацията на аксони, тъй като те могат да представляват бъдещи терапевтични подходи за насърчаване на възстановяването след нараняване и заболяване на ЦНС.
Въведение
Вътрешни клетъчни механизми на аксонална регенерация в ПНС
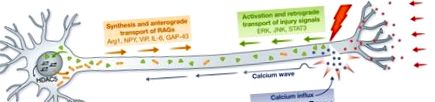
Притокът на калций в аксоплазмата е един от първите сигнали, причинени от нараняване, и деполяризацията, предизвикана от инверсията на калциево-натриевия поток, преминава по аксона към клетъчното тяло. Притокът на калций тук се обсъжда в контекста на вътрешните фактори, които управляват регенерацията на аксоните, тъй като той предизвиква различни автономни механизми на клетките, необходими за успешния растеж на аксоните, вариращи от регулирането на вътреклетъчните пътища до генерирането на епигенетични промени. При сензорните неврони на Caenorhabditis elegans амплитудата на аксоновите калциеви вълни корелира със степента на регенерация и обратно, инхибирането на напрежените калциеви канали или на освобождаването на калций от вътрешните запаси, намалява регенеративния растеж на аксоните [3]. Въпреки че последиците от електрическата стимулация водят до противоречиви резултати, вероятно поради разлики в парадигмите на стимулация, слаб стимул може да подобри регенерацията на моторни плъхове [4] и сензорни неврони [5]. Въпреки това, силен електрически импулс, имитиращ физиологичната активност на невроните на гръбните корени на гръбначните кости на възрастни гризачи (DRG), силно инхибира израстването на аксона, а загубата на електрическа активност след нараняване на ПНС насърчава регенерацията на аксоните в ПНС [6].
Потискането на удължаването на аксоните може да бъде облекчено при нараняване чрез прекъсване на получените от целта негативни сигнали за нараняване и електрическа активност. Притокът на калций в аксоплазмата активира cAMP и PKA, сигнализирайки за DLK-1 и насърчавайки образуването на конус на растежа, локален синтез на протеини и повторно запечатване на аксоналната мембрана. Калциевата вълна се разпространява обратно в клетъчното тяло, което води до ядрен износ HDAC5, активирайки прорегенеративната програма за транскрипция. След зависимата от калция ранна фаза се получава ретрограден транспорт на сигнали за нараняване, включително ERK, JNK и STAT3. В клетъчното тяло се изразяват RAG (Arg1, NPY, VIP, IL-6, GAP-43, наред с други), които са необходими за монтиране на регенеративен отговор. сАМР, цикличен аденозин монофосфат; DLK-1, двойна левцин цип киназа 1; ERK, извънклетъчна сигнално-регулирана киназа; HDAC5, хистонова деацетилаза 5; JNK, c-Jun амино-терминална киназа; RAG, свързан с регенерацията ген.
Ретрограден транспорт на локално активирани сигнали за нараняване
След нараняване се активира локален протеинов синтез. Аксотомията задейства транслацията на мРНК на импортин β1 и виментин. Виментин свързва pERK с комплекс импортин-динеин, така че сигналът за нараняване се транспортира ретроградно към клетъчното тяло. ZBP1 е необходим за аксоналната локализация на β-актин и GAP-43 иРНК, които се транслират след нараняване. Увеличеният антерограден транспорт на митохондриите също се предизвиква от нараняване. GAP-43, протеин-43, свързан с растежа; pERK, фосфорилирана извънклетъчна сигнално-регулирана киназа; ZBP1, свързващ пощенски код протеин 1.
Отговорът на увреждане на нервите разчита на активирането на множество транскрипционни фактори. Някои от транскрипционните фактори се активират от горните сигнали за нараняване. ERK активира протеин, съдържащ ETS домейн (Elk-1) [26], докато JNK активира c-Jun и активира транскрипционен фактор 3 (ATF3) [32]. Други фактори на транскрипция, участващи в регенеративния отговор, също са идентифицирани при анализи с използване на DRG неврони на плъхове и мишки, включително свързващ елемент протеин на CAMP отговор (CREB) [31], свързан с SRY HMG-бокс (Sox11) [33], фосфатидилинозитол 3 -киназа (PI3K) и Smad1 [13, 34]. Заедно те променят транскрипционния профил на увредените неврони, допринасяйки за тяхното оцеляване и регенерация [33]. В този контекст и интегрирането на предишни данни е демонстрирано, че нараняването с ПНС активира PI3K сигнализиране, което води до инактивиране на гликоген синтаза киназа 3 (GSK3) и предполага, че пътят PI3K-GSK3-Smad1 е от основно значение за насърчаване на регенерацията на сензорния аксон [ 13]. Активираните транскрипционни фактори също индуцират експресията на няколко RAG, включително аргиназа-1 [34], NPY, VIP [35], интерлевкин-6 (IL-6) [36], GAP-43 и CAP-23 [37], наред с други (фиг. 1).
В резултат на нараняване, прекъсването на ретрограден транспорт на негативни сигнали за нараняване, евентуално получени от целта молекули, може да освободи невроните от репресията, за да се удължи, позволявайки да се осъществи регенерация. В този контекст е демонстрирано, че след лезия, намаляването на нивата на фактор на растеж на нервите (NGF) в симпатиковите и сензорните неврони допринася за повишените нива на експресия на невропептиди [38]. По същия начин спирането на електрическата активност след периферна лезия допринася за регенеративния отговор [6]. Като такива, получените от целта NGF и електрическата активност се разглеждат като отрицателни сигнали за нараняване. В обобщение, в допълнение към наличието на сигнали за нараняване, насърчаващи регенерацията, при възрастни наивни неврони на ПНС репресията на удължаването на аксоните може да бъде облекчена при нараняване.
Антерограден аксонен транспорт за ефективен регенеративен отговор
Въпреки дискутираните доказателства, които предполагат, че аксоналният транспорт играе централна роля по време на регенерацията на аксоните, модулацията на транспорта от нараняване не е добре разбрана. По-конкретно, предстои да бъдат установени механизмите, които са в основата на увеличаването на аксоналния транспорт след увреждане на ПНС, а бъдещите проучвания трябва да определят дали молекулните двигатели са засегнати от лезия или, ако е алтернативно, микротрубочните следи са модифицирани.
Пощенски кодове и локален синтез на протеини по време на аксонова регенерация
Защо невроните на ЦНС не могат да създадат стабилна регенеративна програма?
За разлика от ПНС, ранените аксони на ЦНС имат ограничена способност за регенерация. Освен образуването на силно инхибиторен глиален белег, могат да се предложат няколко разлики, които да обяснят тази липса на регенеративен капацитет, включително неефективна дегенерация на Валер, възможни дефекти в сигнализирането за нараняване, липса на силна реакция на нараняване, ограничен капацитет за локален синтез на протеини, и съществуването на инхибитори на аксоналния растеж. Всъщност невроните на ЦНС на плъхове не успяват да активират ефективно много от гените, необходими за регенерацията на аксоните [54]. Интересното е, че промените в калция в клетъчното тяло имат по-висока амплитуда и продължителност при DRG на плъхове в сравнение с кортикалните неврони [55], а DRG невроните могат да преживеят дълги периоди на високо съдържание на калций, докато те са вредни за невроните на ЦНС [56]. Освен това, повишеното ацетилиране на хистон не се случва в ганглиозните клетки на ретината (RGCs) [10]. Заедно тези разлики могат да допринесат за неуспеха при активиране на прорегенеративна програма (Фигура 3).
По време на развитието, чрез вътрешна програма за клетки, съставена от множество пътища, невроните показват силен капацитет за удължаване. След установяването на връзки, възрастните неврони на ЦНС имат ограничена регенеративна способност като последица от намалените промени в калция, липса на повишаване на ацетилирането на хистон, липса на силен синтез на RAG, ограничен локален протеинов синтез и наличие на инхибитори на възстановяването на аксона (PTEN, SOCS3 и EFA-6). Възрастните PNS неврони обаче имат висок вътрешен капацитет за растеж като последица от активирането на специфична програма за регенерация и вероятно също чрез рекапитулация на пътища, свързани с развитието. ЦНС, централна нервна система; EFA-6, коефициент на обмен за Arf6; ПНС, периферна нервна система; PTEN, фосфатаза и тензин хомолог; RAG, свързан с регенерацията ген; SOCS3, супресор на цитокиновата сигнализация 3.
Чрез анализа на регенерацията на аксона в различни мутантни миши линии, е доказано, че делецията на супресора на цитокиновата сигнализация 3 (SOCS3), инхибитор на JAK-STAT3 пътя, насърчава стабилната регенерация на увредените аксони на зрителния нерв [60]. За отбелязване е, че едновременното изтриване на PTEN и SOCS3 допълнително увеличава регенерацията на аксоните, тъй като тези сигнали регулират два независими пътя, които действат синергично [61]. В обобщение, mTOR и STAT3 пътищата се появяват като ключови регулатори, насърчаващи регенерацията на аксони на дълги разстояния в ЦНС за възрастни. Укрепвайки този възглед, делецията на PTEN или SOCS3 подобрява регенерацията на отделни аксони на ЦНС [57, 60, 62, 63], а трайното активиране на STAT3 насърчава кортикоспиналното ремоделиране и функционалното възстановяване след увреждане на гръбначния мозък [64]. Напоследък при механично-сензорните неврони на C. elegans се съобщава, че консервираният фактор на гуанин-нуклеотиден обмен EFA-6 е вътрешен инхибитор на възстановяването на аксона, който действа чрез въздействие върху динамиката на аксоналните микротубули, действащ след и/или паралелно с DLK- 1 [65].
Заедно тези проучвания показват, че регенерацията на аксоните се ограничава не само от външни инхибиращи сигнали, но и от вътрешни фактори. Като такава, манипулацията на вътрешните пътища за контрол на растежа се преследва активно като терапевтичен подход за насърчаване на регенерацията на аксона след нараняване на ЦНС.
Капацитетът за вътрешен растеж на клетките на възрастните неврони на ЦНС може да бъде активиран
Освен сАМР, няколко проучвания са идентифицирали широки промени в генната експресия в обусловени от гризачи неврони [36, 69], регулирани от активирането на множество транскрипционни фактори [76]. Надолу по веригата се предизвиква експресията на традиционни RAG, като GAP-43 и CAP-23 [77] и са идентифицирани нови RAG, използващи този модел, включително аргиназа-1 [34] и IL-6 [36]. Нито един от идентифицираните транскрипционни фактори или RAGs не възпроизвежда целия ефект на кондициониране [74], което предполага, че кондиционирането не може да бъде имитирано чрез манипулиране на един път. В подкрепа на тази гледна точка епигенетичните промени, предизвикани от ядрения износ HDAC5, частично възпроизвеждат ефекта на кондиционната лезия [10]. Остават отворени няколко въпроса, включително разликите в сигнализирането, причинено от нараняване, което позволява на периферно увреждане да предизвика силна реакция на регенерация, докато централната лезия на същия неврон не успява да го направи (Sidebar A).
Манипулиране на динамиката на аксоналните микротубули за насърчаване на регенерацията
Много от пътищата, които допринасят за вътрешния вътрешен контрол на регенерацията, участват в ремоделирането на аксоналния цитоскелет, по-специално чрез модулиране на динамиката на микротубулите. Като такива активно се преследват потенциални терапевтични стратегии, които се намесват на нивото на свързаните с микротубули протеини. В това отношение и освен тези, които вече са обсъдени в този преглед, включително HDAC5 и 6, са идентифицирани няколко други възможни цели, включително GSK3β, тъй като много от неговите субстрати са протеини, взаимодействащи с микротубули [84].
Членовете на семейството на кинезините също са изтъкнати като важни играчи в регулирането на динамиката на микротубулите по време на аксоналната регенерация. Доказано е, че KIF3C е специфичен за нараняване кинезин с функция за дестабилизиране на микротубули, играещ ключова роля по време на повторното израстване на аксона [83]. Изчерпването на KIF3C в невроните за възрастни води до увеличаване на стабилни и затворени микротубули и забавя регенерацията на аксоните след нараняване [83]. В допълнение към KIF3C, в механосензорните аксони на C. elegans, деполимеризиращият член на семейство 7 на подобен на кинезин протеин (KLP-7) ограничава растежа на микротубулите в стабилно състояние [85]. След нараняване на аксона, броят на нарастващите микротубули се увеличава на мястото на нараняване, едновременно с понижаването на регулирането на KLP-7, в каскада, координирана от DLK-1 [85]. Този механизъм е предложен, за да позволи на стабилния микротубулен цитоскелет на зрял неврон да се превърне в динамично нарастващия микротубулен цитоскелет на регенериращ аксон.
Освен важността на идентифицирането на взаимодействащите с микротубули протеини, които участват или във формирането на ретракционна крушка, или на конус на растеж, е необходим допълнителен анализ на регулирането на посттранслационните модификации на микротубулите след нараняване, тъй като те контролират динамиката на микротубулите и могат също да повлияят с аксонален транспорт, поради което влияе върху повторното израстване на аксоните.
Заключения и перспективи
Последните доказателства, получени чрез систематичен генетичен скрининг при C. elegans, показват, че освен задействането на програми за развитие, които могат да бъдат потиснати в зрели неврони, регенеративният растеж включва специфични пътища, които усещат и специфично реагират на увреждане [65] (Фигура 3). Въпреки че регенерацията на аксоните не може да се разглежда като обикновена рекапитулация на удължаване на аксоните по време на развитието, някои от оперативните механизми се споделят. Растежът на аксоните по време на развитието се осъществява в две различни фази: начална фаза на растеж и по-късна фаза, която се извършва по време на резитбата [86]. Растежът на аксоните по време на ремоделиране на развитието изглежда механично различен от първоначалното израстване на аксон. Интересното е, че общите пътища, например mTOR сигнализиране, функционират по време на възстановяването на аксона в развитието и регенерацията на аксона [86].
Пътят на комплекса за насърчаване на убиквитин лигаза Cdh1-анафаза (Cdh1-APC) също е критичен вътрешен механизъм на клетките, който регулира растежа на аксоните в мозъчната кора на мозъка, развиваща се [87]. Инхибирането на Cdh1-APC в първичните неврони усилва растежа на аксоните и също така отменя инхибирането на миелина на възстановяването на аксона [87]. Възможно е Cdh1-APC следователно да потенциално ограничи растежа на аксоните в ЦНС за възрастни. В ключови последващи проучвания транскрипционният регулатор SnoN е идентифициран като критичен субстрат на Cdh1-APC в невроните [88], работещ по път, който се регулира чрез трансформиране на сигнала за растежен фактор β-Smad2 [89]. Smad2 нокдаун също отменя инхибирането на миелина на растежа на аксони [89]. Съвсем наскоро беше доказано, че експресията на мутант SnoN, устойчив на разграждане, засилва аксоналната регенерация след увреждане на гръбначния мозък при плъхове [90]. Заедно тези открития повдигат вълнуващата перспектива, че пътищата, работещи по време на развитието, също могат да доведат до регенерация на аксоните след нараняване. Терапевтичните стратегии, насочени към реактивиране на тези пътища при увредени неврони на ЦНС, могат да бъдат успешни при повишаване на способността ни да регенерираме неврони в отговор на нараняване или заболяване.
Странична лента А. Има нужда от отговори
Как се модифицира аксоналният транспорт при нараняване? По-конкретно, какви са механизмите в основата на увеличения аксонален транспорт след нараняване на ПНС? Засегнати ли са молекулярните двигатели или променените модификации на микротрабулите след транслация?
Какви са разликите в сигнализирането, причинено от нараняване, което позволява увреждането на периферния клон на DRG невроните да предизвика силна реакция на регенерация, докато лезията на централния клон не успява да предизвика този отговор?
Има ли причинно-следствена връзка между регенерацията на аксона и динамиката на микротубулите?
Рекапитулирани ли са пътищата на развитие по време на аксонална регенерация след нараняване?
Благодарности
Извиняваме се на всички колеги, чиято работа не може да бъде цитирана поради ограничени пространства. Благодарим на д-р Валерия Кавали (Медицинско училище във Вашингтон) за критичното четене на ръкописа. Авторите бяха подкрепени от FEDER чрез COMPETE и от FCT (Проект FCOMP-01-0124-FEDER-017455; HMSP-ICT/0020/2010 на M.M.S. и A.B.). М.М.С. също се поддържа от FCOMP-01-0124-FEDER-015781; PTDC/SAU-GMG/111761/2009 и от Международната фондация за изследване на параплегия. А.Б. се поддържа и от NIH Grant NS051255.
Терминологичен речник
| АКТ | протеинкиназа В |
| APC | комплекс за насърчаване на анафазата |
| Arg1 | аргиназа 1 |
| ATF3 | активиращ транскрипционен фактор 3 |
| лагер | цикличен аденозин монофосфат |
| ЦНС | Централна нервна система |
| КРЕБ | протеин, свързващ елемент сАМР отговор |
| DLK | двойна левцин цип киназа |
| ДРГ | гръбни коренни ганглии |
| EFA-6 | обменен коефициент за Arf6 |
| Елк-1 | ETS домейн съдържащ протеин |
| ERK | извънклетъчна сигнално-регулирана киназа |
| GAP-43 | свързан с растежа протеин-43 |
| GSK3 | гликоген синтаза киназа 3 |
| HDAC | хистонова деацетилаза |
| IL-6 | интерлевкин-6 |
| JAK | janus киназа |
| JNK | c-Jun амино-терминална киназа |
| KIF3C | член на семейството на кинезин 3С |
| KLP-7 | кинезин-подобен протеин 7 |
| КАРТА1В | свързан с микротубули протеин 1В |
| КАРТА | митоген-активирана протеин киназа |
| mTOR | мишена на рапамицин при бозайници |
| NLS | сигнал за ядрена локализация |
| NPY | невропептид Y |
| PI3K | фосфатидилинозитол 3-киназа |
| PKA | протеинкиназа А |
| PKC | протеинкиназа С |
| PNS | периферна нервна система |
| PTEN | фосфатаза и хомолог на тензин |
| RAG | свързан с регенерацията ген |
| RanBP1 | Ras-свързан ядрен протеинов свързващ протеин 1 |
| RGC | ганглиална клетка на ретината |
| SC | бавен компонент на аксоналния транспорт |
| SOCS3 | супресор на цитокиновата сигнализация 3 |
| Sox11 | Свързана със SRY HMG-кутия 11 |
| STAT3 | сигнален преобразувател и активатор на транскрипция 3 |
| TSC2 | туберкулозен склерозен комплекс 2 |
| UTR | непреведен регион |
| ВИП | вазоинтестинален пептид |
| ZBP1 | протеин, свързващ пощенски код 1 |
Конфликт на интереси
Авторите декларират, че нямат конфликт на интереси.
- Хапчетата за контрол на раждаемостта карат жените да наддават на тегло
- Кучешка епилепсия - Използване на фенобарбитал за контролиране на гърчове при кучета
- Fit Body Control за контрол на теглото на малки породи Суха храна за кучета - Eukanuba
- Правете ли въглехидрати контрол на телесните мазнини
- Контролирайте зимния си апетит